北京市海淀区2022届高三二模化学试题
试卷更新日期:2022-06-06 类型:高考模拟
一、单选题
-
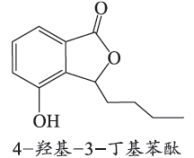
1. 中草药“当归”中含有4—羟基—3—丁基苯酞。下列关于该物质的说法正确的是( )
 A、能发生水解反应 B、分子式为C13H14O3 C、能与溴水发生取代和加成反应 D、能与NaHCO3溶液反应产生CO22. 氘()和氚()是氢的两种同位素,其中仅具有放射性。下列说法正确的是( )A、H2O的相对分子质量为18 B、H的中子数为1 C、H2O具有放射性 D、可用质谱区分H2和H23. 下列说法正确的是( )A、室温下,1L0.1mol·L-1盐酸中H+的数目约为6.02×1022 B、标准状况下,5.6LCCl4中所含C—Cl键的数目约为6.02×1023 C、5.6gFe和足量Cl2反应转移电子的物质的量为0.2mol D、室温下,pH相同的盐酸和硫酸中,溶质的物质的量浓度相同4. 下列方程式能准确解释事实的是( )A、钠在空气中加热生成淡黄色固体:4Na+O2=2Na2O B、硫酸铵溶液使蓝色石蕊试纸变红:NH+H2O=NH3•H2O+H+ C、氢氧化铜浊液中滴加氨水得到深蓝色溶液:Cu2++4NH3[Cu(NH3)4]2+ D、氢硫酸中通入适量Cl2得黄色沉淀:H2S+Cl2=S↓+2HCl5. 用圆底烧瓶收集NH3后进行喷泉实验。对实验现象的分析正确的是( )
A、能发生水解反应 B、分子式为C13H14O3 C、能与溴水发生取代和加成反应 D、能与NaHCO3溶液反应产生CO22. 氘()和氚()是氢的两种同位素,其中仅具有放射性。下列说法正确的是( )A、H2O的相对分子质量为18 B、H的中子数为1 C、H2O具有放射性 D、可用质谱区分H2和H23. 下列说法正确的是( )A、室温下,1L0.1mol·L-1盐酸中H+的数目约为6.02×1022 B、标准状况下,5.6LCCl4中所含C—Cl键的数目约为6.02×1023 C、5.6gFe和足量Cl2反应转移电子的物质的量为0.2mol D、室温下,pH相同的盐酸和硫酸中,溶质的物质的量浓度相同4. 下列方程式能准确解释事实的是( )A、钠在空气中加热生成淡黄色固体:4Na+O2=2Na2O B、硫酸铵溶液使蓝色石蕊试纸变红:NH+H2O=NH3•H2O+H+ C、氢氧化铜浊液中滴加氨水得到深蓝色溶液:Cu2++4NH3[Cu(NH3)4]2+ D、氢硫酸中通入适量Cl2得黄色沉淀:H2S+Cl2=S↓+2HCl5. 用圆底烧瓶收集NH3后进行喷泉实验。对实验现象的分析正确的是( ) A、烧瓶中形成喷泉,说明NH3与H2O发生了反应 B、烧瓶中剩余少量气体,能证明NH3的溶解已达饱和 C、烧瓶中溶液为红色的原因是:NH3+H2ONH3•H2ONH+OH- D、烧瓶中溶液露置在空气中一段时间后pH下降,能证明氨水具有挥发性6. 下列关于实验现象的解释或结论中,错误的是( )
A、烧瓶中形成喷泉,说明NH3与H2O发生了反应 B、烧瓶中剩余少量气体,能证明NH3的溶解已达饱和 C、烧瓶中溶液为红色的原因是:NH3+H2ONH3•H2ONH+OH- D、烧瓶中溶液露置在空气中一段时间后pH下降,能证明氨水具有挥发性6. 下列关于实验现象的解释或结论中,错误的是( )选项
实验操作
试剂A
现象
结论
A
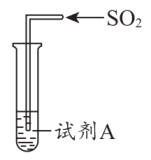
酸性KMnO4溶液
紫色褪去
SO2具有还原性
B
新制氯水
黄绿色褪去
SO2具有漂白性
C
H2S溶液
出现淡黄色浑浊
SO2具有氧化性
D
盐酸酸化的BaCl2溶液
无明显变化,一段时间后产生白色沉淀
硫元素从+4价被氧化到+6价
A、A B、B C、C D、D7. 科研人员提出了CO2羰基化合成甲醇的反应机理,其主要过程示意图如图(图中数字表示键长的数值)。
下列说法错误的是( )
A、该过程中,CO2被还原 B、该过程中发生了3次加成反应 C、由上图可知,化学键的键长会受到周围基团的影响 D、该过程原子利用率达到100%8. 氮化硼(BN)晶体存在如图所示的两种结构。六方氮化硼的结构与石墨类似;立方氮化硼的结构与金刚石类似,可作研磨剂。
下列说法错误的是( )
A、六方氮化硼层间的相互作用不属于化学键 B、六方氮化硼可做润滑剂 C、立方氮化硼晶胞中含有4个氮原子和4个硼原子 D、立方氮化硼晶胞中,N和B之间不存在配位键9. 聚氨酯是一种应用广泛的有机材料,可根据需求调节其硬度,其结构片段如图。 (R、R'表示短碳链,
(R、R'表示短碳链, 表示长碳链)
表示长碳链)下列有关聚氨酯的说法错误的是( )
A、聚氨酯在一定条件下能发生水解 B、聚氨酯中只含有酯基 C、聚氨酯链之间可形成氢键,增大材料的硬度 D、的值越大,聚氨酯材料的硬度越大10. 液流电池可以实现光伏发电和风力发电电能的储存和释放。一种非金属有机物液流电池的工作原理如图。
下列说法错误的是( )
A、放电时,正极反应式为Br2+2e-=2Br- B、放电时,物质a为AQDSH2 C、充电时,AQDS/AQDSH2储液罐中的pH减小,H+通过质子交换膜到达溴极室 D、增大储液罐体积,可提高液流电池的储能容量11. 向AgNO3溶液中通入过量SO2 , 过程和现象如图。
经检验,白色沉淀为Ag2SO3;灰色固体中含有Ag。
下列说法错误的是( )
A、①中生成白色沉淀的离子方程式为2Ag++SO2+H2O=Ag2SO3↓+2H+ B、①中未生成Ag2SO4 , 证明溶度积:Ksp(Ag2SO3)<Ksp(Ag2SO4) C、②中的现象体现了Ag+的氧化性 D、该实验条件下,SO2与AgNO3反应生成Ag2SO3的速率大于生成Ag的速率12. 氧化铈(CeO2)是应用广泛的稀土氧化物。一种用氟碳铈矿(CeFCO3 , 含BaO、SiO2等杂质)为原料制备CeO2 , 的工艺如图。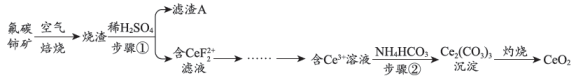
下列说法错误的是( )
A、滤渣A的主要成分为BaSO4和SiO2 B、步骤①、②中均有过滤操作 C、该过程中,铈元素的化合价变化了两次 D、步骤②反应的离子方程式为2Ce3++6HCO=Ce(CO3)3↓+3CO2↑+3H2O13. 工业上利用碳热还原BaSO4制得BaS,进而生产各种含钡化合物。温度对反应后组分的影响如图。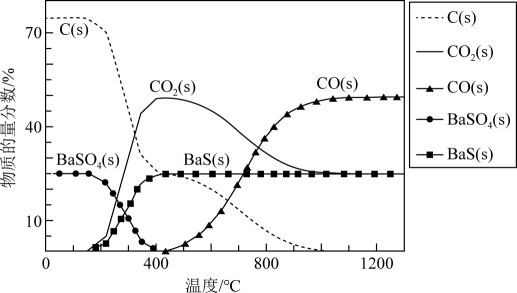
已知:碳热还原BaSO4过程中可能发生下列反应。
i.BaSO4(s)+2C(s)=2CO2(g)+BaS(s) △H1
ii.BaSO4(s)+4C(s)=4CO(g)+BaS(s) △H2=+571.2kJ·mol-1
iii.BaSO4(s)+4CO(g)=4CO2(g)+BaS(s) △H3=-118.8kJ·mol-1
下列关于碳热还原BaSO4过程的说法正确的是( )
A、△H1=+113.1kJ·mol-1 B、400℃后,反应后组分的变化是由C(s)+CO2(g)2CO(g)的移动导致的 C、温度升高,C(s)+CO2(g)2CO(g)的平衡常数K减小 D、反应过程中,生成的CO2和CO的物质的量之和始终等于投入C的物质的量14. 某小组同学用乙醛进行银镜反应实验时,补充做了以下实验。已知:[Ag(NH3)2]+Ag++2NH3

下列关于该实验的分析错误的是( )
A、实验①无需加热,说明碱性条件有利于银氨溶液与乙醛的反应 B、实验①中加入NaOH后,溶液中c(NH3)增大 C、实验表明,乙醛还原的是[Ag(NH3)2]+中的Ag(I) D、对比实验①和②知,形成[Ag(NH3)2]+后Ag(I)氧化性降低二、综合题
-
15. 空燃比是影响发动机油耗和污染物排放量的重要因素。
资料:i.空燃比是通入空气与燃料质量的比值,按化学计量数反应时的空燃比称为理论空燃比。
ii.2CO(g)+O2(g)=2CO2(g) △H=-566kJ·mol-1
(1)、若不完全燃烧时发生反应2C8H18(l)+23O2(g)=12CO2(g)+4CO(g)+18H2O(g)。①与完全燃烧相比,每2molC8H18不完全燃烧时少放出的能量为。
②为减少油耗,实际使用过程中的空燃比(填“大于”或“小于”)理论空燃比。
(2)、三元催化转化器可降低汽车尾气中CO、碳氢化合物和氮氧化物的含量。汽车尾气中污染物单位时间的转化率与空燃比的关系如图(氮氧化物主要是NO)。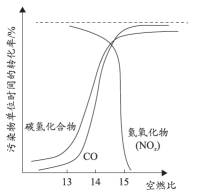
已知:i.空燃比大于15后,空燃比越大,尾气的温度越低。
ii.CO和NO的反应为放热反应。
①三元催化转化器可将CO和NO转化为无害气体,反应的化学方程式为。
②空燃比大于15时,尾气中氮氧化物单位时间的转化率接近于0,可能的原因是。(写出2条)。
16. 氢键对生命活动具有重要意义。DNA中四种碱基间的配对方式如图。(~代表糖苷键)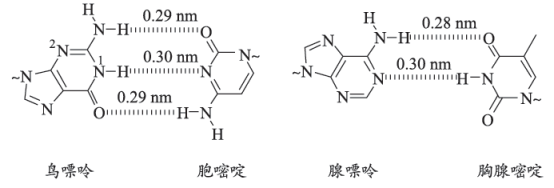 (1)、基态N的核外电子排布式为。(2)、碱基中的—NH2具有一定的碱性,可以结合H+形成—NH , 从结构角度解释可以结合的原因:。(3)、鸟嘌呤是一种常见的碱基。
(1)、基态N的核外电子排布式为。(2)、碱基中的—NH2具有一定的碱性,可以结合H+形成—NH , 从结构角度解释可以结合的原因:。(3)、鸟嘌呤是一种常见的碱基。①鸟嘌呤中2号N的杂化类型为。
②鸟嘌呤中N—H键的平均键长。(填“大于”“小于”或“等于”)0.29nm。
(4)、氢键在DNA复制过程中起重要作用①碱基中,O、N能与H形成氢键而C不能,原因是。
②下列说法正确的是(填序号)。
a.氢键的强度较小,在DNA解旋和复制时容易断裂和形成
b.鸟嘌呤与胞嘧啶之间的相互作用比腺嘌呤与胸腺嘧啶之间的更强
c.碱基配对时,一个H可以同时与多个原子形成氢键
(5)、一定条件下鸟嘌呤会发生异构化,其1号N上的H会转移到O上形成-OH。①鸟嘌呤异构化后的结构简式为。
②鸟嘌呤异构化后最有可能配对的嘧啶碱基是。。
17. 乌药内酯具有抗炎、镇痛作用。乌药内酯的中间体X合成路线如图所示(部分反应条件或试剂略去)。 (1)、B的名称是。(2)、B→D的化学方程式是。(3)、已知2D→E+A,E的结构简式是。(4)、下列关于有机物I的说法错误的是。(填序号)。
(1)、B的名称是。(2)、B→D的化学方程式是。(3)、已知2D→E+A,E的结构简式是。(4)、下列关于有机物I的说法错误的是。(填序号)。a.可以发生取代反应、加成反应、氧化反应
b.存在酚类同分异构体
c.可以用酸性KMnO4溶液检验其中的碳碳双键
d.核磁共振氢谱中有6种信号峰,是手性分子
(5)、I→J的化学方程式是。(6)、已知:①
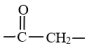 +
+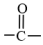
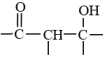
③
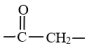
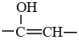
G与L可以在碱性条件下经过如图所示的多步反应得到X。
G+L→中间产物1中间产物2中间产物3
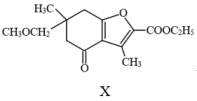
中间产物1、中间产物3的结构简式是、。
18. 对硝基苯酚(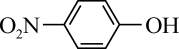 , PNP)是应用广泛的精细化工中间体。PNP有毒,工业废水中的PNP需联合采用多种方法进行处理,流程如图。
, PNP)是应用广泛的精细化工中间体。PNP有毒,工业废水中的PNP需联合采用多种方法进行处理,流程如图。已知:PNP的溶解性与苯酚类似,微溶于水;其化学性质稳定,可被•OH、HClO氧化降解为无机物,但不能与O2反应。
 (1)、在pH>14的废水中,PNP的存在形态为(用结构简式表示)。(2)、絮凝沉淀池中加入硫酸的目的是。(3)、低浓度PNP废水可通过电解法处理,装置示意图如图。
(1)、在pH>14的废水中,PNP的存在形态为(用结构简式表示)。(2)、絮凝沉淀池中加入硫酸的目的是。(3)、低浓度PNP废水可通过电解法处理,装置示意图如图。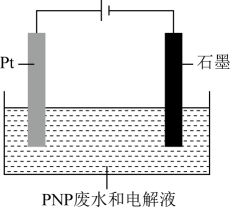
①•OH(氧元素为-1价)由水产生,•OH在(填“Pt”或“石墨”)电极产生。
②产生•OH的电极反应式为。
(4)、废水中所含电解质的种类会影响电解法处理PNP的去除率。其它条件相同时,以NaCl和Na2SO4模拟酸性低浓度PNP废水中的电解质,结果如图。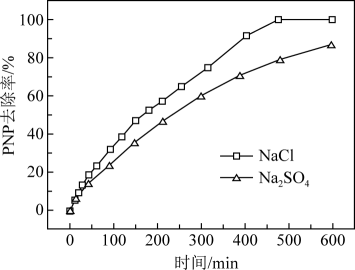
①电解质为NaCl时,阳极副反应的电极反应式为。
②电解质为NaCl时,PNP去除率较Na2SO4高,可能的原因是。
(5)、在强碱性条件下,单独使用电解法也可有效去除废水中的PNP。工业上仍联合使用絮凝沉淀法处理PNP废水,目的是节约电能和。19. 实验小组探究(NH4)2S2O8溶液与KI溶液的反应及其速率,实验过程和现象如表。已知:
i.(NH4)2S2O8具有强氧化性,能完全电离,S2O易被还原为SO;
ii.淀粉检测I2的灵敏度很高,遇低浓度的I2即可快速变蓝;
iii.I2可与S2O发生反应:2S2O+I2=S4O+2I-。
编号
1-1
1-2
实验操作
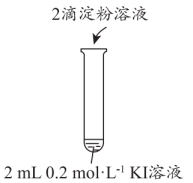
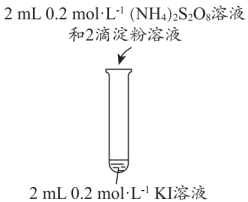
现象
无明显现象
溶液立即变蓝
(1)、实验1-1的目的是。(2)、(NH4)2S2O8与KI反应的离子方程式为。为了研究(NH4)2S2O8与KI反应的速率,小组同学分别向两支试管中依次加入下列试剂,并记录变色时间,如表。
编号
0.2mol·L-1KI溶液/mL
0.01mol·L-1Na2S2O3溶液/mL
蒸馏水/mL
0.4%的淀
粉溶液/滴
0.2mol·L-1(NH4)2S2O8溶液/mL
变色时间/s
2-1
2
0
2.8
2
0.2
立即
2-2
2
0.8
0.2
2
2
30
(3)、实验2-1不能用于测定(NH4)2S2O8与KI反应的速率,原因除变色时间过短外还有。(4)、加入Na2S2O3溶液后溶液变蓝的时间明显增长,甲同学对此提出两种猜想。猜想1:(NH4)2S2O8先与Na2S2O3反应,使c(S2O)降低;
猜想2:(NH4)2S2O8先与KI反应,..............。
①甲同学提出猜想1的依据:由信息iii推测,Na2S2O3的还原性(填“强于”或“弱于”)KI的。
②乙同学根据现有数据证明猜想1不成立,理由是。
③补全猜想2:。
(5)、查阅文献表明猜想2成立。根据实验2-2的数据,计算30s内的平均反应速率v(S2O)=mol·L-1·s-1(写出计算式)。(6)、实验2-2中,30s内未检测到(NH4)2S2O8与Na2S2O3反应,可能的原因是。(写出2条)。