北京市房山区2022届高三第二次模拟测试化学试题
试卷更新日期:2022-06-06 类型:高考模拟
一、单选题
-
1. 2022年4月16日,神舟十三号返回舱成功着陆,我国在探索太空的征程上又迈出了坚实的一步。下列涉及的系列材料中,主要成分为金属的是( )




A.返回舱与推进舱分离时使用的推进剂——液氧和液氢
B.航天员返回途中穿着的航天服——合成纤维及尼龙膜
C.返回舱减速伞材料——高强度锦纶纤维
D.返回舱侧壁壳体——高强度铝合金
A、A B、B C、C D、D2. 下列化学用语书写正确的是( )A、过氧化钠的电子式是 B、乙烷的结构式是
B、乙烷的结构式是 C、基态磷原子的轨道表示式:
C、基态磷原子的轨道表示式: D、中子数为7的碳原子是C
3. 下列实验操作中,符合操作规范的是( )A、向试管中滴加试剂时,将滴管下端紧靠试管内壁 B、用托盘天平称量药品时,右盘放药品,左盘放砝码 C、用pH试纸检验溶液的酸碱性时,将试纸浸入溶液中 D、萃取操作中倒转分液漏斗用力振荡时,应关闭玻璃塞和活塞4. 实验室用锌与稀硫酸反应制氢气,下列做法能加快反应速率的是( )A、选用纯度更大的金属锌 B、改用浓硫酸 C、改用粗锌(含铜、银) D、降低温度5. 脱落酸是一种抑制生长的植物激素,可延长鲜花盛开的时间,其结构简式如图所示。下列关于脱落酸的说法错误的是( )
D、中子数为7的碳原子是C
3. 下列实验操作中,符合操作规范的是( )A、向试管中滴加试剂时,将滴管下端紧靠试管内壁 B、用托盘天平称量药品时,右盘放药品,左盘放砝码 C、用pH试纸检验溶液的酸碱性时,将试纸浸入溶液中 D、萃取操作中倒转分液漏斗用力振荡时,应关闭玻璃塞和活塞4. 实验室用锌与稀硫酸反应制氢气,下列做法能加快反应速率的是( )A、选用纯度更大的金属锌 B、改用浓硫酸 C、改用粗锌(含铜、银) D、降低温度5. 脱落酸是一种抑制生长的植物激素,可延长鲜花盛开的时间,其结构简式如图所示。下列关于脱落酸的说法错误的是( ) A、分子式为C15H20O4 B、存在酯类同分异构体 C、一定条件下可以发生酯化、加聚、氧化反应 D、1mol脱落酸能与2molNaHCO3发生反应6. 根据元素周期律,由下列事实进行推测,不合理的是( )
A、分子式为C15H20O4 B、存在酯类同分异构体 C、一定条件下可以发生酯化、加聚、氧化反应 D、1mol脱落酸能与2molNaHCO3发生反应6. 根据元素周期律,由下列事实进行推测,不合理的是( )选项
事实
推测
A
Na、Al能够与盐酸反应置换出H2
Mg也一定能与盐酸反应置换出H2
B
H3PO4是中强酸,H2SO4是强酸
HClO4是强酸
C
Si是半导体材料,Ge也是半导体材料
IVA族元素的单质都是半导体材料
D
Ca与冷水较易反应,Mg与冷水较难反应
Be与冷水更难反应
A、A B、B C、C D、D7. 下列解释事实的方程式错误的是( )A、用食醋清洗水垢:CO+2CH3COOH=2CH3COO-+H2O+CO2↑ B、84消毒液与洁厕灵混用产生有毒气体:ClO-+Cl-+2H+=Cl2↑+H2O C、用小苏打治疗胃酸过多:HCO+H+=CO2↑+H2O D、用硫化钠除去废水中的汞离子:Hg2++S2-=HgS↓8. 下列颜色变化与氧化还原无关的是( )A、湿润的红色布条遇到氯气褪色 B、棕黄色的FeCl3饱和溶液滴入沸水中变红褐色 C、紫色酸性KMnO4溶液通入乙烯气体后褪色 D、浅黄色Na2O2固体露置于空气中逐渐变为白色9. 微生物电池可用来处理废水中的对氯苯酚,其工作原理示意图如图。关于该电池的说法错误的是( ) A、a极是负极 B、H+向b极迁移 C、b电极上发生的反应是
A、a极是负极 B、H+向b极迁移 C、b电极上发生的反应是 +H++2e-=
+H++2e-= +Cl-
D、生成0.1molH2CO3 , 电池反应电子转移数目为0.4mol
10. 根据下列实验操作和现象所得到的结论正确的是( )
+Cl-
D、生成0.1molH2CO3 , 电池反应电子转移数目为0.4mol
10. 根据下列实验操作和现象所得到的结论正确的是( )选项
实验操作
实验现象
结论
A
向某盐溶液中先加入氯水,再滴加KSCN溶液
溶液变红色
一定含有Fe2+
B
SO2缓慢通入滴有酚酞的NaOH溶液中
溶液红色褪去
SO2具有漂白性
C
少量Zn粉加入1.0mol/L Fe2(SO4)3溶液中
溶液颜色变浅
金属Zn比Fe活泼
D
取少量某无色溶液,先滴加氯水,再加入少量CCl4 , 振荡、静置
溶液分层,下层呈紫红色
原无色溶液中一定有I-
A、A B、B C、C D、D11. 聚酯三元醇应用于制备医用高分子材料,合成聚酯三元醇的原理如图:
已知:R1COOR2+R318OHR1CO18OR3+R2OH
下列说法错误的是( )
A、单体M1属于醇类 B、改变M1在三种单体中的比例,可调控聚酯三元醇的相对分子质量 C、该合成反应为缩聚反应 D、X、Y、Z中包含的结构片段可能有 12. 甲硫醇是一种重要的化工原料,硫化氢与甲醇合成甲硫醇的催化过程如图。下列说法中错误的是( )
12. 甲硫醇是一种重要的化工原料,硫化氢与甲醇合成甲硫醇的催化过程如图。下列说法中错误的是( ) A、上述过程中总反应是取代反应 B、反应前后碳原子的成键数目没有发生变化 C、若CD3OD和H2S参与,则可能生成CHD2SH和D2O D、催化剂的使用可大大提升反应物硫化氢和甲醇的转化率13. 用0.100mol·L-1的NaOH溶液分别滴定体积均为10.00mL、浓度均为0.100mol·L-1的HCl和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率(电导率越大表示溶液导电性越强)变化如图所示。下列说法正确的是( )
A、上述过程中总反应是取代反应 B、反应前后碳原子的成键数目没有发生变化 C、若CD3OD和H2S参与,则可能生成CHD2SH和D2O D、催化剂的使用可大大提升反应物硫化氢和甲醇的转化率13. 用0.100mol·L-1的NaOH溶液分别滴定体积均为10.00mL、浓度均为0.100mol·L-1的HCl和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率(电导率越大表示溶液导电性越强)变化如图所示。下列说法正确的是( ) A、曲线①代表向HCl中滴加NaOH B、A点溶液的pH小于C点溶液的pH C、A、B两点水的电离程度:A>B D、C→D发生了反应:H++OH-=H2O14. 小组进行如下实验。
A、曲线①代表向HCl中滴加NaOH B、A点溶液的pH小于C点溶液的pH C、A、B两点水的电离程度:A>B D、C→D发生了反应:H++OH-=H2O14. 小组进行如下实验。
下列说法错误的是( )
A、①中存在沉淀溶解平衡:Mg(OH)2(s)⇌Mg2+(aq)+2OH−(aq) B、③中溶液又变红的原因:沉淀溶解平衡正向移动 C、c(OH−):③=① D、③中存在:2c(Mg2+)>c(Cl−)二、综合题
-
15. 氧氮杂环是新药研制过程中发现的一类重要活性物质,有抗肿瘤功效。下面是某研究团队提出的一种氧氮杂环类化合物F的合成路线:

已知:RCH=CHCOOR′+


回答下列问题:
(1)、A的名称是 , B中含氧官能团的名称是。(2)、B→C的化学方程式是。(3)、C与M一定条件下反应生成D,M的结构简式是。(4)、D→E的反应类型是。(5)、B有多种同分异构体,写出满足以下条件的一种同分异构体的结构简式。①不含—CH3
②含2种官能团
③含苯环,且苯环上仅有2个取代基
④核磁共振氢谱有三组吸收峰,峰面积之比为3∶2∶2
(6)、参照上述合成路线和信息,写出由 和
和 为原料合成
为原料合成 的路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件,无机试剂任选)。 16. 氨对人类的生存和发展有着重要意义,1909年哈伯在实验室中首次利用氮气与氢气反应合成氨,实现了人工固氮。(1)、反应N2(g)+3H2(g)2NH3(g)的化学平衡常数表达式为。(2)、在一定条件下氨的平衡含量如表。
的路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件,无机试剂任选)。 16. 氨对人类的生存和发展有着重要意义,1909年哈伯在实验室中首次利用氮气与氢气反应合成氨,实现了人工固氮。(1)、反应N2(g)+3H2(g)2NH3(g)的化学平衡常数表达式为。(2)、在一定条件下氨的平衡含量如表。温度/℃
压强/MPa
氨的平衡含量
200
10
81.5%
550
10
8.25%
①该反应为(填“吸热”或“放热”)反应。
②哈伯选用的条件是550℃、10MPa,而非200℃、10MPa,可能的原因是。
(3)、实验室研究是工业生产的基石。如图中的实验数据是在其它条件不变时,不同温度(200℃、400℃、600℃)、压强下,平衡混合物中NH3的物质的量分数的变化情况。
①曲线a对应的温度是。
②M、N、Q点平衡常数K的大小关系是。
(4)、尽管哈伯的合成氨法被评为“20世纪科学领域中最辉煌的成就”之一,但仍存在耗能高、产率低等问题。因此,科学家在持续探索,寻求合成氨的新路径。如图为电解法合成氨的原理示意图,阴极的电极反应式为。 (5)、NH3转化为NO是工业制取硝酸的重要一步。已知:100kPa、298K时:
(5)、NH3转化为NO是工业制取硝酸的重要一步。已知:100kPa、298K时:4NH3(g)+3O2(g)2N2(g)+6H2O(g)ΔH=-1268kJ·mol-1
2NO(g)N2(g)+O2(g)ΔH=-180.5kJ·mol-1
请写出NH3转化为NO的热化学方程式。
17. 金属铬及其化合物广泛应用于工业生产中。(1)、烟酸铬是铬的一种化合物,可促进生物体内的蛋白质合成,提高生物体的免疫力,其合成过程如图:
①H、C、N、O的电负性由大到小的顺序是。
②烟酸中碳原子的杂化方式为。
(2)、基态铬原子的核外电子排布式为 , 有个未成对电子。(3)、铬元素的一种配合物[Cr(H2O)4Cl2]Cl•2H2O,配离子中提供孤电子对的原子为 , 配位数为。(4)、Cr2O3晶体的熔点为2435℃,而CrCl3晶体易升华,其主要原因是。(5)、铬、钙和氧组成一种特殊的导电材料(复合氧化物),其晶胞如图所示。该晶体的化学式为。 18. 工业上用含三价钒(V2O3)为主的某石煤为原料(含有Al2O3、SiO2、Fe2O3等杂质),低温硫酸化焙烧—水浸工艺制备V2O5 , 其流程如图:
18. 工业上用含三价钒(V2O3)为主的某石煤为原料(含有Al2O3、SiO2、Fe2O3等杂质),低温硫酸化焙烧—水浸工艺制备V2O5 , 其流程如图:
资料:
ⅰ.VOSO4高温易分解
ⅱ.含磷有机试剂对溶液中离子萃取能力为Fe(III)>V(IV)>V(V)>Fe(II)
ⅲ.含磷有机试剂萃取过程中溶液的H+浓度越高,萃取率越低,萃取钒效果越差
ⅳ.10VO+8H2OH2V10O+14H+
ⅴ.氢氧化物完全沉淀时溶液的pH表
沉淀物
Fe(OH)3
Fe(OH)2
Al(OH)3
完全沉淀
3.2
9.0
4.7
(1)、焙烧过程中向石煤中加硫酸焙烧,将V2O3转化为VOSO4的化学方程式是。(2)、预处理过程中先加入Na2SO3溶液进行还原预处理,加入Na2SO3溶液的第一个作用是将V(V)还原为V(IV)减少钒的损失,再用氨水混合并调节溶液pH。①请结合相关离子方程式,说明加入Na2SO3的第二个作用。
②解释加氨水调节pH≈5的原因是。
(3)、上述I的具体操作为。(4)、沉钒过程中先加入NaClO3进行氧化,再加氨水调节pH,铵盐会将H2V10O中的钒元素以多钒酸铵((NH4)2V6O16)的形式沉淀。溶液pH值与沉钒率的关系如图,请结合反应原理解释沉钒的pH=2.5的原因是。 (5)、测定产品中V2O5的纯度:
(5)、测定产品中V2O5的纯度:称取ag产品,先用硫酸溶解,得到(VO2)2SO4溶液。再加入b1mLc1mol·L-1(NH4)2Fe(SO4)2溶液(VO+2H++Fe2+=VO2++Fe3++H2O)最后用c2mol·L-1KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2mL。已知MnO被还原为Mn2+ , 假设杂质不参与反应。则产品中V2O5的质量分数是。(V2O5的摩尔质量:182g•mol-1)
19. 某小组用实验1探究FeCl3与Cu的反应,观察到有白色沉淀产生。实验1:
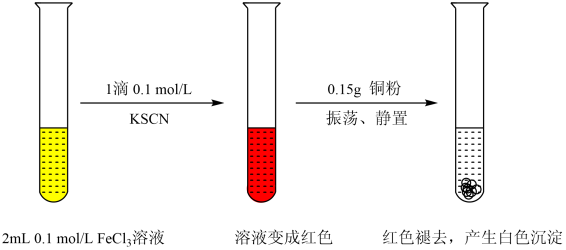
资料:ⅰ.CuSCN、CuCl均为难溶于水的白色固体;均能与硝酸反应,分别生成Cu2+与SO、Cu2+与Cl-。
ⅱ.(SCN)2性质与卤素单质相似,其水溶液呈黄色。
(1)、FeCl3溶液与Cu反应的离子方程式为。(2)、小组同学推测白色沉淀中的Cu(I)(I表示+1价铜元素)可能是由Fe3+氧化Cu得到的,为探究实验1中白色沉淀的成分,小组同学实施了实验2:
由实验2可知,实验1中白色沉淀的成分是。
(3)、该小组欲进一步探究实验1中白色沉淀产生的原因,实施了实验3:步骤
实验操作
实验现象
I
溶液变为蓝色,澄清透明,底部只有少量红色固体剩余
II
取I中上层清液于试管中,滴加1滴0.1mol/L KSCN溶液
立刻出现红色,同时有白色沉淀生成
III
振荡II中试管,静置
白色沉淀变多,红色逐渐褪去
①步骤I的实验操作是。
②根据实验3的现象,小组同学认为Fe3+与Cu反应的氧化产物不含Cu(I),他们的判断依据是。
③步骤Ⅱ中加入KSCN溶液后出现红色的可能原因是。
④解释步骤III中实验现象产生的可能原因:。