浙教版科学八年级下册期末复习专题11 化学方程式
试卷更新日期:2022-06-01 类型:复习试卷
一、单选题
-
1. 下列关于二氧化碳的用途不能用化学反应式来体现的的是( )A、
 B、
B、 C、
C、 D、
D、 2. 碳酸钠溶液中滴入少量盐酸并不会产生气体,原因是先发生如下反应:Na2CO3+HCl=NaHCO3+NaCl,当加入一定量盐酸时,才会产生气体。某锥形瓶内盛有100g碳酸钠溶液,向其中逐滴加入溶质质量分数为3.65%的盐酸溶液,产生的气体质量 m1与加入的盐酸溶液质量m2的变化关系如图所示。下列说法错误的是( )
2. 碳酸钠溶液中滴入少量盐酸并不会产生气体,原因是先发生如下反应:Na2CO3+HCl=NaHCO3+NaCl,当加入一定量盐酸时,才会产生气体。某锥形瓶内盛有100g碳酸钠溶液,向其中逐滴加入溶质质量分数为3.65%的盐酸溶液,产生的气体质量 m1与加入的盐酸溶液质量m2的变化关系如图所示。下列说法错误的是( ) A、反应至A点时,锥形瓶内的溶质为碳酸氢钠和氯化钠 B、b的数值为100g C、碳酸钠的溶质质量分数为10.6% D、反应至B点时,产生的气体质量为2.2g3. 将一定质量的铁和氧化铜的混合物粉末放入足量稀盐酸中,充分反应后产生气体0.2g,并得到残留固体6.4g.则原混合物粉末的质量是( )A、5.6g B、13.6g C、19.2g D、25.6g4. 为实现二氧化碳绿色利用,科学家用固碳酶作催化剂设计了图示转化过程。下列说法不正确的是( )
A、反应至A点时,锥形瓶内的溶质为碳酸氢钠和氯化钠 B、b的数值为100g C、碳酸钠的溶质质量分数为10.6% D、反应至B点时,产生的气体质量为2.2g3. 将一定质量的铁和氧化铜的混合物粉末放入足量稀盐酸中,充分反应后产生气体0.2g,并得到残留固体6.4g.则原混合物粉末的质量是( )A、5.6g B、13.6g C、19.2g D、25.6g4. 为实现二氧化碳绿色利用,科学家用固碳酶作催化剂设计了图示转化过程。下列说法不正确的是( ) A、反应①前后,碳元素的化合价发生改变 B、反应①是分解反应 C、固碳酶在反应前后化学性质没有变化 D、反应中②遵循质量守恒定律5. 火柴头是一种不能被磁铁吸引的物体,但烧过之后的火柴头却能被磁铁吸引,原因是很多火柴头用氧化铁着色,点燃后会与木棒中的碳反应产生四氧化三铁和二氧化碳等。下列说法中不合理的是( )A、Fe3O4与Fe2O3磁性不同,体现了它们的物理性质不同 B、Fe3O4中铁的质量分数大于Fe2O3 C、火柴头燃烧的化学方程式为C+O2+6Fe2O3 4Fe3O4+CO2 D、火柴头原本不被磁铁吸引是因为不易被磁化6. 下列化学方程式书写正确的是( )A、P+O2 PO2 B、2P+5O2 P2O5 C、4P+5O2 P2O5
A、反应①前后,碳元素的化合价发生改变 B、反应①是分解反应 C、固碳酶在反应前后化学性质没有变化 D、反应中②遵循质量守恒定律5. 火柴头是一种不能被磁铁吸引的物体,但烧过之后的火柴头却能被磁铁吸引,原因是很多火柴头用氧化铁着色,点燃后会与木棒中的碳反应产生四氧化三铁和二氧化碳等。下列说法中不合理的是( )A、Fe3O4与Fe2O3磁性不同,体现了它们的物理性质不同 B、Fe3O4中铁的质量分数大于Fe2O3 C、火柴头燃烧的化学方程式为C+O2+6Fe2O3 4Fe3O4+CO2 D、火柴头原本不被磁铁吸引是因为不易被磁化6. 下列化学方程式书写正确的是( )A、P+O2 PO2 B、2P+5O2 P2O5 C、4P+5O2 P2O5D、4P+5O2 2P2O57. “天宫一号”目标飞行器内镍氢电池的总反应方程式为H2+2NiO(OH)=2Ni(OH)2。下列有关叙述不正确的是( )A、H2是单质 B、NiO(OH)是氧化物 C、Ni(OH)2中Ni元素的化合价为+2价 D、参加反应的H2、NiO(OH)的质量比为1:928. 在化学反应2A+B2=2C中,已知20 g A和足量B2充分反应后,生成30 gC。已知B2的相对分子质量为32,则C的相对分子质量是( )A、20 B、32 C、48 D、969. 根据化学方程式:2H2O2 H2↑+O2↑,判断下列说法正确的是( )①水分子是由两个氢原子和一个氧原子构成的②水是由氢元素和氧元素组成的③反应前后氢元素的化合价没有发生变化④水是由氧气单质和氢气单质组成的⑤反应前后氧原子和氢原子的数目不变⑥反应前后氧原子的质子数不变⑦生成的氢气和氧气的微粒数目之比是2 : 1⑧反应前后物质的总质量不变
A、①④⑤⑦⑧ B、②④⑤⑥⑦ C、①③④⑥⑧ D、②⑤⑥⑦⑧二、填空题
-
10. 在学校组织的科技节上,同学们展示了许多神奇的实验。
 (1)、图甲,把装有刚停止沸腾水的玻璃瓶倒放,在瓶底上放上一块冰块发现水又重新沸腾起来,是因为冰块使瓶内的气压变小,水的沸点。(2)、图乙,将两支两头都被削出笔芯的铅笔插入水中,并在铅笔上方笔芯接上一节五号电池,发现下方笔芯.上产生了大量气泡,原因是(请用化学方程式表示)。(3)、图丙,接通电路后,观察到小磁针偏转。断电后,小磁针恢复到原来指向。这一现象说明。11. 写出下列反应的化学方程式,并填空。(1)、实验室用双氧水制取氧气: 。(2)、镁在二氧化碳中燃烧生成氧化镁和炭黑:;收集镁条燃烧后的固体粉末于燃烧匙中,将其放于酒精灯的火焰上灼烧,并用内壁涂有澄清石灰水的烧杯罩在燃烧匙上方,澄清石灰水变浑浊,证明该固体粉末中含碳元素。你认为该结论(填“正确”或“不 正确”),理由是。12. 1823年德贝莱纳发现氢气遇到金属铂会起火,根据此原理制成了世界上第一支打火机,如甲图所示。用一只小玻璃筒盛上适量的稀硫酸,筒内装一内管,内管中装入锌片,玻璃筒装一顶盖,顶盖上有喷嘴、铂网和开关,其结构简图如乙图所示。
(1)、图甲,把装有刚停止沸腾水的玻璃瓶倒放,在瓶底上放上一块冰块发现水又重新沸腾起来,是因为冰块使瓶内的气压变小,水的沸点。(2)、图乙,将两支两头都被削出笔芯的铅笔插入水中,并在铅笔上方笔芯接上一节五号电池,发现下方笔芯.上产生了大量气泡,原因是(请用化学方程式表示)。(3)、图丙,接通电路后,观察到小磁针偏转。断电后,小磁针恢复到原来指向。这一现象说明。11. 写出下列反应的化学方程式,并填空。(1)、实验室用双氧水制取氧气: 。(2)、镁在二氧化碳中燃烧生成氧化镁和炭黑:;收集镁条燃烧后的固体粉末于燃烧匙中,将其放于酒精灯的火焰上灼烧,并用内壁涂有澄清石灰水的烧杯罩在燃烧匙上方,澄清石灰水变浑浊,证明该固体粉末中含碳元素。你认为该结论(填“正确”或“不 正确”),理由是。12. 1823年德贝莱纳发现氢气遇到金属铂会起火,根据此原理制成了世界上第一支打火机,如甲图所示。用一只小玻璃筒盛上适量的稀硫酸,筒内装一内管,内管中装入锌片,玻璃筒装一顶盖,顶盖上有喷嘴、铂网和开关,其结构简图如乙图所示。 (1)、请写出锌与稀硫酸反应的化学方程式 。(2)、反应产生氢气,氢气和氧气遇铂在常温下就会发生化学变化,过程如丙图所示,铂在该反应中的作用是。(3)、当将顶盖上的开关关闭,堵住喷嘴时,打火机便停止工作,氢气也随之停止产生。氢气停止产生的原因是 。
(1)、请写出锌与稀硫酸反应的化学方程式 。(2)、反应产生氢气,氢气和氧气遇铂在常温下就会发生化学变化,过程如丙图所示,铂在该反应中的作用是。(3)、当将顶盖上的开关关闭,堵住喷嘴时,打火机便停止工作,氢气也随之停止产生。氢气停止产生的原因是 。三、实验探究题
-
13. 实验室现有 Fe(OH)3、Cu(OH)2 和少量杂质的固体混合物,某同学欲测定该固体混合物中各成分的含量,设计了如下实验.部分实验步骤如下:

已知:①在 68℃时,Cu(OH)2 会分解;在 500℃时,Fe(OH)3会分解.二种物质的分解产物均为氧化物且化合价不变.
②装置气密性良好,试剂均足量,反应均完全,杂质不参与反应也不分解.
Ⅰ.将质量为m的样品放入硬质玻璃管中,称量装置B的质量m1.
Ⅱ.连接好装置。缓缓通入N2一会儿,再开始加热并控制温度在100℃左右.反应结束后称量装置B的质量m2.
Ⅲ.重复步骤Ⅱ,控制温度在550℃左右.反应结束后再次称量装置B的质量m3.
实验数据记录如下表:
温度/℃
室温
100
550
B装置/g
m1
M2
M3
请回答下列问题:
(1)、如果装置B中的试剂也是浓硫酸,那么装置C的作用。(2)、每次停止加热后仍需继续通N2 , 作用是.(3)、样品中Cu(OH)2的质量分数为。14. 氢化钙(CaH2)是一种常见的储氢材料,也是登山运动员常用的能源提供剂,某研究性学习小组模拟生产企业制取氢化钙。【查阅资料】
Ⅰ.钙、氢化钙遇水立即发生剧烈反应: ; ;
II.钙能燃烧生成氧化钙;氢化钙能燃烧生成氧化钙和水。
【实验原理】
用锌粒和稀硫酸反应制得干燥、纯净的氢气,再与金属钙在加热的条件下直接化合,即可制得CaH2。同学们设计了以下实验装置:
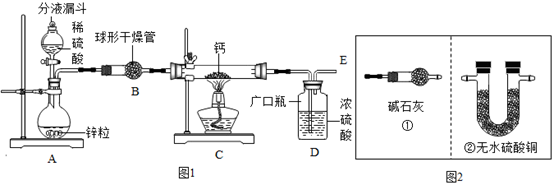
请回答:
(1)、观察图1实验设计图,为了实验安全,点燃C装置酒精灯前,应采取的操作为 , D装置的作用是。(2)、反应结束后,小组同学想证明C中的钙是否真变成氢化钙,设计如下定性实验:取C中少量反应后的固体样品,在干燥条件下与氧气反应,再将其产物通入图2中的(填“①”或“②”)装置。(3)、既然钙与氢化钙两种固体均能与水反应生成氢气能源,那为什么要将金属钙制备成氢化钙作为登山运动员常用的能源提供剂呢?请写出你的解释:。15. 海水中蕴含丰富的资源。(1)、海水淡化是解决淡水资源不足的重要方法。下列方法中, 可以使海水变为淡水的是 (填字母序号)A、滤纸过滤 B、吸附 C、沉降 D、蒸馏(2)、从海水中提炼出来的重水(D2O)可作原子能反应堆的中子减速剂和热传热介质。重水中重氢原子(D)的相对原子质量是2,则重水中氢元素的质量分数为 。(3)、从海水中制备纯碱和金属镁的流程如图所示:
回答下列问题:
①步骤V中所加试剂是
②写出由贝壳得到CaO的化学方程式
四、解答题
-
16. 请根据所示的实验过程和提供的信息作答:
 (1)、K2CO3中钾、碳、氧元素的质量比为(写最简比)。(2)、实验结束后溶液中的溶质为。(3)、实验所用K2CO3溶液的溶质质量分数是(精确至 0.1%)。(4)、计算原混合液中CaCl2的质量分数。(写出计算过程,精确至0.1%)17. 化学兴趣小组为探究实验室制取氧气。把干燥、纯净的氯酸钾和二氧化锰的混合物30g 装入大试管中,加热。待反应完全后,将试管冷却、称量,得到20.4g固体物质。
(1)、K2CO3中钾、碳、氧元素的质量比为(写最简比)。(2)、实验结束后溶液中的溶质为。(3)、实验所用K2CO3溶液的溶质质量分数是(精确至 0.1%)。(4)、计算原混合液中CaCl2的质量分数。(写出计算过程,精确至0.1%)17. 化学兴趣小组为探究实验室制取氧气。把干燥、纯净的氯酸钾和二氧化锰的混合物30g 装入大试管中,加热。待反应完全后,将试管冷却、称量,得到20.4g固体物质。试计算:
(1)、完全反应后制得氧气多少克(写出计算过程)?(2)、原混合物中氯酸钾的质量(写出计算过程)。五、综合说理题
-
18. 自然界的水都是含有多种物质的混合物,生产生活中需要的纯净水可以通过蒸馏得到。
(1)将刚刚蒸馏出来的水盛放在敞口的干净容器里,一段时间后,蒸馏水的pH将发生怎样的变化?请你分析说明引起蒸馏水pH改变的原因。
(2)在电解水的实验中,为了增加水的导电性,常在水中加入一定量的稀硫酸,某次实验时,在一定量的蒸馏水中加入50克15%的稀硫酸进行电解,结束后测得剩余溶液的质量为100克,则剩余溶液的质量分数为多少?