浙教版科学八年级下册期末复习专题06 模型、符号、原子结构
试卷更新日期:2022-06-01 类型:复习试卷
一、单选题
-
1. 工业上用二氧化氮溶于水制取硝酸,如图为该化学反应的微观示意图。下列说法错误的是( )
 A、该化学变化过程中氮元素呈现了三种不同的化合价 B、参加反应的甲、乙分子个数比为3 : 1 C、反应生成的丙、丁质量比为21:5 D、该化学反应前后分子总数不变2. 目前铯原子钟是世界上最精确的时钟。铯原子的相对原子质量为133,核外电子数为55,则铯原子的质子数为( )A、55 B、133 C、78 D、1883. 科学家设计了“人造树叶”模拟光合作用,其装置和反应的微观示意图如图。下列说法错误的是( )
A、该化学变化过程中氮元素呈现了三种不同的化合价 B、参加反应的甲、乙分子个数比为3 : 1 C、反应生成的丙、丁质量比为21:5 D、该化学反应前后分子总数不变2. 目前铯原子钟是世界上最精确的时钟。铯原子的相对原子质量为133,核外电子数为55,则铯原子的质子数为( )A、55 B、133 C、78 D、1883. 科学家设计了“人造树叶”模拟光合作用,其装置和反应的微观示意图如图。下列说法错误的是( )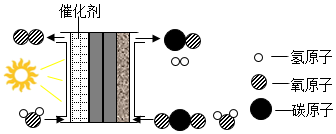 A、该过程实现了能量的转化 B、反应最终生成两种分子 C、反应前后催化剂的化学性质不变 D、该设计为缓解温室效应提供了新途径4. 南京理工大学胡炳成团队用新方法制得了NaN5·3H2O,该化合物中含有N5-等微粒。已知N为7号元素,则下列有关说法正确的是( )A、N5-是一种单质 B、1 个 N5-带 1 个单位的正电荷 C、个 N5-中共含有 35 个质子 D、1 个 N5-中共含有 35 个电子5. 2022年北京冬奥会,碲化镉发电玻璃成为绿色奥运和科技奥运的创新点。碲元素是一种重要的工业添加剂,如碲-128。其相对原子质量为128,质子数为52,则碲-128原子中的中子数为( )A、128 B、52 C、76 D、1806. 医学上用碘的同位素治疗甲亢已非常普遍。从 1942 年第一例放射性元素碘-131 治疗甲亢以来有效性和安全性就得到了充分的证实。已知碘-131 原子的核电荷数为 53,中子数为 78,则该原子核外电子数为( )A、25 B、53 C、78 D、1317. 模型常常可以帮助人们认识和理解一些不能直接观察到的或复杂的事物。下列不属于模型的是( )A、新冠病毒
A、该过程实现了能量的转化 B、反应最终生成两种分子 C、反应前后催化剂的化学性质不变 D、该设计为缓解温室效应提供了新途径4. 南京理工大学胡炳成团队用新方法制得了NaN5·3H2O,该化合物中含有N5-等微粒。已知N为7号元素,则下列有关说法正确的是( )A、N5-是一种单质 B、1 个 N5-带 1 个单位的正电荷 C、个 N5-中共含有 35 个质子 D、1 个 N5-中共含有 35 个电子5. 2022年北京冬奥会,碲化镉发电玻璃成为绿色奥运和科技奥运的创新点。碲元素是一种重要的工业添加剂,如碲-128。其相对原子质量为128,质子数为52,则碲-128原子中的中子数为( )A、128 B、52 C、76 D、1806. 医学上用碘的同位素治疗甲亢已非常普遍。从 1942 年第一例放射性元素碘-131 治疗甲亢以来有效性和安全性就得到了充分的证实。已知碘-131 原子的核电荷数为 53,中子数为 78,则该原子核外电子数为( )A、25 B、53 C、78 D、1317. 模型常常可以帮助人们认识和理解一些不能直接观察到的或复杂的事物。下列不属于模型的是( )A、新冠病毒 B、甲烷分子结构
B、甲烷分子结构  C、节水标记
C、节水标记  D、足球烯结构
D、足球烯结构  8. 在生活与科研中,我们用符号或模型来表达一定的信息。下列图示属于符号的是( )A、
8. 在生活与科研中,我们用符号或模型来表达一定的信息。下列图示属于符号的是( )A、 B、
B、 C、
C、 D、
D、 9. 下列模型与符号“2HCl”(其中
9. 下列模型与符号“2HCl”(其中 氢原子,
氢原子,  氯原子)表示的意义一致的是( ) A、
氯原子)表示的意义一致的是( ) A、 B、
B、 C、
C、 D、
D、 10. 钛和钛合金被认为是21世纪的重要金属材料,它们具有熔点高、密度小、抗腐蚀性能好等优良性能,因此被广泛用于火箭、航天飞机、船舶和化工等。已知钛原子的质子数为22,中子数为26,则钛原子的核外电子数为( )A、22 B、26 C、4 D、48
10. 钛和钛合金被认为是21世纪的重要金属材料,它们具有熔点高、密度小、抗腐蚀性能好等优良性能,因此被广泛用于火箭、航天飞机、船舶和化工等。已知钛原子的质子数为22,中子数为26,则钛原子的核外电子数为( )A、22 B、26 C、4 D、48二、填空题
-
11. 乙硫醇(化学式为C2H5S)易挥发、易燃烧的液体,有蒜臭味。人对该气味极其敏感,在较远距离便可闻到该气味,家用天然气中添加该物质,可以帮助判断天然气是否泄露。(1)、乙硫醇在物质分类中属于化合物中的。(2)、乙硫醇中碳元素与氢元素的质量比是。(3)、若天然气泄漏,人能迅速闻到蒜臭味。从微观角度解释该现象:。12. 下图是一氧化碳与氧气反应的微观模型图,图中
 表示氧原子,Ο表示碳原子。
表示氧原子,Ο表示碳原子。  (1)、请画出图中位置A的模型图:。(2)、参加反应的一氧化碳与氧气的质量比为。13. 2020年10月,关于日本政府欲将核废水排入太平洋的事曾在全球闹得沸沸扬扬。核废水中131I(碘-131)的相关报道成为热门话题。请回答下列问题:(1)、131I原子中含有53个质子,78个中子。131I原子的核外电子数是。(2)、自然界中普遍存在的另一种碘原子127I,它和131I同属于碘元素。127I原子的质子
(1)、请画出图中位置A的模型图:。(2)、参加反应的一氧化碳与氧气的质量比为。13. 2020年10月,关于日本政府欲将核废水排入太平洋的事曾在全球闹得沸沸扬扬。核废水中131I(碘-131)的相关报道成为热门话题。请回答下列问题:(1)、131I原子中含有53个质子,78个中子。131I原子的核外电子数是。(2)、自然界中普遍存在的另一种碘原子127I,它和131I同属于碘元素。127I原子的质子数为。
14. 我国用新技术提纯了稀有金属铼Re,为航空航天发动机的制造提供了重要原料。(1)、铼原子的相对原子质量为186,原子核内有75个质子,则其核外电子数为。(2)、高铼酸钠(NaReO4)是铼的重要来源之一。高铼酸钠中钠、氧元素质量比为。15. 氮元素和氧元素可以组成很多物质,如氧气、氮气、硝酸(HNO3)等。(1)、氧气和氮气在化学性质上有很大不同,是因为构成它们的不同。(2)、氧元素和氮元素的最根本区别是 不同。A.元素符号
B.原子中的中子数
C.原子中的质子数
D.相对原子质量
(3)、氮元素的化合价有-3,+1,+2,+3,+4,+5价等,则+5 价的氮元素与氧元素形成化合物的化学式为。三、实验探究题
-
16. 碘是一种由碘分子构成的物质。小明同学利用碘进行如下实验:①把少量的固体碘放在湿润的馒头上,发现馒头会变成蓝色;②再取少量的碘溶解在酒精中,取少量碘酒滴在馒头上,发现馒头也会变蓝色。请回答以下问题。(1)、如果取少量的碘放入烧杯中,用酒精灯加热,碘升华成碘蒸气,把湿润的馒头放在碘蒸气中,馒头会有什么变化,请预测实验现象为 , 并阐述理由。(2)、现在市场上买来的食盐大多是加碘盐,将少量食盐水滴在馒头上,馒头不变蓝。那么加碘盐中(填“有”或“没有”)碘分子。17. 探究原子结构的奥秘:1803年英国科学家道尔顿提出了近代原子学说,他认为一切物质是由原子构成的,这些原子是微小的不可分割的实心球。1911年,英国科学家卢瑟福用一束平行高速运动的α粒子(α粒子是带两个单位正电荷的氦原子)轰击金箔时(金原子的核电荷数为79,相对原子质量为197),发现大多数α粒子能穿透金箔,而且不改变原来的运动方向,但是也有一小部分α粒子改变了原来的运动路径,甚至有极少数的α粒子好像碰到了坚硬不可穿透的质点而被弹了回来。(1)、若原子质量、正电荷在原子内均匀分布,则极少数α粒子就(填“会”或“不会” )发生大角度散射。卢瑟福所说的“极少数的α粒子好像碰到了坚硬不可穿透的质点而被弹了回来的“质点”指的是。(2)、绝大多数α粒子穿过后方向不变,说明 ;(填序号)A、原子的质量是均匀分布的 B、原子内部绝大部分空间是空的(3)、从原子结构模型建立的过程中,我们发现。(选填序号)
a.科学模型的建立是一个不断完善、不断修正的过程
b.模型在科学研究中起着很重要的作用
c.波尔的原子模型建立,使人们对原子结构的认识达到了完美的境界
d.人类借助模型的建立,对原子的认识逐渐接近本质
18. 1910年英国科学家卢瑟福进行了著名的α粒子轰击金箔实验。实验做法如图: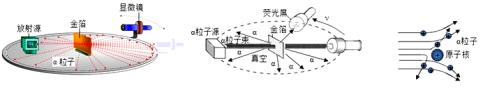
绝大多数α粒子穿过金箔后仍沿原来的方向前进,但是有少数α粒子却发生了较大的偏转,并且有极少数α粒子的偏转超过90°,有的甚至几乎达到180°,像是被金箔弹了回来。
【猜想与假设】α粒子遇到电子后,就像飞行的子弹碰到灰尘一样运动方向不会发生明显的改变,而结果却出乎意料,除非原子的大部分质量集中到了一个很小的结构上,否则大角度的散射是不可能的。
【解释与结论】
(1)、大多数 α 粒子不改变原来的运动方向,原因是 。(2)、卢瑟福所说的“除非原子的大部分质量集中到了一个很小的结构”中的“很小的结构” 指的是 。(3)、科学家对原子结构的探究经历了三个过程,通过 α 粒子散射实验,你认为原子结构为 右图的 。
四、解答题
-
19. 人类对微观世界的探究永无止境。请根据所学知识回答:(1)、道尔顿最早提出原子的概念并认为原子是“不可再分的实心球体”,1897年汤姆生发现电子并提出类似“西瓜”的原子模型,认为电子就像“西瓜子”一样镶嵌在带正电荷的“西瓜瓤”中,如今这些观点均是(选填“正确”“错误”)的。
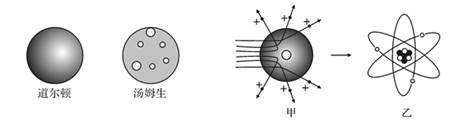 (2)、卢瑟福进行α粒子散射实验后,认为原子是“行星模型”,即原子是由带电荷的原子核和核外电子构成。如图甲是卢瑟福用α粒子轰击原子而产生散射的实验,在分析实验结果的基础上,他提出了图乙所示的原子核式结构,卢瑟福的这一研究过程是一个。
(2)、卢瑟福进行α粒子散射实验后,认为原子是“行星模型”,即原子是由带电荷的原子核和核外电子构成。如图甲是卢瑟福用α粒子轰击原子而产生散射的实验,在分析实验结果的基础上,他提出了图乙所示的原子核式结构,卢瑟福的这一研究过程是一个。A.建立模型的过程 B.得出结论的过程 C.提出问题的过程 D.验证证据的过程
(3)、卢瑟福在α散射实验中(α粒子带正电荷),断定原子中的绝大部分空间是空的,他的依据是。(4)、据报道,中国科学家利用超强超短激光,成功提取出反物质一一超快正电子源,“反物质”是由“反粒子”构成的,“反粒子”与其对应的正粒子具有相同的质量与电量,但电性相反,已知α粒子是带2个正电荷的氦原子核 ,则反α粒子的符号可表示为。20. 2011年3月11日,日本近海发生9.0级强烈地震,从而引发核泄露危机,核事故时往往泄漏出污染物(具有放射性的碘原子)。为避免核辐射,需一次性口服100毫克(不具放射性的碘原子),使人体甲状腺中碘达到饱和而不再吸收外界的碘,从而起到保护作用。请回答:(1)、碘-131是一种质子数为53、中子数为78的碘原子。该原子核外电子数为。(2)、存在于自然界中的另外一种碘原子“碘-127”,其核内质子数是53,中子数是74,它与碘-131的关系是____。A、同种元素 B、同种物质 C、同种分子 D、同种原子(3)、假设所处的环境已受污染,通过服用加碘食盐(注:加碘食盐中的碘为)的方法能否有效起到避免核辐射的目的呢?【查阅资料】成人每天食用食盐的质量通常为6 g;某种加碘食盐的标签如图所示。
配料表:氯化钠、碘酸钾()
净含量:500 g
碘含量(以I计):
【问题分析】500 g该品牌食盐中,含碘的最大质量是。
【结论】日常服用加碘食盐能否起到避免核辐射目的? , 原因是。
五、综合说理题
-
21. 食盐(化学式为NaCl)对人类的生存至关重要,也是烹饪中常用的调味料,但氯气(化学式为Cl2)具有毒性,侵入人体对呼吸道黏膜造成伤害,可见,NaCl和Cl2两种物质化学性质存在明显差异。从微观角度对上述结论作简要的解释。