山东省济宁市泗水县2022年中考二模化学试题
试卷更新日期:2022-06-01 类型:中考模拟
一、单选题
-
1. 下列有关物质应用错误的是( )A、稀有气体常用于制成多种用途的电光源 B、将熟石灰与铵态氮肥混合使用可改良土壤、增加肥效 C、利用碳酸钙能补充人体的常量元素钙 D、应用黄金的金属光泽制作饰品2. 某同学的下列生活行为不符合环保理念的是( )A、在没有疫情的时候,减少自驾车,尽量乘坐公共交通工具 B、将各种废弃的金属丢入“可回收垃圾”桶 C、学习过程中使用的打草纸尽量双面使用 D、夏季使用空调时,尽量将温度调至最低3. 规范的操作是实验成功的保证。下列实验操作正确的是( )A、CO2验满
 B、检查装置的气密性
B、检查装置的气密性 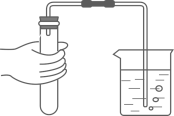 C、滴加液体
C、滴加液体 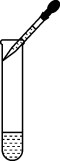 D、测溶液pH
D、测溶液pH 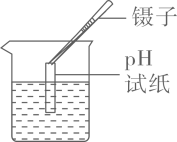 4. 下列依据证据得出的结论,错误的是( )
4. 下列依据证据得出的结论,错误的是( )选项
证据
结论
A
夏天铁轨之间的缝隙变小
分子之间的间隔变小
B
Cu与AgNO3溶液反应生成Ag和Cu(NO3)2
Cu的金属活动性比Ag的强
C
向某固体中加入稀盐酸,有无色无味气体产生,将气体通入澄清石灰水,石灰水变浑浊
该固体含有碳酸根或碳酸氢根
D
白磷在热水中不燃烧,通入氧气后燃烧
氧气能支持白磷燃烧
A、A B、B C、C D、D5. 逻辑推理是化学学习中常用的思维方法。下列推理正确的是( )A、单质中只含一种元素,含一种元素的物质一定是单质 B、同种元素的原子质子数相同,质子数相同的微粒属于同种元素 C、NaOH、Ca(OH)2等碱溶液都使酚酞试液变红,使酚酞试液变红的一定是碱性溶液 D、置换反应生成单质和化合物,生成单质和化合物的反应一定为置换反应6. 甲酸(HCOOH)具有清洁制氢的巨大潜力,其分解前后分子种类变化的微观示意图如下: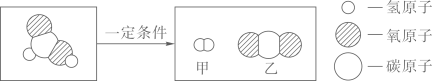
下列说法正确的是( )
A、甲酸分子中氢、氧原子个数比为1:2 B、乙中碳、氧元素质量比为1:2 C、46g甲酸中氢元素质量为2g D、生成甲与乙的分子个数比为2:17. 下列实验方案不能达到实验目的是( )实验目的
实验操作
A
除去硫酸亚铁溶液中少量硫酸铜
加过量铁粉充分反应,过滤
B
检验某固体为碳酸盐
取样,滴加稀盐酸,观察是否有气泡产生
C
除去氯化钠溶液中少量氯化镁
加入过量氢氧化钠溶液,过滤,向滤液中加稀盐酸至中性
D
鉴别氢氧化钠固体和硝酸铵固体
取样,加水溶解,观察温度变化
A、A B、B C、C D、D8. 如图是甲、乙、丙三种固体物质的溶解度曲线,下列说法正确的是( ) A、甲物质的溶解度大于乙的溶解度 B、t2℃时,甲、乙两种物质的溶液浓度相等 C、将t3℃时三种物质的饱和溶液都蒸发10g水,析出溶质的质量为甲>乙>丙 D、当甲中混有少量丙时,可采用蒸发结晶的方法提纯9. 下列所示的四个图象能正确反映对应变化关系的是( )A、
A、甲物质的溶解度大于乙的溶解度 B、t2℃时,甲、乙两种物质的溶液浓度相等 C、将t3℃时三种物质的饱和溶液都蒸发10g水,析出溶质的质量为甲>乙>丙 D、当甲中混有少量丙时,可采用蒸发结晶的方法提纯9. 下列所示的四个图象能正确反映对应变化关系的是( )A、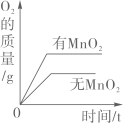 两份完全相同的双氧水在有无MnO2情况下产生O2
B、
两份完全相同的双氧水在有无MnO2情况下产生O2
B、 在密闭容器中用红磷测定空气中氧气的含量
C、
在密闭容器中用红磷测定空气中氧气的含量
C、 向等质量等质量分数的稀硫酸中,分别加入足量的铁粉和锌粉
D、
向等质量等质量分数的稀硫酸中,分别加入足量的铁粉和锌粉
D、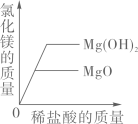 向等质量的氧化镁、氢氧化镁中,分别加入质量分数相同的稀盐酸至过量
10. 某化学兴趣小组在进行科学探究时进行了几个探究实验,用到了以下药品:酚酞、氢氧化钠、盐酸、碳酸钠、氯化钙、硝酸钡、硫酸。实验结束后他们把废液倒入废液缸中,发现废液为无色,且废液底部有白色沉淀,取少量废液测得其pH为4.则有关说法正确的是(不考虑酚酞)( )A、上层清液中一定含有Na+、Cl-、 ,可能含有 、Ba2+ B、上层清液中一定含有Na+、Cl-、 、Ca2+,可能含有 、Ba2+ C、上层清液中一定含有H+、Na+、Cl-、 、Ca2+,可能含有Ba2+ D、白色沉淀的主要成分为BaCO3和BaSO411. 小明同学看到了某衣服上面如图的标签,引发了对所学知识中材料的相关联想,小明同学的下列想法中正确的是 。
向等质量的氧化镁、氢氧化镁中,分别加入质量分数相同的稀盐酸至过量
10. 某化学兴趣小组在进行科学探究时进行了几个探究实验,用到了以下药品:酚酞、氢氧化钠、盐酸、碳酸钠、氯化钙、硝酸钡、硫酸。实验结束后他们把废液倒入废液缸中,发现废液为无色,且废液底部有白色沉淀,取少量废液测得其pH为4.则有关说法正确的是(不考虑酚酞)( )A、上层清液中一定含有Na+、Cl-、 ,可能含有 、Ba2+ B、上层清液中一定含有Na+、Cl-、 、Ca2+,可能含有 、Ba2+ C、上层清液中一定含有H+、Na+、Cl-、 、Ca2+,可能含有Ba2+ D、白色沉淀的主要成分为BaCO3和BaSO411. 小明同学看到了某衣服上面如图的标签,引发了对所学知识中材料的相关联想,小明同学的下列想法中正确的是 。品名:风衣
颜色:红色
号型:170/92A
面料:涤纶 56%棉 44%
等级:合格
A、该衣服中的材料有些是采用化工方法生产的,生产过程中会带来大量污染,因此我们应该拒绝这些材料的使用 B、化学给我们带来了大量的好处,因此我们应该不计任何代价大力发展化学工业 C、用灼烧的方法可区分棉纤维与聚酯纤维二、填空题
-
12. 我县柘沟镇石灰石资源丰富,请根据所学知识用化学用语回答下列问题。(1)、石灰石的主要成分为。(2)、利用石灰石能够制得一种用途广泛的碱,这种碱为。(3)、石灰石高温煅烧时生成两种非常重要的物质,其中属于氧化物的是。(4)、用石灰浆粉刷墙壁,干燥后墙面变硬的原因是。(用化学方程式表示)13. 四月份,曲阜突发新冠疫情,为了帮助曲阜渡过难关,泗水派出一只医疗队支援曲阜,在整个抗疫过程中医护人员全身心投入,为守护人民的身心健康做出了巨大的贡献,在抗疫过程中他们用到了如下用品:(1)、口罩作为防疫必需品,为防止病原微生物,颗粒物的直接透过提供一定的物理屏障。常用的一次性医用口罩由口罩体、鼻夹和口罩带组成。口罩体为三层结构,内外两层为纺粘无纺布(聚丙烯),中间层过滤材料为聚丙烯熔喷无纺布。鼻夹由金属裹塑材料制成,口罩带由氦纶弹性带制成。其中,三层材料为(填“有机合成材料”或“合金”)。(2)、75%的酒精是常用消毒剂。酒精的学名叫乙醇,化学式为C2H5OH,它属于(填“有机物”或“无机物”)。(3)、84消毒液(有效成分为NaClO)也是常用消毒剂。使用时务必不能与“洁测灵”(有效成分为HCl)混用,原因是混用会产生一种有毒气体X,其原理: ,则X的化学式为。(4)、84消毒液常用于环境消毒,某次使用的消毒液pH为11.3,该溶液呈性(填“酸”、“中”、“碱”)。其有效成分是一种盐(化学式为NaClO),其对应的酸为次氯酸,你认为次氯酸的化学式应为。14. 绿矾(FeSO4·7H2O)是一种非常重要的化工原料,在工业上常以铁粉为原料制取,请回答:(1)、绿矾的相对分子质量为。(2)、绿矾中硫元素和氧元素的质量比为。
三、综合题
-
15. 从氯碱工业产生的盐泥中回收BaSO4 , 其主要工艺流程如下图。
已知:①盐泥的主要成分为BaSO4、NaCl、Mg(OH)2和CaCO3。
②BaSO4难溶于水,不与盐酸反应。
 (1)、除去NaCl,利用的性质是。(2)、酸溶槽中发生中和反应的化学方程式为。(3)、过滤器中分离出来的固体是。16. 覆铜板是制作印刷线路板基本材料。覆铜板中的金属Sn占2-10%,Cu占90-98%。简易工艺流程如图所示:
(1)、除去NaCl,利用的性质是。(2)、酸溶槽中发生中和反应的化学方程式为。(3)、过滤器中分离出来的固体是。16. 覆铜板是制作印刷线路板基本材料。覆铜板中的金属Sn占2-10%,Cu占90-98%。简易工艺流程如图所示: (1)、将废旧镀锡覆铜板粉碎后,通过步骤②可将其分离为有机树脂材料(固体)和铜锡粉。根据化学常识回答,此工艺利用的是的性质(填字母代号)。
(1)、将废旧镀锡覆铜板粉碎后,通过步骤②可将其分离为有机树脂材料(固体)和铜锡粉。根据化学常识回答,此工艺利用的是的性质(填字母代号)。a溶解性不同 b密度不同 c沸点不同
(2)、步骤④中涉及的分离操作是(填操作名称)。(3)、设计步骤⑦的主要目的是。(4)、步骤⑨中涉及的主要化学方程式为。17.(1)、(一)气体制备、收集是初中化学的重要知识。请结合下图回答有关问题。
写出图中仪器a的名称:。
(2)、实验室用氯酸钾和二氧化锰制取氧气,应选择的发生装置为(填字母)。(3)、用装置C代替装置B制取二氧化碳的优点是:。用D装置收集二氧化碳,则气体应从(填“①”或“②”)端进入。(4)、用质软的塑料瓶收集满两瓶二氧化碳气体。向其中一瓶加入约1/3体积的水(如图F所示),立即旋紧瓶盖,振荡。观察塑料瓶最终的现象: , 产生该现象的原因。 (5)、(二)实验室有一包久置的生铁粉末(成分为碳、铁和氧化铁)。为测定各组分的质量分数,小怡取两份质量均为的生铁粉末样品,分别进行如下实验:
(5)、(二)实验室有一包久置的生铁粉末(成分为碳、铁和氧化铁)。为测定各组分的质量分数,小怡取两份质量均为的生铁粉末样品,分别进行如下实验:Ⅰ.测定碳的含量

已知:过氧化氢溶液能将Fe2+转化为Fe3+。
步骤①的具体实验操作中包括过滤,此操作中玻璃棒的作用是。
(6)、生成滤渣丙的化学方程式为。(7)、Ⅱ.测定氧化铁质量分数下图所示装置气密性良好。硬质玻璃管中放入样品2,打开止水夹K,在球形干燥管出口处检验氢气纯净后,点燃酒精灯,待充分反应后,熄灭酒精灯,冷却至室温,关闭止水夹K。

打开止水夹K,观察到装置甲中的实验现象是。
(8)、若无装置乙,会导致测得氧化铁的质量分数(填“偏大”“偏小”或“不变”)。(9)、实验过程中无污染性气体生成,且实验结束,硬质玻璃管中剩余固体只为单质铁(提示:碳与氧化铁、氢气与氧化铁均反应),丁装置中浓硫酸质量比实验前增重了0.54g,则m=g(结果精确到0.01)。四、计算题
-
18. 碳酸氢钠是面点膨松剂的主要成分之一。
小芳同学研究反应2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑中NaHCO3与CO2之间量的关系。
(1)、理论计算:1.26gNaHCO3粉末与足量稀硫酸反应,计算生成CO2的质量(写出计算过程)。(2)、实验分析:小芳用如图装置进行实验,向盛有足量稀硫酸的锥形瓶中加入1.26g NaHCO3粉末,完全反应至不再产生气泡。称取反应前后质量如下表,发现反应前后质量变化值(填“大于”、“小于”或“等于”)生成CO2质量的理论值,原因可能是。
反应前
反应后
NaHCO3/g
锥形瓶+稀硫酸/g
锥形瓶+反应后溶液/g
1.26
24.59
25.36