山东省济南市莱芜区2022年中考二模化学试题
试卷更新日期:2022-06-01 类型:中考模拟
一、单选题
-
1. 扬州拥有众多非物质文化遗产项目,下列过程涉及化学变化的是( )A、玉石雕刻
 B、纸张裁剪
B、纸张裁剪  C、木料打磨
C、木料打磨  D、腐乳发酵
D、腐乳发酵  2. 2022年央视“3·15”晚会曝“土坑”酸菜食品问题后,食品安全再次引起人们的高度关注。下列有关加工食品的做法合理的是( )A、焙制糕点时可以加入适量的小苏打作膨松剂 B、用工业石蜡等涂抹在苹果表面给苹果“保鲜” C、餐饮店食材过期后仍继续使用,做成饮品出售 D、加工袋装食品时过量使用食品添加剂3. 规范的实验操作是进行科学实验的重要保障。下列有关实验操作的说法中合理的是( )A、蒸发时,当水分蒸干时停止加热 B、实验室用CO还原Fe2O3 , 应先通入CO气体,然后用酒精喷灯加热 C、测定某溶液的pH,应先用蒸馏水将pH试纸润湿,再进行测定 D、稀释浓硫酸时,把浓硫酸沿器壁慢慢注入盛有水的量筒中,并不断搅拌4. 化学与工农业生产密不可分,下列说法或做法正确的是( )A、玻璃钢和不锈钢都是金属材料 B、用铁桶盛放农药波尔多液安全稳定 C、铵态氮肥和熟石灰混合使用可增加肥效 D、燃烧加入脱硫剂的煤炭可以减少空气污染5. 世界万物都是由极其微小的粒子构成的,下列有关分子、原子、离子的说法错误的是( )A、铁是由铁原子构成的 B、Na+、 、Ba2+、Cl-四种离子在溶液中可以共存 C、保持氧气化学性质的最小微粒是氧分子 D、水通电分解的过程中,分子的种类发生了变化6. 山东大学利用异核双金属“镍-钴”配合物,可逆地催化质子还原氢气(H2)与氘水(D2O)的H/D交换,镍在元素周期表中的信息如图1所示,镍离子结构示意图如图2所示,下列说法错误的是( )
2. 2022年央视“3·15”晚会曝“土坑”酸菜食品问题后,食品安全再次引起人们的高度关注。下列有关加工食品的做法合理的是( )A、焙制糕点时可以加入适量的小苏打作膨松剂 B、用工业石蜡等涂抹在苹果表面给苹果“保鲜” C、餐饮店食材过期后仍继续使用,做成饮品出售 D、加工袋装食品时过量使用食品添加剂3. 规范的实验操作是进行科学实验的重要保障。下列有关实验操作的说法中合理的是( )A、蒸发时,当水分蒸干时停止加热 B、实验室用CO还原Fe2O3 , 应先通入CO气体,然后用酒精喷灯加热 C、测定某溶液的pH,应先用蒸馏水将pH试纸润湿,再进行测定 D、稀释浓硫酸时,把浓硫酸沿器壁慢慢注入盛有水的量筒中,并不断搅拌4. 化学与工农业生产密不可分,下列说法或做法正确的是( )A、玻璃钢和不锈钢都是金属材料 B、用铁桶盛放农药波尔多液安全稳定 C、铵态氮肥和熟石灰混合使用可增加肥效 D、燃烧加入脱硫剂的煤炭可以减少空气污染5. 世界万物都是由极其微小的粒子构成的,下列有关分子、原子、离子的说法错误的是( )A、铁是由铁原子构成的 B、Na+、 、Ba2+、Cl-四种离子在溶液中可以共存 C、保持氧气化学性质的最小微粒是氧分子 D、水通电分解的过程中,分子的种类发生了变化6. 山东大学利用异核双金属“镍-钴”配合物,可逆地催化质子还原氢气(H2)与氘水(D2O)的H/D交换,镍在元素周期表中的信息如图1所示,镍离子结构示意图如图2所示,下列说法错误的是( ) A、镍元素位于元素周期表的第三周期 B、镍原子在化学反应中易失去电子 C、镍原子核外电子数为28 D、镍原子的相对原子质量为58.697. 中国诗词既蕴含人文思想,又焕发理性光辉。对下列诗词所涉及的化学知识解释不合理的是( )A、“春蚕到死丝方尽,蜡炬成灰泪始干”中的“丝”在灼烧时会产生烧焦羽毛气味 B、“千淘万漉虽辛苦,吹尽狂沙始到金”说明金的化学性质稳定,在自然界中常以单质状态存在 C、“煮豆燃豆萁,豆在釜中泣”,这里的能量变化主要是化学能转化为热能 D、“粉身碎骨浑不怕,要留清白在人间”中涉及的化学反应均为化合反应8. 构建化学基本观念是学好化学的基础。下列对化学基本观念的认识中,错误的是( )A、微粒观:水结成冰的过程中,水分子本身没有改变, B、转化观:金属镁在一定条件下可以转化为氧化镁 C、守恒观:8g氢气和8g氧气反应,一定生成16g水 D、元素观:一氧化碳、二氧化碳都是由碳元素和氧元素组成的9. 逻辑推理是一种重要的化学思维方法。下列推理合理的是( )A、由一种元素组成的纯净物一定是单质,所以单质一定只含有一种元素 B、有机物都含碳元素,所以含碳元素的化合物一定是有机物 C、在同一化合物中,金属元素显正价,则非金属元素一定显负价 D、因为碱溶液呈碱性,所以显碱性的溶液一定都是碱的溶液10. 向40g盐酸和氯化铜的混合溶液中慢慢加入20%的氢氧化钠溶液并振荡,所加氢氧化钠溶液的质量与生成沉淀的质量的关系如图所示,下列判断错误的是( )
A、镍元素位于元素周期表的第三周期 B、镍原子在化学反应中易失去电子 C、镍原子核外电子数为28 D、镍原子的相对原子质量为58.697. 中国诗词既蕴含人文思想,又焕发理性光辉。对下列诗词所涉及的化学知识解释不合理的是( )A、“春蚕到死丝方尽,蜡炬成灰泪始干”中的“丝”在灼烧时会产生烧焦羽毛气味 B、“千淘万漉虽辛苦,吹尽狂沙始到金”说明金的化学性质稳定,在自然界中常以单质状态存在 C、“煮豆燃豆萁,豆在釜中泣”,这里的能量变化主要是化学能转化为热能 D、“粉身碎骨浑不怕,要留清白在人间”中涉及的化学反应均为化合反应8. 构建化学基本观念是学好化学的基础。下列对化学基本观念的认识中,错误的是( )A、微粒观:水结成冰的过程中,水分子本身没有改变, B、转化观:金属镁在一定条件下可以转化为氧化镁 C、守恒观:8g氢气和8g氧气反应,一定生成16g水 D、元素观:一氧化碳、二氧化碳都是由碳元素和氧元素组成的9. 逻辑推理是一种重要的化学思维方法。下列推理合理的是( )A、由一种元素组成的纯净物一定是单质,所以单质一定只含有一种元素 B、有机物都含碳元素,所以含碳元素的化合物一定是有机物 C、在同一化合物中,金属元素显正价,则非金属元素一定显负价 D、因为碱溶液呈碱性,所以显碱性的溶液一定都是碱的溶液10. 向40g盐酸和氯化铜的混合溶液中慢慢加入20%的氢氧化钠溶液并振荡,所加氢氧化钠溶液的质量与生成沉淀的质量的关系如图所示,下列判断错误的是( ) A、最终生成沉淀的质量9.8克 B、向B点所处的溶液中加入无色酚酞试液,溶液会变为红色 C、在整个反应的过程中,氯化钠在溶液中的质量分数不断的增大 D、当加入氢氧化钠溶液为60克(即A点)时,所得溶液中的溶质只含氯化钠
A、最终生成沉淀的质量9.8克 B、向B点所处的溶液中加入无色酚酞试液,溶液会变为红色 C、在整个反应的过程中,氯化钠在溶液中的质量分数不断的增大 D、当加入氢氧化钠溶液为60克(即A点)时,所得溶液中的溶质只含氯化钠二、多选题
-
11. 3月30日10时29分,长征十一号遥十运载火箭在酒泉卫星发射中心腾空而起,成功将三颗卫星送入预定轨道,发射任务取得圆满成功,长十一火箭2022年宇航发射首战告捷。火箭在发射过程中,发生反应的微观过程示意图如下,下列说法错误的是( )
 A、反应前后氮元素的化合价没有发生改变 B、乙的相对分子质量是32g C、反应前后氧元素的质量不变 D、生成的丙和丁的分子个数比是3:212. 已知某无色溶液X是NaOH溶液和稀硫酸两者之一,又知甲、乙、丙三种试剂分别是BaCl2溶液、Na2CO3溶液、NH4Cl溶液三种溶液中的各一种。取三等份无色溶液X,分别向其中加入适量的甲、乙、丙三种试剂,产生的现象如下表所示。则依据实验现象做出的下列推断中,合理的是( )
A、反应前后氮元素的化合价没有发生改变 B、乙的相对分子质量是32g C、反应前后氧元素的质量不变 D、生成的丙和丁的分子个数比是3:212. 已知某无色溶液X是NaOH溶液和稀硫酸两者之一,又知甲、乙、丙三种试剂分别是BaCl2溶液、Na2CO3溶液、NH4Cl溶液三种溶液中的各一种。取三等份无色溶液X,分别向其中加入适量的甲、乙、丙三种试剂,产生的现象如下表所示。则依据实验现象做出的下列推断中,合理的是( )加入试剂
甲
乙
丙
实验现象
有气泡冒出
无明显现象
产生沉淀
A、溶液X一定是NaOH溶液 B、溶液X一定是稀硫酸 C、甲一定是NH4Cl溶液 D、丙一定是BaCl2溶液13. 下列实验操作能达到实验目的的是( )选项
实验目的
实验方法
A
分离获取空气中的主要组成成分
先将空气液化,再升温逐一气化
B
区分羊毛制品和化纤制品
取样灼烧,闻气味
C
鉴别黄金和黄铜(铜锌合金)
分别加入稀盐酸,观察现象
D
除去NaCl固体中混有的少量Na2SO4杂质
加入过量BaCl2溶液,过滤
A、A B、B C、C D、D14. 为了探究金属与盐溶液的反应规律,将一定质量的锌粉和银粉加入Cu(NO3)2溶液中,充分反应,实验过程及实验现象如下图所示,则下列判断中正确的是( )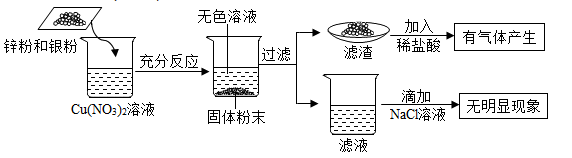 A、滤液中可能含有Ag+ B、反应后滤液的质量大于原Cu(NO3)2溶液的质量 C、滤渣中一定含有单质铜、银、锌 D、把锌粉和银粉加入Cu(NO3)2溶液中,共发生了两个化学反应15. 向Mg与MgCO3的混合粉末中加入100g9.8%的H2SO4溶液,恰好完全反应后得到不饱和溶液甲和气体乙。将生成的气体乙通入足量NaOH溶液,溶液质量增加2.2g。以下说法正确的是( )A、溶液甲中溶质的质量为12g B、与Mg粉反应的H2SO4溶液的质量为50g C、原固体粉末的质量为5.4g D、生成氢气的质量为0.2g
A、滤液中可能含有Ag+ B、反应后滤液的质量大于原Cu(NO3)2溶液的质量 C、滤渣中一定含有单质铜、银、锌 D、把锌粉和银粉加入Cu(NO3)2溶液中,共发生了两个化学反应15. 向Mg与MgCO3的混合粉末中加入100g9.8%的H2SO4溶液,恰好完全反应后得到不饱和溶液甲和气体乙。将生成的气体乙通入足量NaOH溶液,溶液质量增加2.2g。以下说法正确的是( )A、溶液甲中溶质的质量为12g B、与Mg粉反应的H2SO4溶液的质量为50g C、原固体粉末的质量为5.4g D、生成氢气的质量为0.2g三、填空题
-
16. 回答下列问题。(1)、请从K、Ca、O、H、Cl、N、S、C元素中选择适当的元素,写出符合下列要求物质的化学式。
①能作为燃料的氧化物。
②一种可做复合肥的盐。
③农业上改良酸性土壤的碱。
④一种具有挥发性的酸。
(2)、科学防疫,化学助力。我们应该运用所学知识进行防护。①杀菌消毒,消灭新冠病毒。氯气(Cl2)是一种重要的消毒剂。发生如下反应: ,X的化学式为;除氯气外,过氧乙酸(C2H4O3)也是高效消毒剂,它属于。(填“有机物”、“无机物”或“氧化物”);欲将200g20%的过氧乙酸稀释为5%,需加入水的质量为g。
②科学戴口罩,对于新冠肺炎具有预防作用。口罩已经成为新冠肺炎疫情防控的必需品。佩戴口罩隔离新冠肺炎病毒,跟化学实验基本操作中的原理相似。口罩中的鼻梁条起着将口罩固定在鼻梁上的作用,其材质常见的有:铝、塑料、镀锌铁等。其中塑料属于材料:铁表面镀锌因其能隔绝水和 , 从而防止铁的锈蚀。
③做好防护,阻隔病毒入侵。根据同学们掌握的疫情防护知识,下列说法错误的是。
a.居家生活做到合理饮食、加强锻炼 b.坐公交车时尽量避免用手触摸车上物品
c.注意保持房间环境清洁和适当通风 d.多聚会,多聊天,缓解紧张情绪
17. 见证中国力量,实现民族复兴。(1)、2021年10月16日中国神舟十三号载人飞船发射取得圆满成功,举国欢庆。航空航天技术已经成为一个国家科技、工业和国防实力的重要体现。航天工程中需要大量的金属材料,如铝合金、钛合金等。
①铝具有很好的抗腐蚀性的原因是(用化学方程式表示)。
②如图是钛(Ti)原子结构示意图,图中x=;其在化学反应中,易失去电子形成离子,其离子符号为。
③卫星上的太阳能电池是将能转化为电能的装置。
④火箭的姿控系统使用耐辐照石英玻璃作为光学材料,其主要成分为二氧化硅,其中硅元素的化合价为。
⑤国际空间站有的用固体燃料氧气发生器制取氧气,很多宇航员将其亲切地称为“氧气蜡烛”,原理是点燃氯酸钠(NaClO3)和铁的固体粉末,产物中还有氧化亚铁和一种常见可做调味品的盐。写出该反应的化学方程式。
(2)、1926年我国著名化学家侯德榜先生创立了侯氏制碱法,促进了世界制碱技术的发展。①“侯氏制碱法“过程中,向饱和的氯化钠溶液中先后通入的两种气体是(填化学式),生成物中先结晶析出(填化学式)。
②Na2CO3和NaCl两种物质的溶解度曲线如图所示。若把t1℃时Na2CO3和NaCl的饱和溶液,均升温到t2℃,则t2℃时Na2CO3溶液的溶质质量分数NaCl溶液的溶质质量分数(填“大于”、“小于”、“等于之一)。
③t2℃时,NaCl的饱和溶液溶质质量分数36%(填写“大于”、“等于”、“小于”之一)
④t2℃时,向50g水中加入40gNa2CO3固体,经充分搅拌后,所得溶液的质量为g。
 18. 如图所示为实验室中常见气体制备、净化、干燥、收集和进行实验探究的部分仪器(组装实验置时,可重复选择仪器),某小组的同学利用其进行下列各实验。
18. 如图所示为实验室中常见气体制备、净化、干燥、收集和进行实验探究的部分仪器(组装实验置时,可重复选择仪器),某小组的同学利用其进行下列各实验。 (1)、实验室制取气体是我们化学中的重要实验操作,请根据所学知识回答下列问题:
(1)、实验室制取气体是我们化学中的重要实验操作,请根据所学知识回答下列问题:①以过氧化氢溶液为原料(二氧化锰作催化剂),在实验室中制取并收集干燥的氧气。请写出该反应的化学方程式 , 所选装置的连接顺序为。
②利用制取氧气的发生和收集装置还能制取另外一种常见气体,利用此装置制取该气体的化学方程式为。
③下列有关气体制取和性质的描述中,错误的是。
A.实验室制取气体时,应先检查装置气密性,再加入药品
B.做铁丝在纯氧中燃烧实验时,集气瓶中要预先加少量水或铺一层细沙
C.CO2通入氢氧化钠溶液中会产生白色沉淀
D.制取O2时,二氧化锰在反应前后质量和性质都不变
(2)、用氧气对某纸试样的组成进行分析实验(资料显示纸试样只含C、H、O三种元素)。所选装置按“气体→A1→D→A2→C→碱石灰干燥管”的顺序连接(假设所发生的化学反应都充分进行),若装置D的玻璃管中放入纸试样的质量为4g,充分反应后,测得装置A2的质量增加1.8g,装置C的质量增加4.4g,则纸试样中氧元素的质量分数为;若在实验中不连A1 , 则所测得的纸试样中氧元素的质量分数(填“偏大”或“无影响”或“偏小”)。(3)、某同学利用水煤气(主要成分为CO和H2 , 含有少量水蒸气)来测定8g氧化铁样品中氧化铁的质量分数(杂质为Fe)。仪器的连接顺序为水煤气→A1→E→A2→C。①装置E中的现象为 , 装置A1所起的作用是。
②为测定氧化铁的纯度,实验小组测得如下数据:
装置
A1
E
A2
C
增重(减轻)的质量
0.18g
1.2g
0.45g
2.2g
根据实验数据,测得该样品中氧化铁的质量分数为。
③若该反应未完全进行,则分离出反应后混合物中铁粉可用的物理方法为。
④该实验过程中存在设计不当之处,请叙述具体的改进方法。
19. “化学实验→观察现象→分析推理→得出结论”是化学学习的方法之一。(1)、实验室有两瓶黑色粉末分别是铁粉和氧化铜。小明同学在稀硫酸、氢氧化钠溶液两种试剂中选择了进行实验,结果出现了的现象,他认定该黑色粉末为铁粉。(2)、小明利用实验中的铁粉、氧化铜和稀硫酸设计了制取单质铜的实验:方法一:
方法二:
上述两种方法中,你认为方法(填“一”或“二”)更好,原因是。
(3)、已知某固体样品A可能是NaNO3和NH4Cl或两者之一,另有一固体样品B,其中可能含有CaO、MgCl2、Na2SO4、BaCl2四种物质中的一种或多种。按如图所示进行实验,出现的现象如图中所述(假设过程中所有可能发生的反应都恰好完全进行)
①产生的气体F是(写化学式),能使湿润的红色石蕊试纸变色。
②沉淀E的化学式是。
③写出步骤③中发生的化学方程式:。
④溶液D中肯定存在的阴离子有(写离子符号)。
⑤固体A中一定不存在的物质是(写化学式),理由是。
20. 氢氧化钠,俗称“烧碱”,一种白色固体,是化学实验室中必备的化学品,亦为常见的化工品之一。氢氧化钠的用途极广,用于造纸、印染、制备肥皂、化学纤维、冶炼金属、石油精制等方面。工业上用纯碱和石灰石为原料制备烧碱,主要流程如图所示: (1)、过程①发生反应的化学方程式为;过程②的反应属于反应(填放热或吸热)。(2)、从微观上看过程④发生反应的实质为。(3)、在上述①一④的生产过程中,没有涉及到的基本反应类型是反应。(4)、小雪同学为探究氢氧化钠固体是否已变质,设计以下方案:取少量固体溶于水中,滴加几滴无色酚酞试液,若酚酞试液变红色,则证明氢氧化钠固体没有变质。你认为她的实验方案是否合理并说明理由。(5)、若氢氧化钠固体已经部分变质,可以采用加入氢氧化钙溶液的方法除去其中的杂质碳酸钠。现将10g氢氧化钠样品置于干净的烧杯中,加入100g水使固体完全溶解,向该溶液中不断加入氢氧化钙溶液,产生沉淀的质量与加入氢氧化钙溶液的质量关系如图所示。试回答下列问题:
(1)、过程①发生反应的化学方程式为;过程②的反应属于反应(填放热或吸热)。(2)、从微观上看过程④发生反应的实质为。(3)、在上述①一④的生产过程中,没有涉及到的基本反应类型是反应。(4)、小雪同学为探究氢氧化钠固体是否已变质,设计以下方案:取少量固体溶于水中,滴加几滴无色酚酞试液,若酚酞试液变红色,则证明氢氧化钠固体没有变质。你认为她的实验方案是否合理并说明理由。(5)、若氢氧化钠固体已经部分变质,可以采用加入氢氧化钙溶液的方法除去其中的杂质碳酸钠。现将10g氢氧化钠样品置于干净的烧杯中,加入100g水使固体完全溶解,向该溶液中不断加入氢氧化钙溶液,产生沉淀的质量与加入氢氧化钙溶液的质量关系如图所示。试回答下列问题:
①当加入氢氧化钙溶液的质量至图中B点时,溶液中含有的溶质为(写化学式)。
②向溶液中加入一定量氢氧化钙溶液时,两种物质恰好完全反应。试通过计算,求此时反应后所得溶液中溶质的质量(计算结果精确到0.1g)。