山东省菏泽市牡丹区2022年中考二模化学试题
试卷更新日期:2022-06-01 类型:中考模拟
一、单选题
-
1. 纪录片《我在故宫修文物》表现了文物修复者穿越古今与百年之前的人进行对话的职业体验,让我们领略到历史与文化的传承。下列文物修复和保护的过程中涉及化学变化的是( )
A
B
C
D




银器用除锈剂见新
变形的金属香炉复原
古画水洗除尘
木器表面擦拭烫蜡
A、A B、B C、C D、D2. 思维模型的建构既方便问题的解决,又能促进深度学习。某同学对解决“气密性检查”类问题建构的思维模型为:构建封闭体系→改变压强→观察现象→得出结论,其中改变封闭体系内气体压强方法较多,如加热法、冷却法、加水压缩法、用注射器压缩法等。下列装置气密性不好的是( )A、 关闭分液漏斗活塞,向右拉动注射器活塞,松手后注射器活塞又弹回
B、
关闭分液漏斗活塞,向右拉动注射器活塞,松手后注射器活塞又弹回
B、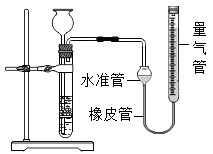 长颈漏斗加水至浸没下端,从量气管加水,水准管内液面低于量气管内液面
C、
长颈漏斗加水至浸没下端,从量气管加水,水准管内液面低于量气管内液面
C、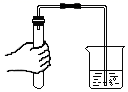 导气管放入水中,导管内液面低于烧杯内液面;或者手握试管,导管口有气泡
D、
导气管放入水中,导管内液面低于烧杯内液面;或者手握试管,导管口有气泡
D、 关闭弹簧夹,从长颈漏斗加水液封下端;继续加水,长颈漏斗内液面与试管液面相平
3. 根据如下微观示意图分析,下列结论正确的是( )
关闭弹簧夹,从长颈漏斗加水液封下端;继续加水,长颈漏斗内液面与试管液面相平
3. 根据如下微观示意图分析,下列结论正确的是( ) A、该反应不遵循质量守恒定律 B、该反应前后氧元素化合价不变 C、参加反应的甲与乙的质量比为15:56 D、该反应生成的丙与丁的分子个数比为1:14. 如图所示的四个图像,能正确反映对应变化关系的是( )A、
A、该反应不遵循质量守恒定律 B、该反应前后氧元素化合价不变 C、参加反应的甲与乙的质量比为15:56 D、该反应生成的丙与丁的分子个数比为1:14. 如图所示的四个图像,能正确反映对应变化关系的是( )A、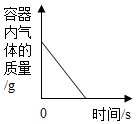 图①:足量的碳在盛有氧气的密闭容器内充分燃烧
B、
图①:足量的碳在盛有氧气的密闭容器内充分燃烧
B、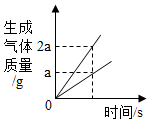 图②:在电解器玻璃管里加满水,用惰性电极进行电解
C、
图②:在电解器玻璃管里加满水,用惰性电极进行电解
C、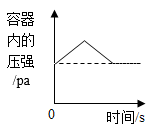 图③:红磷在盛有一定量空气的密闭容器中燃烧至熄灭
D、
图③:红磷在盛有一定量空气的密闭容器中燃烧至熄灭
D、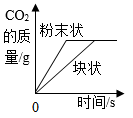 图④:等质量CaCO3分别与等质量等质量分数的稀盐酸(足量)反应
5. 配制100g溶质的质量分数为16%的NaCl溶液。下列说法错误的是( )
图④:等质量CaCO3分别与等质量等质量分数的稀盐酸(足量)反应
5. 配制100g溶质的质量分数为16%的NaCl溶液。下列说法错误的是( )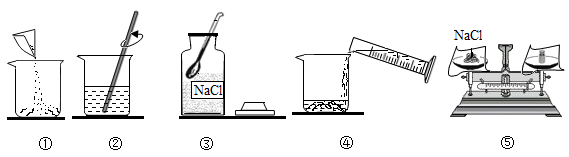 A、实验操作顺序为③⑤①④② B、配制好的溶液倒出10mL,剩余溶液浓度变小 C、需称量NaCl的质量为16g D、选用100mL量筒量取所需的水6. 抗日战争时期,八路军在缺枪少弹的情况下自制了土地雷,土地雷主要由瓦罐、雷管及黑火药(反应原理: )组成,下列说法错误的是( )A、KNO3中N的化合价为+5 B、X的化学式为N2 C、该反应不在基本反应类型之中 D、硝酸钾在农业上可作为氮肥且不能与碱性物质共用7. 下列对某一主题的知识归纳,有错误的是( )
A、实验操作顺序为③⑤①④② B、配制好的溶液倒出10mL,剩余溶液浓度变小 C、需称量NaCl的质量为16g D、选用100mL量筒量取所需的水6. 抗日战争时期,八路军在缺枪少弹的情况下自制了土地雷,土地雷主要由瓦罐、雷管及黑火药(反应原理: )组成,下列说法错误的是( )A、KNO3中N的化合价为+5 B、X的化学式为N2 C、该反应不在基本反应类型之中 D、硝酸钾在农业上可作为氮肥且不能与碱性物质共用7. 下列对某一主题的知识归纳,有错误的是( )A.化学与安全
B.化学与材料
重金属中毒-可喝鲜牛奶解毒
煤气泄漏-应关闭气阀、开窗通风
油锅着火-加入新鲜蔬菜
棉麻,羊毛、锦纶-天然纤维
塑料、聚乙烯、铝合金-合成材料
废弃的塑料制品-造成“白色污染”
C.化学与生活
D.化学与健康
熟石灰,大理石-都可用做建筑材料
病人输入葡萄糖溶液-及时补充能量
生活中降低水硬度-加热煮沸
缺铁-易得贫血症
缺氟-易得龋齿
维生素-可调节新陈代谢、预防疾病
A、A B、B C、C D、D8. 类推是一种重要的学习方法,但如果不具体问题具体分析就会产生错误的结论。下列类推结论错误的是( )①盐是由金属阳离子与酸根离子构成,因此盐中一定含有金属元素
②NaOH溶液能使无色酚酞试液变红色,因此Cu(OH)2也能使无色酚试液变红
③复分解反应前后元素的化合价不变,则反应前后元素化合价不变的反应一定是复分解反应
④在化合物里,正负化合价的代数和为零,所以在同一化合物中金属元素显正价,则非金属元素一定显负价
⑤钢铁锈蚀是与氧气、水共同作用的结果,所以防止钢铁锈蚀必须同时隔绝与氧气和水的接触
A、①②③④⑤ B、①②③⑤ C、②④⑤ D、①③④9. 下列有关物质的检验、鉴别、分离、除杂的实验方案正确的是( )选项
实验目的
实验方案
A
检验二氧化碳气体
用燃着的木条伸入集气瓶内,观察火焰是否熄灭
B
鉴别BaCO3、NaCl、
NaOH、CuSO4四种固体
分别取少量固体于试管中加入适量水,观察现象
C
分离MgCl2、NaCl固体混合物
依次加入水和适量 Ca(OH)2 溶液,过滤后向沉淀中加入适量盐酸,再蒸发两种溶液得到固体
D
除去CuO少量的Cu
加足量稀盐酸,充分反应后再过滤
A、A B、B C、C D、D10. 为确定某溶液中含有以下离子H+、Mg2+、Ba2+、Cl-、 、 中的几种,进行了以下实验:①经测定,溶液pH=1;
②取部分未知溶液加入过量NaOH溶液,有白色沉淀产生;
③取②中部分溶液加入Na2CO3溶液,无明显现象。
分析上述实验,下面对溶液中含有离子的判断,正确的是( )
A、一定含有H+、Mg2+、Ba2+、Cl-、 B、一定含有H+、Mg2+、Cl- , 一定不含有 C、一定含有H+、Ba2+ , ,一定不含有Cl- D、一定含有H+、Mg2+ , 可能同时含有Cl-、二、填空题
-
11. 图一是锶元素在周期表中的信息,图二是几种粒子的结构示意图。请回答:

 (1)、图一中锶原子的相对原子质量为;(2)、图二中和粒子①化学性质相似的是(填序号);图二中表示阳离子的是(填符号);元素②与元素⑤组成的化合物的化学式。12. 如图1为甲、乙两种固体物质的溶解度曲线。
(1)、图一中锶原子的相对原子质量为;(2)、图二中和粒子①化学性质相似的是(填序号);图二中表示阳离子的是(填符号);元素②与元素⑤组成的化合物的化学式。12. 如图1为甲、乙两种固体物质的溶解度曲线。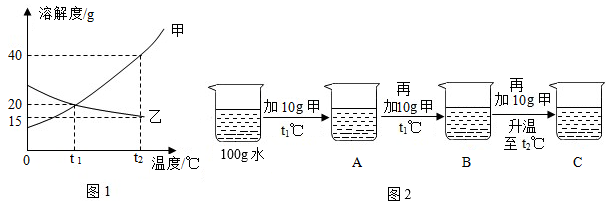 (1)、某同学按图2所示进行实验,得到相应温度下的A、B、C溶液,在A、B、C三种溶液中属于饱和溶液的是(填字母)。向溶液C中再加入25g甲,充分搅拌,恢复到t2℃时,所得溶液中溶质的质量为g。(2)、将t2℃时等质量的甲、乙两种物质的饱和溶液降温至t1℃,下列说法正确的是__________。A、降温后,甲溶液的质量大于乙溶液的质量 B、降温前,甲溶液中溶剂的质量比乙溶液中溶剂的质量小 C、降温后,甲溶液的质量分数大于乙溶液的质量分数 D、降温前后乙溶液的质量分数保持不变
(1)、某同学按图2所示进行实验,得到相应温度下的A、B、C溶液,在A、B、C三种溶液中属于饱和溶液的是(填字母)。向溶液C中再加入25g甲,充分搅拌,恢复到t2℃时,所得溶液中溶质的质量为g。(2)、将t2℃时等质量的甲、乙两种物质的饱和溶液降温至t1℃,下列说法正确的是__________。A、降温后,甲溶液的质量大于乙溶液的质量 B、降温前,甲溶液中溶剂的质量比乙溶液中溶剂的质量小 C、降温后,甲溶液的质量分数大于乙溶液的质量分数 D、降温前后乙溶液的质量分数保持不变三、科普阅读题
-
13. 阅读下面科普短文。
茶叶中含有大量的茶多酚。茶多酚是白色粉末,易溶于水,还可溶于乙醇,味苦涩,具有抗氧化、延缓衰老、降血脂和降血糖等功能,在食品、医药、日化、保健等方面具有广泛的应用前景。不同茶叶中茶多酚的含量不同,这与茶叶的加工工艺以及发酵程度有关,下为中国六大类茶叶中茶多酚含量的测定结果:
样品名称
绿茶
白茶
黄茶
青茶
红茶
黑茶
发酵程度
未发酵
微发酵
轻发酵
半发酵
全发酵
后发酵
茶多酚含量
34.79%
32.53%
32.33%
20.04%
17.36%
17.08%
研究人员选用绿茶与白茶,分别提取出不同浓度茶多酚提取液,进行总抗氧化能力(FRAP)实验,并与高效抗氧化剂Vc的总抗氧化能力进行对比,测定结果如下图所示。

实验表明,茶多酚确实具有较好的抗氧化活性,是人体自由基的清除剂,有助于延缓衰老,日常生活中可通过饮茶获得。一般来说,茶汤越浓,越苦涩、回甘越好说明茶汤中含的茶多酚浓度越大,但不是所有人都适合饮茶,有胃病的人如采饮茶过量或过浓,易引起胃肠道的病理变化,并形成溃疡。因此,科学合理饮茶才有利于身体健康。
依据文章内容回答下列问题:
(1)、茶多酚的物理性质有(写出一条即可);(2)、根据表格信息分析,绿茶中茶多酚含量高的原因是。(3)、Vc的化学式为C6H8O6 , 下列关于Vc的说法正确的是__________。A、是一种有机物 B、由三种元素组成 C、1个Vc分子中含有20个原子 D、C,H,O元素质量比为3:4:3(4)、提取茶多酚,除可用水浸的方式,也可以用(填化学式)浸取。四、综合题
-
14. 认识常见物质间的转化和反应关系、理解化学反应的本质等是全面理解物质化学变化的重要内容,请同学们应用所学化学知识解决以下问题:(1)、Ⅰ、A~F是初中化学中常见的六种物质,其中B、C组成元素相同,C、D、E、F是不同类别的化合物,D和E的溶液均呈碱性,且E可用来配置波尔多液,它们相互间的关系如图所示,(图中“-”表示相连的物质两两之间可以发生反应,“→”表示由某一物质转化为另一物质,部分反应物、生成物及反应条件已略去)。请回答:
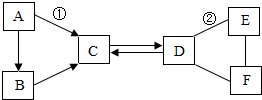
B的化学式。
(2)、写出有关反应的化学方程式:①;②。(3)、II.中和反应的实质可以表示为: 。
像这种用实际参加反应的离子符号来表示反应的式子叫离子方程式。离子方程式中,反应前离子带电荷总数等于反应后离子带电荷总数。请用离子方程式表示图1所示反应。
(4)、III.用溶质质量分数均为10%的稀硫酸和氢氧化钠溶液进行实验,测得溶液酸碱度变化如上图2所示。则A点所含溶质的化学式为。
15. 如图1是实验室常用的一些装置。 (1)、写出图1中仪器名称a。(2)、实验室用装置B与C连接制取并收集氧气,则装置B中反应的化学方程式为。(3)、SO2通常是一种无色有刺激性气味的有毒气体,密度比空气大,易溶于水,排放到空气中会形成酸雨。实验室用图2装置收集一瓶干燥SO2 , 装置中的X是(填名称);导管的连接顺序为(填图2导管口字母)。16. 小红发现,金店里有两种不同的“白金”,单价相差悬殊,小红很好奇,打算进行研究。
(1)、写出图1中仪器名称a。(2)、实验室用装置B与C连接制取并收集氧气,则装置B中反应的化学方程式为。(3)、SO2通常是一种无色有刺激性气味的有毒气体,密度比空气大,易溶于水,排放到空气中会形成酸雨。实验室用图2装置收集一瓶干燥SO2 , 装置中的X是(填名称);导管的连接顺序为(填图2导管口字母)。16. 小红发现,金店里有两种不同的“白金”,单价相差悬殊,小红很好奇,打算进行研究。【查阅资料】市场上所谓的“白金”通常有两种,一种是金、镍、铜、锌的合金,称为白色金;另一种是铂金,铂是一种银白色的贵重金属,用于耐腐蚀的化学仪器及首饰等,俗称“白金”(platinum)…元素符号Pt。小红结合化学课上学习的金属活动性顺序,展开了下列实验活动。
(1)、鉴别两种白金,她的方法可能是(填操作、现象、结论);(2)、探究Zn、Ni(镍)、铜的活动性顺序。【作出假设】对三种金属的活动性顺序提出可能的猜想①Zn>Ni>Cu;②Zn>Cu>Ni;你的猜想是③。
(3)、【查阅资料】小红同学查阅了部分含镍化合物的溶解性如下表。OH-
Cl-
Ni2+
不
溶
溶
溶
【设计实验】同温下,取大小、厚度相同的这三种金属薄片,分别投入等体积等浓度的足量稀盐酸中,观察现象。
【记录现象】请帮助小红把实验现象填写完整
金属
Ni
Zn
Cu
与盐酸反应的现象
气体产生缓慢金属逐渐溶解
气体产生激烈金属迅速溶解
【得出结论】正确的是猜想①;
写出镍与盐酸反应的化学方程式。
(4)、【结论应用】除小红的实验设计外,你能否像小红一样,设计另一组实验,也这样一次验证上述假设的正确与否,你的设计所用的一组物质的化学式是(只写出一组即可)。
五、计算题
-
17. 醋的主要成分是醋酸,其化学式为CH3COOH。醋不仅是调味品,而且有较强的灭菌、抑毒的作用。小明为判断家中的9°米醋含酸量是否合格,取100mL米醋(见标签)于锥形瓶中,然后再向锥形瓶中逐渐加入一定溶质质量分数的碳酸氢钠溶液,反应过程中,当加入碳酸氢钠溶液的质量至以下数值时,对充分反应后锥形瓶中剩余物质的质量进行了记录,测得的部分数据如下,请根据有关信息回答问题:(化学方程式: )

加入碳酸氢钠溶液质量(g)
25
50
100
155
175
锥形瓶内剩余物质质量(g)
123.9
147.8
195.6
248.4
m
(1)、100mL米醋与足量碳酸氢钠溶液反应产生的二氧化碳质量为 , 表中m的数值为。(2)、请通过计算判断该产品含酸量是否合格?(写出计算过程)
-