山东省德州市庆云县2022年中考二模化学试题
试卷更新日期:2022-06-01 类型:中考模拟
一、单选题
-
1. 化学使生活更美好。下列与生产、生活相关的做法中,一定发生了化学变化的是( )A、用稀有气体制多用途电光源 B、在云层中撒布干冰实施人工降雨 C、用白醋除去热水壶中的水垢 D、加热使食盐在水中溶解速度加快2. 下列仪器可以直接加热的是( )A、
 量筒
B、
量筒
B、 试管
C、
试管
C、 烧杯
D、
烧杯
D、 集气瓶
3. 用如图装置进行实验,实验结束后,瓶内剩下的气体主要是( )
集气瓶
3. 用如图装置进行实验,实验结束后,瓶内剩下的气体主要是( )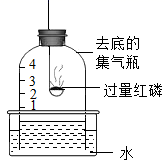 A、氮气 B、氧气 C、稀有气体 D、二氧化碳4. 如图是铁丝在氧气中燃烧的实验示意图,下列有关该实验叙述正确的是( )
A、氮气 B、氧气 C、稀有气体 D、二氧化碳4. 如图是铁丝在氧气中燃烧的实验示意图,下列有关该实验叙述正确的是( ) A、点燃系在细铁丝下端的火柴,立即插入盛有氧气的集气瓶中 B、观察到铁丝剧烈燃烧、火星四射、生成黑色固体 C、该反应的化学方程式为3Fe+2O2=Fe3O4 D、集气瓶底部的水不能用少量细沙代替5. 嫦娥五号完成我国首次月球采样任务,带回1731g月壤,月壤中含有丰富的氦3.已知氦3的质子数为2,中子数为1.氦3的核外电子数为( )A、1 B、2 C、3 D、46. 火药是我国古代四大发明之一,《天工开物》记载:“凡硫黄配硝而后,火药成声”。其反应的化学方程式为: 。则X的化学式为( )A、O2 B、SO2 C、NO2 D、N27. 下列化学方程式书写正确的是( )A、 B、 C、 D、8. 下列实验现象既能体现二氧化碳的物理性质,又能体现其化学性质的是( )A、蜡烛自下而上熄灭
A、点燃系在细铁丝下端的火柴,立即插入盛有氧气的集气瓶中 B、观察到铁丝剧烈燃烧、火星四射、生成黑色固体 C、该反应的化学方程式为3Fe+2O2=Fe3O4 D、集气瓶底部的水不能用少量细沙代替5. 嫦娥五号完成我国首次月球采样任务,带回1731g月壤,月壤中含有丰富的氦3.已知氦3的质子数为2,中子数为1.氦3的核外电子数为( )A、1 B、2 C、3 D、46. 火药是我国古代四大发明之一,《天工开物》记载:“凡硫黄配硝而后,火药成声”。其反应的化学方程式为: 。则X的化学式为( )A、O2 B、SO2 C、NO2 D、N27. 下列化学方程式书写正确的是( )A、 B、 C、 D、8. 下列实验现象既能体现二氧化碳的物理性质,又能体现其化学性质的是( )A、蜡烛自下而上熄灭 B、软塑料瓶变瘪
B、软塑料瓶变瘪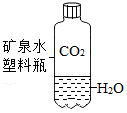 C、石蕊溶液变红
C、石蕊溶液变红 D、气球上浮
D、气球上浮 9. 森林灭火有效方法之一,是在大火蔓延路线的前方清理出一片隔离带,大火会逐渐熄灭,该灭火方法的原理是( )A、隔离空气 B、清除或隔离可燃物 C、隔离氧气 D、降低温度到着火点以下10. 无人机的用途越来越广泛,可以用于航拍、喷洒农药等。制无人机框架宜选用密度小、强度高、硬度较大,化学稳定性好的金属材料,下列材料中最适合做无人机框架的是( )
9. 森林灭火有效方法之一,是在大火蔓延路线的前方清理出一片隔离带,大火会逐渐熄灭,该灭火方法的原理是( )A、隔离空气 B、清除或隔离可燃物 C、隔离氧气 D、降低温度到着火点以下10. 无人机的用途越来越广泛,可以用于航拍、喷洒农药等。制无人机框架宜选用密度小、强度高、硬度较大,化学稳定性好的金属材料,下列材料中最适合做无人机框架的是( ) A、生铁 B、黄铜 C、铝合金 D、纯铝11. 现有铁、铜两种金属,下列哪一种试剂无法判断铁、铜的金属活动性顺序( )A、稀盐酸 B、硫酸铜溶液 C、氯化亚铁溶液 D、硫酸锌溶液12. 某小组利用如图装置进行创新实验。实验时,先加热炭粉,一段时间后将酒精灯移至CuO处加热。下列说法错误的是( )
A、生铁 B、黄铜 C、铝合金 D、纯铝11. 现有铁、铜两种金属,下列哪一种试剂无法判断铁、铜的金属活动性顺序( )A、稀盐酸 B、硫酸铜溶液 C、氯化亚铁溶液 D、硫酸锌溶液12. 某小组利用如图装置进行创新实验。实验时,先加热炭粉,一段时间后将酒精灯移至CuO处加热。下列说法错误的是( ) A、酒精灯加网罩是为了提高火焰温度 B、气球可以收集尾气,防止污染空气 C、反应过程中,黑色氧化铜变为红色固体 D、装置中发生反应:13. 化学课上老师在滤纸上用酚酞试液画漫画,然后再喷洒某种液体X,滤纸上立即显示出红色图像,则X可能是( )A、稀盐酸 B、蒸馏水 C、石灰水 D、食盐水14. 柠檬酸(C6H8O7)是一种较强的有机酸,在水溶液中可以解离出来H+ , 从而呈现酸性,主要用于香料或作为饮料的酸化剂.下列物质不能与柠檬酸反应的是( )
A、酒精灯加网罩是为了提高火焰温度 B、气球可以收集尾气,防止污染空气 C、反应过程中,黑色氧化铜变为红色固体 D、装置中发生反应:13. 化学课上老师在滤纸上用酚酞试液画漫画,然后再喷洒某种液体X,滤纸上立即显示出红色图像,则X可能是( )A、稀盐酸 B、蒸馏水 C、石灰水 D、食盐水14. 柠檬酸(C6H8O7)是一种较强的有机酸,在水溶液中可以解离出来H+ , 从而呈现酸性,主要用于香料或作为饮料的酸化剂.下列物质不能与柠檬酸反应的是( )
A、Mg B、Fe2O3 C、CO2 D、NaOH15. 只用水这一种试剂不能将下列各组固体物质鉴别出来的是( )A、KNO3和NH4NO3 B、CaCO3和CaCl2 C、NaOH和NaCl D、K2SO4和KCl16. 向盛有一定量固体的烧杯中加入某溶液,固体质量变化与图像相符的是( ) A、 中加入过氧化氢溶液 B、 合金中加入稀硫酸 C、 中加入稀盐酸 D、 中加入稀盐酸
A、 中加入过氧化氢溶液 B、 合金中加入稀硫酸 C、 中加入稀盐酸 D、 中加入稀盐酸二、填空题
-
17. 化学与我们的生活、生产、科技密切相关。(1)、中国自主研发的“天问一号”火星探测车已成功登陆火星。硅片太阳能电池板是探测车主要动力来源,硅的元素符号是。(2)、我国具有丰富的海洋资源,海水中含量最多的阳离子是(填离子符号)。(3)、二氧化氯(ClO2)是一种高效、广谱安全的杀菌、消毒剂,可应用于自来水和公共场所的杀菌、消毒处理。ClO2中氯元素的化合价为价。(4)、老师将棉手帕放入55%左右的酒精中浸湿,再用坩埚钳夹住点燃,待火焰熄灭后,棉手帕依然完好的原因。(5)、用石灰浆粉刷墙壁,干燥后墙面变硬的原因。(用化学方程式表示)(6)、某学校为学生准备的午餐食谱如下:米饭、红烧肉、清蒸鱼、凉拌黄瓜、豆腐汤,其中富含维生素的是。18.(1)、Ⅰ.建立“宏观·微观”之间的联系,是化学学习的重要方法。根据图示回答下列问题:


硒元素被科学家称为“抗癌之王"”,科学界研究发现血硒水平的高低与癌的发生息息相关。图一是硒元素的相关信息:硒原子在化学变化中易电子(填“得到”或“失去”)。硒元素的相对原子质量是。
(2)、由图二可知:在元素周期表中,钠、镁、铝元素位于同一周期,是因为它们具有相同的。(3)、科学家发现,利用催化剂可有效消除室内装修材料释放的有害气体甲醛(HCHO)。请根据图三写出反应的化学方程式。(4)、Ⅱ、人们在实验研究中总结出常见金属的活动性顺序:
请在表中 内填写对应的元素符号。
(5)、Mg、Sn、Pb、Cu、Ag五种金属,能与稀盐酸(或稀硫酸)发生置换反应的金属有种。19. 水和溶液在生产生活中用途广泛,请回答下列问题。(1)、自来水厂在净化水的过程中加入活性炭的主要作用是。(2)、生活中的下列物质分别放入水中,可以得到溶液的是 (填序号,下同)。A、面粉 B、食盐 C、植物油 D、酒精(3)、t2℃时,向分别盛有10mL水的Ⅰ、Ⅱ两支试管中分别加入等质量的甲、乙两种固体,充分溶解后,观察到如图1所示的现象。图2是甲、乙两种固体的溶解度曲线。请回答下列问题:
①图2中表示甲物质溶解度曲线的是(填“a”或“b”)。
②乙中混有少量甲,可用法提纯乙。
③t1℃时,甲物质饱和溶液的溶质质量分数是(精确到0.1%)。
20. 物质结构决定性质,物质性质决定用途,反应本质决定变化现象。如图是小明构建的氢氧化钙部分知识网络,其中“—”表示相连物质能发生化学反应,X与图中所给物质的类别不同。请回答: (1)、酚酞试液在Ca(OH)2溶液中显红色,能使酚酞试液变红的离子是。(2)、列举熟石灰Ca(OH)2在工农业上的一种用途:。(3)、X溶液能与Ca(OH)2溶液反应并产生白色沉淀,写出符合该实验现象的一个化学方程式。
(1)、酚酞试液在Ca(OH)2溶液中显红色,能使酚酞试液变红的离子是。(2)、列举熟石灰Ca(OH)2在工农业上的一种用途:。(3)、X溶液能与Ca(OH)2溶液反应并产生白色沉淀,写出符合该实验现象的一个化学方程式。三、科普阅读题
-
21. 阅读下列科普短文,回答有关问题。
石灰岩中悄悄发生的化学变化
石灰石是地壳中最常见的岩石之一,在石灰岩地区,地下水中溶有较多的二氧化碳气体,石灰岩在地下水的不断侵蚀下逐渐溶解,经过漫长的过程形成溶洞。坚硬的石灰石主要成分是碳酸钙,水不会使它溶解,但溶有较多二氧化碳的水可以和它慢慢发生化学反应,把它转化为可以溶解的碳酸氢钙[Ca(HCO3)2],溶解在地下水中。
溶解有较多碳酸氢钙的地下水,在一定条件下会逐渐分解,把“吃掉”的石灰岩重新“吐”出来,形成碳酸钙沉积下来,形成了钟乳石。检验碳酸钙的方法很简单,碳酸钙会在酸性条件下反应生成二氧化碳。我们日常烧水的水壶中经常会结接一些水垢,主要成分也是碳酸钙,倒入食醋进去就可以除水垢,利用也是一样的原理。
钟乳石非常漂亮,可以用来做人造假山,雕刻大尊工艺品等。可是钟乳石的形成周期非常长,需要上万年才能形成。溶洞景观一旦破坏,想要恢复几乎是不可能的,需要政府加强立法,保护钟乳石资源。
(1)、在石灰岩地区,地下水的pH7(填:“>”、“<”或“=”)。(2)、写出碳酸钙转化为碳酸氢钙的化学方程式。(3)、可以向地下水的水样中加入 , 检验其为硬水还是软水。(4)、下列有关钟乳石的说法中,正确的是______(填字母序号)。A、形成周期很长 B、能和食醋反应 C、资源丰富,可以任意开采四、综合题
-
22. 某学习小组利用如图装置制备CO2 , 并模拟自然界中CO2的循环进行实验探究。请回答下列问题。
 (1)、装置B中仪器①的名称是 , 在实验室利用B装置可制取的一种常见气体是 , 反应的化学方程式是。(2)、实验室用稀盐酸和石灰石制取CO2 , 反应的化学方程式为 , 所用发生装置可选用图示中的(填字母序号)。(3)、为得到CO2的水溶液,CO2应从装置C的(填“m”或“n”)端通入。(4)、将CO2的水溶液转移至烧杯,并组装装置如图D所示,置于阳光下一段时间,观察到有气泡产生,检验该气体的方法是。23. 实验课上,老师向滴有无色酚酞试液的NaOH红色溶液中滴加稀HCl,同学们观察到溶液颜色由红色变为无色,说明酸碱发生了中和反应。
(1)、装置B中仪器①的名称是 , 在实验室利用B装置可制取的一种常见气体是 , 反应的化学方程式是。(2)、实验室用稀盐酸和石灰石制取CO2 , 反应的化学方程式为 , 所用发生装置可选用图示中的(填字母序号)。(3)、为得到CO2的水溶液,CO2应从装置C的(填“m”或“n”)端通入。(4)、将CO2的水溶液转移至烧杯,并组装装置如图D所示,置于阳光下一段时间,观察到有气泡产生,检验该气体的方法是。23. 实验课上,老师向滴有无色酚酞试液的NaOH红色溶液中滴加稀HCl,同学们观察到溶液颜色由红色变为无色,说明酸碱发生了中和反应。【提出问题】HCl和NaOH是否恰好完全反应了?
【查阅资料】I.常温下,酚酞在pH≤8.2的溶液中呈无色,在pH>8.2的溶液中呈红色。
Ⅱ.相同温度下,NaOH稀溶液中溶质的质量分数越大,溶液pH越大。
(1)、【猜想假设】① , 溶液pH>7;②恰好完全反应,溶液pH=7;
③HCl过量,溶液pH<7。
(2)、【理论论证】分别取少量反应后的无色溶液于3支试管中,按下列方案实验:实验操作
实验现象
实验结论
方案1
滴加几滴碳酸氢钠溶液
无气泡产生
假设不正确(填序号)
方案2
加热蒸发
蒸发过程中,发现溶液由无色变为红色
假设①正确方案3的化学反应方程式
方案3
滴加几滴硫酸铜溶液
有蓝色沉淀生成
(3)、【结论分析】反应后的无色溶液中还有少量NaOH,此时pH的范围;加热蒸发一段时间后,恢复至常温,当溶液的pH>8.2时,变为红色。(4)、【反思总结】向某碱性溶液中滴加2~3滴无色酚酞试液,振荡后,溶液的颜色变为红色。(填“一定”或“不一定”)(5)、【拓展应用】在探究酸碱性质的实验中,可借助pH传感器监测溶液pH的变化情况。常温下,向盐酸中加水稀释,溶液pH变化与下图吻合的是。(填序号)
五、计算题
-