陕西省咸阳市泾阳县2021-2022学年高一下学期期中质量检测化学试题
试卷更新日期:2022-05-31 类型:期中考试
一、单选题
-
1. 2022年北京冬奥会火炬以氢气为燃料,主火炬首次采用“微火”方式。下列说法错误的是( )A、氢气在空气中燃烧火焰呈淡蓝色 B、利用太阳能分解水制备氢气是放热反应 C、主火炬采用“微火”方式体现了低碳理念 D、氢气是清洁能源,燃烧产物对环境友好2. 下列各图为元素周期表的一部分,表中数字为原子序数,其中X为17的是( )A、
 B、
B、 C、
C、 D、
D、 3. 下列化合物中,既含有离子键又含有共价键的是( )A、CO2 B、KCl C、NH4Cl D、CaCl24. 日本福岛核废水排海引起舆论风波,核废水中不只含有放射性氚,真正具有伤害性的是里面含有的放射性元素,分别是碘-131、铯-134和铯-137、碳-14、钴-60和锶-90。下列叙述正确的是( )A、I原子所含中子数与质子数之差为25 B、铯-134和铯-137是两种不同的元素 C、I的核外电子数为131 D、I和I的核外电子数之差为45. 下列化学用语表述正确的是( )A、溴原子的结构示意图:
3. 下列化合物中,既含有离子键又含有共价键的是( )A、CO2 B、KCl C、NH4Cl D、CaCl24. 日本福岛核废水排海引起舆论风波,核废水中不只含有放射性氚,真正具有伤害性的是里面含有的放射性元素,分别是碘-131、铯-134和铯-137、碳-14、钴-60和锶-90。下列叙述正确的是( )A、I原子所含中子数与质子数之差为25 B、铯-134和铯-137是两种不同的元素 C、I的核外电子数为131 D、I和I的核外电子数之差为45. 下列化学用语表述正确的是( )A、溴原子的结构示意图: B、HF的电子式:
B、HF的电子式: C、Na原子的结构示意图:
C、Na原子的结构示意图: D、H、D、T互为同位素
6. 在一固定体积的密闭容器内发生反应:2A(g)+3B(g)=C(g)+D(g),测得在0~5min内,A由15mol减少至5mol,以A的浓度变化表示的平均反应速率为1mol/(L·min),则此密闭容器的体积为( )A、1L B、2L C、3L D、4L7. 如图所示是两种常见的化学电源示意图,下列说法错误的是( )
D、H、D、T互为同位素
6. 在一固定体积的密闭容器内发生反应:2A(g)+3B(g)=C(g)+D(g),测得在0~5min内,A由15mol减少至5mol,以A的浓度变化表示的平均反应速率为1mol/(L·min),则此密闭容器的体积为( )A、1L B、2L C、3L D、4L7. 如图所示是两种常见的化学电源示意图,下列说法错误的是( ) A、化学电源是将化学能转化为电能的实用装置 B、甲、乙分别属于一次电池和二次电池 C、铅蓄电池可以无限制地反复放电、充电 D、甲电池的负极反应式为Zn-2e-=Zn2+8. 下列实验现象能充分说明对应的化学反应是放热反应的是( )
A、化学电源是将化学能转化为电能的实用装置 B、甲、乙分别属于一次电池和二次电池 C、铅蓄电池可以无限制地反复放电、充电 D、甲电池的负极反应式为Zn-2e-=Zn2+8. 下列实验现象能充分说明对应的化学反应是放热反应的是( )选项
A
B
C
D
反应装置

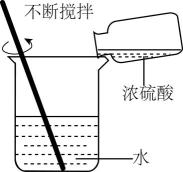

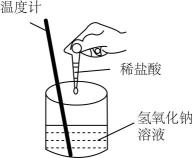
实验现象
反应开始后,针筒活塞向右移动
稀释时烧杯壁温度明显升高
U形管的液面左高右低
温度计的水银柱不断上升
A、A B、B C、C D、D9. 某温度下的恒容密闭容器中,发生可逆反应:A(g)+2B(g)C(g)+D(g)。下列能说明该反应一定达到化学平衡状态的是( )A、混合气体的质量不再变化 B、单位时间内,消耗1 mol A的同时消耗2 mol B C、A的百分含量保持不变 D、混合气体的密度不再变化10. 下列反应不属于可逆反应的是( )A、SO2+H2O=H2SO3与H2SO3=SO2+H2O B、2H2O2H2↑+O2↑与2H2+O22H2O C、2SO2+O22SO3与2SO32SO2+O2 D、H2+I22HI与2HIH2↑+I2↑11. 水煤气变换反应的过程示意图如图:
下列说法错误的是( )
A、上述过程中,H2O均参与了反应过程 B、过程Ⅰ吸收能量 C、过程Ⅰ、Ⅱ中均断裂了氧氢键 D、过程Ⅲ只生成了H2O、O212. 图1是铜锌原电池示意图。图2中x轴表示实验时流入正极的电子的物质的量,则y轴表示( ) A、溶液的质量 B、c(Zn2+) C、c(Cu2+) D、锌棒的质量13. 元素周期表和元素周期律可以指导人们进行规律性的推测和判断。下列说法不合理的是( )A、原子最外层电子数为2的元素一定位于元素周期表的第IIA族 B、若X+和Y2-的核外电子层结构相同,则原子序数:X>Y C、硅、锗都位于金属与非金属的分界处,都可作半导体材料 D、第三周期主族元素的最高正化合价等于其所在主族序数14. 如图是兴趣小组同学设计的电池装置,下列叙述错误的是( )
A、溶液的质量 B、c(Zn2+) C、c(Cu2+) D、锌棒的质量13. 元素周期表和元素周期律可以指导人们进行规律性的推测和判断。下列说法不合理的是( )A、原子最外层电子数为2的元素一定位于元素周期表的第IIA族 B、若X+和Y2-的核外电子层结构相同,则原子序数:X>Y C、硅、锗都位于金属与非金属的分界处,都可作半导体材料 D、第三周期主族元素的最高正化合价等于其所在主族序数14. 如图是兴趣小组同学设计的电池装置,下列叙述错误的是( ) A、铁片是该电池的负极 B、电子的流动方向是:铁片→电子导体(金属导线)→石墨棒 C、离子导体中的Fe3+向铁电极方向移动 D、该电池的总反应是:2Fe3++Fe=3Fe2+15. 几种短周期元素的原子半径及主要化合价见表:
A、铁片是该电池的负极 B、电子的流动方向是:铁片→电子导体(金属导线)→石墨棒 C、离子导体中的Fe3+向铁电极方向移动 D、该电池的总反应是:2Fe3++Fe=3Fe2+15. 几种短周期元素的原子半径及主要化合价见表:元素符号
X
Y
Z
R
T
原子半径(nm)
0.160
0.089
0.102
0.143
0.074
主要化合价
+2
+2
-2,+4,+6
+3
-2
根据表中信息,判断以下说法正确的是( )
A、简单离子氧化性:X2+>R3+ B、离子半径:T2->X2+ C、元素最高价氧化物的水化物的碱性:Y>R>X D、单质与氢气化合由易到难:Z>T16. 下列实验方案能达到相应实验目的的是( )选项
实验目的
实验方案
A
探究化学反应的限度
取5mL0.1mol/LKI溶液,滴加0.1mol/LFeCl3溶液5~6滴,充分反应,可根据溶液中既含I2又含I-的实验事实判断该反应是可逆反应
B
探究FeCl3对H2O2分解速率的影响
相同条件下,向一支试管中加入2mL5%的H2O2和1mLH2O,向另一支试管中加入2mL5%的H2O2和1mLFeCl3溶液,观察并比较实验现象
C
比较碳酸和硅酸的酸性强弱
在CaCO3中加浓盐酸,并将反应后所得气体直接通入Na2SiO3溶液中,溶液变浑浊
D
探究浓度对化学反应速率的影响
常温下,向相同的铁片中分别加入足量的浓、稀硝酸
A、A B、B C、C D、D二、填空题
-
17. 现有下列物质:①Cl2;②Na2O2;③NaOH;④CH4;⑤CO2;⑥O2;⑦NaCl。(1)、属于离子化合物的有(填序号,下同);属于共价化合物的有。(2)、②的电子式为。(3)、用电子式表示⑦的形成过程:。(4)、4 g CH4(g)在氧气中燃烧生成CO2(g)和H2O(l),放出222.5 kJ热量,则1 mol CH4(g)完全燃烧生成CO2(g)和H2O(l)放出的热量为kJ。18. 原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。(1)、如图装置中属于原电池的是(填序号)。
 (2)、依据氧化还原反应Fe+2Ag+=Fe2++2Ag设计的原电池如图1所示。
(2)、依据氧化还原反应Fe+2Ag+=Fe2++2Ag设计的原电池如图1所示。
①电极X的材料是。
②X电极的电极反应式为;Ag电极上发生的是(填“氧化”或“还原”)反应。
③当有2.8 g铁溶解时,Ag电极增重g。
(3)、以甲烷为燃料的新型电池得到广泛的研究,如图2是目前研究较多的一类燃料电池的工作原理示意图。
①A极为电池极(填“正”或“负”)。
②B极的电极反应式为;若消耗标准状况下的CH411.2 L,则电路中转移mol电子。
三、综合题
-
19. 工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)CH3OH(g)。图1表示反应进行过程中能量的变化;图2表示一定温度下,在体积为2 L的密闭容器中加入4molH2(g)和一定量的CO(g)后,CO(g)和CH3OH(g)的浓度随时间的变化情况。
 (1)、由图1可知,该反应是(填“吸热”或“放热”)反应。(2)、当反应生成1 mol CH3OH(g)时,能量变化值是kJ。若要加快反应速率,可采取的措施有(写一条)。(3)、根据图2判断,下列说法错误的是____(填字母)。A、反应进行到3 min时达到化学平衡状态 B、若反应生成液态甲醇,能量变化值会更大 C、平衡时氢气的浓度为1 mol/L(4)、推测反应CH3OH(g)CO(g)+2H2(g)是(填“吸热”或“放热”)反应。(5)、若断开1 mol H-H键、1 mol N-H键、1 mol N≡N键分别需要吸收能量为436 kJ、391 kJ、946 kJ,则3 mol H2(g)与足量N2(g)反应生成NH3(g)需放出能量kJ。事实上,反应的热量总小于理论值,理由是。20. 现有A、B、M、D、F、E六种短周期元素,原子序数依次增大。它们的性质或原子结构如表所示:
(1)、由图1可知,该反应是(填“吸热”或“放热”)反应。(2)、当反应生成1 mol CH3OH(g)时,能量变化值是kJ。若要加快反应速率,可采取的措施有(写一条)。(3)、根据图2判断,下列说法错误的是____(填字母)。A、反应进行到3 min时达到化学平衡状态 B、若反应生成液态甲醇,能量变化值会更大 C、平衡时氢气的浓度为1 mol/L(4)、推测反应CH3OH(g)CO(g)+2H2(g)是(填“吸热”或“放热”)反应。(5)、若断开1 mol H-H键、1 mol N-H键、1 mol N≡N键分别需要吸收能量为436 kJ、391 kJ、946 kJ,则3 mol H2(g)与足量N2(g)反应生成NH3(g)需放出能量kJ。事实上,反应的热量总小于理论值,理由是。20. 现有A、B、M、D、F、E六种短周期元素,原子序数依次增大。它们的性质或原子结构如表所示:元素
性质或原子结构
A
原子核内只有一个质子
B
形成的单质是空气中含量最多的气体
M
原子的最外层电子数是次外层电子数的3倍
D
M层比K层少一个电子
E
最高正化合价与最低负化合价的代数和为6
F
比D原子序数大1
请回答:
(1)、M在元素周期表中的位置为。(2)、A、M形成的常见液态化合物中,能杀菌消毒的是(填化学式,下同)。(3)、B的最高价氧化物对应的水化物为。(4)、F与D相比,金属性较强的是(填元素符号),请从原子结构的角度解释原因:。(5)、E的单质通入D的最高价氧化物对应水化物的溶液中,可以制取漂白液,发生反应的离子方程式为。(6)、硒元素对人体有一定的保健作用。已知硒元素与M同主族,与钙同周期。下列关于硒的说法错误的是____(填字母)。A、原子序数为26 B、常温下为固体,最高价氧化物是SeO3 C、原子半径比钙小 D、气态氢化物的化学式是H2Se,稳定性比HBr弱21. 某同学为探究元素周期表中元素性质的递变规律,进行了如下系列实验。回答问题:探究1:验证氯元素的非金属性比硫元素的非金属性强。设计实验如图:
 (1)、装置A中盛放的试剂是(填字母),A中发生反应的化学方程式为。
(1)、装置A中盛放的试剂是(填字母),A中发生反应的化学方程式为。A.Na2SO3溶液 B.Na2S溶液 C.Na2SO4溶液
(2)、下列不能用于验证氯元素比硫元素非金属性强的依据是(填字母)。A.HCl比H2S稳定 B.铁与Cl2反应生成FeCl3 , 而铁与硫反应生成FeS
C.HClO4的酸性比H2SO4的强 D.HClO的氧化性比H2SO3的强
(3)、实验I中的现象是。(4)、根据I、II、III的实验现象可得Cl、Br、I的得电子能力强弱顺序为。(5)、实验I、II得到的CCl4层中含有卤素单质,可用NaOH浓溶液反萃取分离回收。以下是反萃取回收I2的操作过程:①向装有I2的CCl4溶液的分液漏斗中加入少量浓NaOH溶液;
②振荡至溶液的紫红色消失,静置、分层;
③先将CCl4层从仪器的下口放出,再将含I-、IO的碱溶液从仪器的(填“上”或“下”)口倒入烧杯中;
④边搅拌边加入几滴45%的H2SO4溶液,溶液立即转为棕黄色,并析出碘晶体,写出该反应的离子方程式。