陕西省宝鸡市金台区2021-2022学年高一下学期期中考试化学试题
试卷更新日期:2022-05-31 类型:期中考试
一、单选题
-
1. 根据周期表,判断下列元素中不属于主族元素的是( )A、硼 B、溴 C、铜 D、铯2. 有关元素周期表,下列说法中正确的是( )A、通常元素周期表左下方区域的是非金属元素 B、金属元素和非金属元素分界线附近的元素可以合成农药 C、人们在过渡元素中可以寻找催化剂、耐高温、耐腐蚀材料 D、元素周期表有七个横行,16个纵行,已有元素约一百多种3. 元素的性质随着原子序数的递增呈现周期性的变化的根本原因是( )A、元素相对原子质量的递增,量变引起质变 B、元素的金属性和非金属性呈周期性变化 C、元素原子核外电子排布呈周期性变化 D、元素化合价呈周期性变化4. 下列说法错误的是( )A、红磷和白磷互为同素异形体 B、中质子数和中子数相差 C、和互为同位素 D、、、H+和H2是氢元素的四种不同粒子5. 下列说法中正确的是( )A、CH4和BCl3分子中所有原子的最外层都达到了8电子稳定结构 B、H2O2、NaClO中所含化学键类型不完全相同 C、Si与C同属第IVA族,因此SiO2和CO2两种物质结构相同 D、原子的相对原子质量就是该原子的质量数6. 下列关于碱金属元素和卤族元素错误的是( )A、卤族元素从上到下,非金属增强,其对应的单质氧化性逐渐增强。 B、碱金属元素从上到下,金属性增强,其对应的单质还原性逐渐增强。 C、卤族元素从上到下,其对应的氢化物稳定性减弱。 D、碱金属元素和卤族元素分别位于周期表第1和第17纵行7. 下列关于铯(Cs)的叙述正确的是( )A、Cs 是一种活泼的金属,在自然界中有少量游离态的铯存在 B、铯位于第五周期第IA族,原子序数55 C、氢氧化铯是一种强碱,碱性小于氢氧化钾 D、硫酸铯是一种离子化合物8. 下列微粒的结构示意图中,正确的是( )A、Mg2+
 B、Cl
B、Cl  C、Ar
C、Ar  D、K
D、K  9. 下列关于物质性质的比较,错误的是( )A、酸性强弱: B、原子半径大小: C、碱性强弱: D、金属性强弱:10. 已知反应A+B=C+D的能量变化如图所示,下列说法正确的是( )
9. 下列关于物质性质的比较,错误的是( )A、酸性强弱: B、原子半径大小: C、碱性强弱: D、金属性强弱:10. 已知反应A+B=C+D的能量变化如图所示,下列说法正确的是( )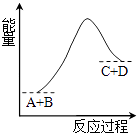 A、该反应为放热反应 B、该反应为吸热反应 C、反应物的总能量高于生成物的总能量 D、该反应只有在加热条件下才能进行11. 已知断开1 mol H-H吸收的能量为436 kJ,形成1 mol H—N放出的能量为391 kJ,根据化学方程式N2+3H22NH3 , 反应完1 mol N2放出的能量为92.4 kJ,则断开1 mol N≡N需吸收的能量是( )A、431 kJ B、945.6 kJ C、649 kJ D、869 kJ12. 下列反应中,既属于氧化还原反应同时又是吸热反应的是( )A、Ba(OH)2·8H2O与NH4Cl反应 B、铝与稀盐酸 C、灼热的炭与CO2反应 D、甲烷与O2的燃烧反应13. 下列化学电池不易造成环境污染的是( )A、氢氧燃料电池 B、锌锰电池 C、镍镉电池 D、铅蓄电池14. 人造地球卫星上使用的一种高能电池(银锌蓄电池),其电池的电极反应式为:Zn+2OH--2e- =ZnO+H2O,Ag2O+H2O+2e- =2Ag+2OH-。据此判断氧化银是( )A、正极,被还原 B、负极,被氧化 C、正极,被氧化 D、负极,被还原15. 如图是氢氧燃料电池构造示意图。下列关于该电池的说法错误的是( )
A、该反应为放热反应 B、该反应为吸热反应 C、反应物的总能量高于生成物的总能量 D、该反应只有在加热条件下才能进行11. 已知断开1 mol H-H吸收的能量为436 kJ,形成1 mol H—N放出的能量为391 kJ,根据化学方程式N2+3H22NH3 , 反应完1 mol N2放出的能量为92.4 kJ,则断开1 mol N≡N需吸收的能量是( )A、431 kJ B、945.6 kJ C、649 kJ D、869 kJ12. 下列反应中,既属于氧化还原反应同时又是吸热反应的是( )A、Ba(OH)2·8H2O与NH4Cl反应 B、铝与稀盐酸 C、灼热的炭与CO2反应 D、甲烷与O2的燃烧反应13. 下列化学电池不易造成环境污染的是( )A、氢氧燃料电池 B、锌锰电池 C、镍镉电池 D、铅蓄电池14. 人造地球卫星上使用的一种高能电池(银锌蓄电池),其电池的电极反应式为:Zn+2OH--2e- =ZnO+H2O,Ag2O+H2O+2e- =2Ag+2OH-。据此判断氧化银是( )A、正极,被还原 B、负极,被氧化 C、正极,被氧化 D、负极,被还原15. 如图是氢氧燃料电池构造示意图。下列关于该电池的说法错误的是( ) A、a极是负极 B、正极的电极反应式是 C、电子由a通过灯泡流向b D、氢氧燃料电池是环保电池16. 下列说法正确的是( )A、离子键就是阴、阳离子间的静电引力 B、所有金属元素与所有非金属元素之间都能形成离子键 C、HCl在水中能电离出H+和Cl- , 所以HCl由H+和Cl-构成 D、某化合物熔融态能导电,则该化合物中一定含有离子键17. 下列物质中,既含有离子键又含有共价键的是( )A、H2SO4 B、NaCl C、MgCl2 D、NaOH18. 下列关于化学反应的说法,错误的是( )A、化学反应速率是衡量化学反应进行快慢程度的物理量 B、化学反应速率的大小主要取决于反应物本身的性质 C、化学反应速率也可用单位时间内生成某物质的质量的多少来表示 D、对一个可逆反应,它达到平衡状态时化学反应速率为零19. 在四个不同的容器中,在不同的条件下进行合成氨反应,根据下列在相同时间内测得的结果判断,生成氨的反应速率最快的是( )A、v(NH3)=0.3 mol·L-1·min-1 B、v(N2)=0.01 mol·L-1·s-1 C、v(N2)=0.2 mol·L-1·min-1 D、v(H2)=0.3 mol·L-1·min-120. 某反应进行过程中,各物质物质的量的变化情况如图所示。下列说法正确的是( )
A、a极是负极 B、正极的电极反应式是 C、电子由a通过灯泡流向b D、氢氧燃料电池是环保电池16. 下列说法正确的是( )A、离子键就是阴、阳离子间的静电引力 B、所有金属元素与所有非金属元素之间都能形成离子键 C、HCl在水中能电离出H+和Cl- , 所以HCl由H+和Cl-构成 D、某化合物熔融态能导电,则该化合物中一定含有离子键17. 下列物质中,既含有离子键又含有共价键的是( )A、H2SO4 B、NaCl C、MgCl2 D、NaOH18. 下列关于化学反应的说法,错误的是( )A、化学反应速率是衡量化学反应进行快慢程度的物理量 B、化学反应速率的大小主要取决于反应物本身的性质 C、化学反应速率也可用单位时间内生成某物质的质量的多少来表示 D、对一个可逆反应,它达到平衡状态时化学反应速率为零19. 在四个不同的容器中,在不同的条件下进行合成氨反应,根据下列在相同时间内测得的结果判断,生成氨的反应速率最快的是( )A、v(NH3)=0.3 mol·L-1·min-1 B、v(N2)=0.01 mol·L-1·s-1 C、v(N2)=0.2 mol·L-1·min-1 D、v(H2)=0.3 mol·L-1·min-120. 某反应进行过程中,各物质物质的量的变化情况如图所示。下列说法正确的是( ) A、C,D是生成物 B、反应的方程式为2A + B
A、C,D是生成物 B、反应的方程式为2A + B 2C
C、2 min后各物质的量不再变化
D、该反应不是可逆反应
2C
C、2 min后各物质的量不再变化
D、该反应不是可逆反应
二、填空题
-
21. 按要求填空(1)、写出下列物质的电子式:
①KCl ②MgCl2 ③Cl2
④N2 ⑤H2O ⑥CH4
(2)、写出下列反应的化学方程式。①锂在空气中燃烧:;
②钾与水反应:;
③溴与碘化钾反应:;
④氯化亚铁与氯气反应: ;
22. 工业制硫酸中一步重要的反应是在400~500℃下的催化氧化: 2SO2+O22SO3(g),这是一个正反应放热的可逆反应。回答下列问题:(1)、如果反应在密闭容器中进行,下列有关说法错误的是____A、使用适当催化剂可以加快反应速率,提高SO3产量 B、适当提高O2浓度可以提高SO2转化率 C、采用400~500℃是因为此温度下该反应速率最快 D、采用合适条件就可以使该反应完全进行,不浪费原料(2)、若在t ℃时,将2 mol SO2和1 mol O2通入体积为2 L的恒温恒容密闭容器中,发生上述反应,2 min时反应达到平衡,此时测得反应物O2还剩余0.8 mol。则2min内,生成SO3的平均反应速率为;此时SO2的转化率为。(3)、下列叙述能说明该反应已达到化学平衡状态的是____(填序号)。A、容器内气体质量不再发生变化 B、SO2的体积分数不再发生变化 C、容器内气体原子总数不再发生变化 D、相同时间内消耗2n mol SO2的同时消耗n mol O2 E、相同时间内消耗2n mol SO2的同时生成n mol O2三、综合题
-
23. 下表列出了A-R 9种元素在周期表中的位置:
IA
IIA
IIIA
IVA
VA
VIA
VIIA
0
2
E
F
3
A
C
D
G
R
4
B
H
(1)、这9种元素中化学性质最不活泼的是(填元素符号)。(2)、A元素可在F中燃烧形成一种淡黄色物质,此物质的化学式为。(3)、B、C、G三种元素的离子的离子半径由大到小的顺序排列为(按照顺序写出离子符号即可)。(4)、G元素和H元素两者核电荷数之差是。(5)、D元素最高价氧化物对应的水化物与氢氧化钠反应的离子方程式是。(6)、用电子式表示H和B形成化合物的过程 , 高温灼烧该化合物时,火焰呈现色。24. 某班同学想要设计实验验证元素性质变化规律,(1)、I.第一组同学拟利用原电池反应检测金属的活动性顺序,设计如图甲所示原电池装置,用铝片和铜片作电极,电解质为H2SO4溶液,
写出甲中负极的电极反应式:。此电池工作时导线中电流方向为:(选填“铜→铝”或“铝→铜”)。
(2)、乙同学将铜电极换成镁电极,如图乙所示,实验发现也可组成原电池,此时铝片上有气体产生,则此原电池中负极是。(填“镁片”或“铝片”)。(3)、由以上实验推断,当把A、B两种金属用导线连接后同时浸入稀硫酸溶液中,若B上发生还原反应,则A、B金属的活泼性可能是(填“A>B”或“A<B”)。(4)、II.为了验证元素周期律相关的结论,另一组同学也设计了一套实验方案,并记录了有关实验现象。实验方案
实验现象
①将新制氯水滴入NaBr溶液中,振荡后加入适量CCl4溶液,振荡,静置
分层,上层无色,下层橙红色
②将溴水滴入NaI溶液中,振荡后加入适量CCl4溶液,振荡,静置
分层,上层无色,下层紫红色
③将少量I2固体加入NaCl溶液中,振荡后加入适量淀粉溶液,振荡,静置
溶液变蓝色
④将少量I2固体加入Na2S溶液,振荡后静置
溶液变浑浊,出现淡黄色沉淀
方案①相关反应的离子方程式为。
(5)、方案④相关反应的化学方程式为 , 由以上方案可知S、Cl、Br、I的非金属性由强到弱的顺序为(用化学符号表示)。(6)、实验结论:周期表中元素的非金属性变化规律为。