辽宁省沈阳市五校协作体2021-2022学年高一下学期期中联考化学试题
试卷更新日期:2022-05-31 类型:期中考试
一、单选题
-
1. 《天工开物》被外国学者称它为“中国17世纪的工艺百科全书”,其中有许多关于化学的记载。下列说法不合理的是( )A、“凡弓弦取食柘叶蚕茧,其丝更坚韧”中的“丝”为蛋白质 B、“凡埏泥造瓦,掘地二尺余,择取无沙粘土而为之”中“瓦”的主要成分为二氧化硅 C、“稻以糠为甲,麦以麸为衣”中“糠”的主要成分为纤维素 D、“凡火药,硫为纯阳,硝为纯阴”,“硝”指硝酸钾,在反应中表现氧化性2. 化学与生产、生活密切相关,下列有关说法错误的是( )A、煤油可由石油分馏获得,可用作燃料和保存少量金属钠 B、制作老式油条的口诀是“一碱、二矾、三钱盐”,其中的“矾”是蓝矾 C、用臭氧代替农药在粮食仓储中杀菌防霉,是因为臭氧使细菌的蛋白质变性 D、用灼烧的方法可以区别衣服的成分是羊毛还是涤纶3. 材料是人类文明的重要组成部分,下列有关材料的说法错误的是( )A、SiC陶瓷、光导纤维和碳纳米管都是新型无机非金属材料 B、在水泥砂浆中添加适量的水玻璃可以提高水泥砂浆的黏结性和胶凝性 C、塑料、天然橡胶、麻、蚕丝等都是天然高分子材料 D、通过淀粉发酵方法获得味精4. 下列化学用语书写正确的是( )A、CH3CHO的球棍模型:
 B、
B、 按照系统命名法的名称:2-乙基丙烷
C、过氧化氢的空间填充模型:
按照系统命名法的名称:2-乙基丙烷
C、过氧化氢的空间填充模型: D、-NH2的电子式:
D、-NH2的电子式: 5. 下列叙述中,正确的有几个( )
5. 下列叙述中,正确的有几个( )①石灰石可以用于玻璃、炼铁、水泥、漂白粉工业
②利用乙酸乙酯的皂化反应,工业制肥皂
③煤的液化、石油的分馏、蛋白质的显色反应及催化裂化都属于化学变化
④乙烷在光照条件下与氯气发生取代反应可能生成的10种有机物
⑤液氨可作制冷剂,是因为氨气易液化,气化时吸热
⑥二氧化硫可用于葡萄酒保质,因为二氧化硫具有抗氧化性
⑦氯仿没有同分异构体可证明甲烷是正四面体结构
A、2个 B、3个 C、4个 D、5个6. 海洋的化学资源有十分大的开发潜力。利用海水资源(主要含、 , 少量的、、、、)制备碳酸锂的一种工艺如图所示:
资料:微溶于水,在冷水中溶解度较热水中大,不溶于乙醇。
下列说法正确的是( )
A、工序③和工序④顺序可互换 B、工序⑤选择常温下进行,可降低碳酸锂在水中的溶解度,提高产率 C、用乙醇洗涤粗产品可起到提高产率和快速干燥的效果 D、滤渣1和滤渣2的主要成分分别是和7. 同温同压下,将两个干燥圆底烧瓶中分别充满相应的气体后进行喷泉实验(如图所示),下列说法错误的是( ) A、打开止水夹、挤出胶头滴管中的水后,都可产生红色喷泉 B、实验后烧瓶中溶质的物质的量浓度均为 C、实验后烧瓶中均未充满溶液 D、若去掉装置中的胶头滴管,采用热敷烧瓶的方法也可引发喷泉8. 用下列实验装置不能达到相关实验目的的是( )
A、打开止水夹、挤出胶头滴管中的水后,都可产生红色喷泉 B、实验后烧瓶中溶质的物质的量浓度均为 C、实验后烧瓶中均未充满溶液 D、若去掉装置中的胶头滴管,采用热敷烧瓶的方法也可引发喷泉8. 用下列实验装置不能达到相关实验目的的是( )A
B
C
D
实验装置




实验目的
探究与的反应
除去甲烷中的乙烯
收集气体
将乙醇氧化为乙醛
A、A B、B C、C D、D9. 浓硫酸与木炭在加热条件下可发生化学反应,为检验反应的产物,某同学设计了如下图所示的实验。
在不影响实验检验结果的情况下,理论上以下试剂中可以用来代替装置B中的品红溶液的是( )
①溶液 ②溶液 ③饱和溶液 ④饱和碳酸钠溶液 ⑤溴水 ⑥澄清石灰水
A、④⑤ B、②③ C、①⑥ D、②⑤10. 氧化剂溶液的浓度会影响其氧化性的强弱。镁与不同浓度的硝酸溶液反应可得到、、、、等还原产物(每种情况只考虑生成一种还原产物),下列说法错误的是( )A、24g镁与足量某浓度的硝酸溶液充分反应生成时消耗2.25mol B、消耗等量的镁生成的还原产物物质的量最多的是 C、生成氢气时所用硝酸浓度应小于生成其它产物时所用硝酸浓度 D、生成等物质的量的NO和消耗镁的物质的量之比为3∶811. 人类利用人工合成信息素诱捕害虫、测报虫情等。一种集结信息素的分子结构简式如图所示,关于该有机物的说法错误的是( ) A、该有机物分子含有三种官能团 B、该有机物能发生加成和氧化反应 C、该有机物水解产物之一能氧化成醛 D、该有机物具有一定的挥发性12. 合成氨的生产在国民生活中占有重要地位。在能源和环境问题日益严重的今天,合成氨工业的改革至关重要。一种新型合成氨的过程如下。下列说法正确的是( )
A、该有机物分子含有三种官能团 B、该有机物能发生加成和氧化反应 C、该有机物水解产物之一能氧化成醛 D、该有机物具有一定的挥发性12. 合成氨的生产在国民生活中占有重要地位。在能源和环境问题日益严重的今天,合成氨工业的改革至关重要。一种新型合成氨的过程如下。下列说法正确的是( ) A、“转氨”过程属于氮的固定 B、合成过程中有两个反应为非氧化还原反应 C、若用代替进行转化,从体系中分离出更容易 D、该合成氨过程中,参加反应的与的物质的量之比为2∶313. 乙烯是一种重要的化工原料,下图展示了其部分应用。下列说法错误的是( )
A、“转氨”过程属于氮的固定 B、合成过程中有两个反应为非氧化还原反应 C、若用代替进行转化,从体系中分离出更容易 D、该合成氨过程中,参加反应的与的物质的量之比为2∶313. 乙烯是一种重要的化工原料,下图展示了其部分应用。下列说法错误的是( )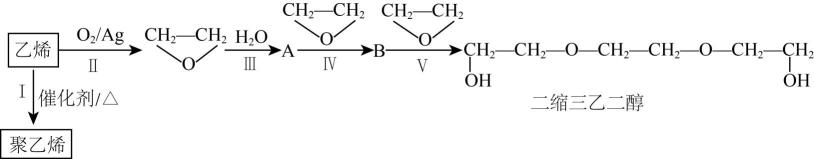 A、Ⅰ~Ⅴ反应的原子利用率均为100%,符合绿色化学理念 B、Ⅲ、Ⅳ、Ⅴ的反应类型均为加成反应 C、聚乙烯和二缩三乙二醇均能使酸性高锰酸钾溶液褪色 D、环氧乙烷的同分异构体可能发生银镜反应14. 某有机高聚物的结构片段如图所示。下列说法正确的是( )
A、Ⅰ~Ⅴ反应的原子利用率均为100%,符合绿色化学理念 B、Ⅲ、Ⅳ、Ⅴ的反应类型均为加成反应 C、聚乙烯和二缩三乙二醇均能使酸性高锰酸钾溶液褪色 D、环氧乙烷的同分异构体可能发生银镜反应14. 某有机高聚物的结构片段如图所示。下列说法正确的是( ) A、该有机高聚物的实验式为 B、该有机高聚物中含有极性键、非极性键和氢键三种化学键 C、因分子中含有酰胺基,所以该有机聚合物属于多肽 D、该有机高聚物由两种单体加聚而成15. 某化学兴趣小组利用如图装置进行下列操作:在一支50mL的注射器里充入20mLNO,然后吸入5mL水,用乳胶管和弹簧夹封住管口,振荡注射器;打开弹簧夹,快速吸入15mL空气[假设只有两种气体,且]后夹上弹簧夹,振荡注射器。下列说法错误的是( )
A、该有机高聚物的实验式为 B、该有机高聚物中含有极性键、非极性键和氢键三种化学键 C、因分子中含有酰胺基,所以该有机聚合物属于多肽 D、该有机高聚物由两种单体加聚而成15. 某化学兴趣小组利用如图装置进行下列操作:在一支50mL的注射器里充入20mLNO,然后吸入5mL水,用乳胶管和弹簧夹封住管口,振荡注射器;打开弹簧夹,快速吸入15mL空气[假设只有两种气体,且]后夹上弹簧夹,振荡注射器。下列说法错误的是( ) A、整个实验过程可以看到无色气体变为红棕色后又消失的现象 B、实验结束后,注射器活塞停留在28mL刻度附近 C、最终,注射器中气体为:NO约16mL、约12mL D、所得溶液的物质的量浓度约为0.036mol/L(气体体积均为标准状况数据;溶液体积仍为5mL)
A、整个实验过程可以看到无色气体变为红棕色后又消失的现象 B、实验结束后,注射器活塞停留在28mL刻度附近 C、最终,注射器中气体为:NO约16mL、约12mL D、所得溶液的物质的量浓度约为0.036mol/L(气体体积均为标准状况数据;溶液体积仍为5mL)二、填空题
-
16. 海水是巨大的资源宝库,海水淡化及其综合利用具有重要意义。请回答下列问题:(1)、历史最久,技术和工艺也比较成熟,但成本较高的海水淡化方法是。(2)、步骤1中,粗盐中含有、、等杂质离子,精制时常用的试剂有:①稀盐酸;②氯化钡溶液;③氢氧化钠溶液;④碳酸钠溶液。下列加入试剂的顺序正确的是____(填字母)A、①②③④ B、②③④① C、④③②① D、③②④①(3)、海水提溴工艺中热空气吹出 , 利用了溴的性质;吹出的溴蒸气在吸收塔中被和水吸收,写出离子方程式。(4)、为了把海水中转化为 , 从原料来源及经济效益角度考虑,最好选用。
a.氨水 b.氢氧化钙 c.氢氧化钠
(5)、写出无水氯化镁制备Mg的化学方程式:。(6)、在实验室模拟海带提碘的实验过程。灼烧海带时,会用到的主要仪器有酒精灯、三脚架、玻璃棒、。三、综合题
-
17. 乙酸乙酯是一种重要的有机化工原料和工业溶剂。完成下列问题。(1)、用乙醇和和乙酸制备乙酸乙酯的反应机理如图所示:

上述反应中互为同分异构体的是(填“甲、乙、丙、丁”);上述过程中属于加成反应的有(填“①②③④⑤”)
(2)、以正丁烷为原料合成乙酸乙酯的合成路线如下: , 写出与反应的化学方程式:。(3)、某课外兴趣小组欲用乙醇和乙酸制备少量乙酸乙酯,把装置Ⅰ改进为装置Ⅱ。
装置Ⅰ中有一处明显的不正确,会造成的后果是。装置Ⅱ与装置Ⅰ相比,突出的优点是。
18. 某实验小组为验证与水反应的产物与课本方程式中的产物是否一致,设计如下装置进行实验(夹持装置已略去,装置气密性已检验)。
实验步骤如下:
步骤Ⅰ:打开K1、K3、K4 , 关闭K2 , 通入一段时间 , 关闭K1;
步骤Ⅱ:打开K2 , 加入足量浓硝酸,同时打开传感器,记录数据。
步骤Ⅲ:铜片完全溶解后,打开K1 , 再通入一段时间。
步骤Ⅳ:测定尾气收集装置中NO的量。
回答下列问题:
(1)、仪器a的名称为。(2)、铜与浓硝酸反应的化学方程式。(3)、“步骤I”中“通入一段时间”的目的是。“步骤Ⅲ”中“通入一段时间”的目的是。(4)、步骤Ⅳ中,利用与NO反应,产生激发态的(用表示),当回到基态时,产生荧光。通过测量荧光强度可获知NO的浓度,二者呈正比。下列说法正确的有____。A、基态与具有的能量不同 B、与NO发生反应: C、NO转化过程没有颜色变化 D、测得荧光强度越大,说明尾气中NO含量越高(5)、课本中与水反应的离子方程式为。通过实验数据同学们发现 , 试猜测可能的原因。19. 丁烷催化裂解生成烷烃和烯烃,可按下列两种方式进行:;。某化学兴趣小组为了测定丁烷裂解气中和的比例关系,设计实验如下图所示:
如图连接好装置后,需进行的操作有:①给D、G装置加热;②检查整套装置的气密性;③用惰性气体排出装置中的空气等……
注:CuO能将烃氧化成和;是烷烃裂解的催化剂;G后面装置已省略。
(1)、这三步操作的先后顺序是(填序号)(2)、装置B的作用是。(3)、装置E中的现象是。(4)、假定丁烷完全裂解,且流经各装置中的气体能完全反应。当装置E和F的总质量比反应前增加了0.7g,G装置中固体质量比反应前减少了1.76g,则在丁烷的裂解产物中和的物质的量之比。20. 已知A是一种密度为(标准状况下)的烷烃,B是一种常见的油脂。 (1)、下列说法正确的是(填编号)
(1)、下列说法正确的是(填编号)①1mol有机物D可以与3molNa反应
②有机物A的分子式为 , 且有两种同分异构体
③有机物B和有机物F互为同系物;D与乙醇互为同系物
④有机物E能去除油污的最主要原因是其水溶液呈碱性
(2)、写出有机物C与D反应生成F的化学方程式。(3)、B与NaOH溶液生成D和E的反应类型是。(4)、关于油脂的下列性质或用途与其含有不饱和碳碳双键有关的是____。A、常见的食用油在空气中久置被氧化,产生“哈喇”味 B、用废油脂制成的生物柴油 C、油脂可以为人体提供能量 D、植物油可用于生产人造奶油
-