黑龙江省西北部八校2021-2022学年高一下学期期中联考化学试题
试卷更新日期:2022-05-31 类型:期中考试
一、单选题
-
1. 2010年诺贝尔物理学奖用于表彰首次剥离出单层石墨的科学家。单层石墨称为石墨烯,这种“只有一层碳原子厚的碳薄片”的石墨烯,被公认为目前世界上已知的最薄、最坚硬、传导电子速度最快的新型材料,应用前景十分广阔!下列关于石墨烯的叙述正确的是( )A、石墨烯是碳单质 B、石墨烯是一种有机物 C、石墨烯中碳原子的化合价为+3 D、石墨烯可导电,说明它是一种金属单质2. 下列关于无机非金属材料的说法错误的是( )A、传统无机非金属材料是指:玻璃、水泥、陶瓷等硅酸盐材料 B、新型无机非金属材料碳化硅具有类似金刚石的结构,硬度很大 C、高温结构材料具有耐高温、抗氧化、耐磨蚀等优良性能 D、新型无机非金属材料光导纤维的成分是二氧化硅分子3. 下列有关浓硫酸、浓盐酸、浓硝酸的认识错误的是( )A、浓硫酸、浓硝酸与金属反应时,分别是S、N得电子 B、蔗糖与浓硫酸混合后,白色蔗糖固体逐渐变成黑色疏松的碳,体现了浓硫酸的脱水性 C、浓盐酸、浓硝酸具有挥发性,而浓硫酸难挥发 D、常温下,浓硫酸或浓HNO3中投入Fe片,均会产生大量的气体4. 不能由两种单质直接化合而成的是( )A、FeCl3 B、NO C、CuS D、SO25. 可逆反应A(g)+3B(g)2C(g)+2D(g)在不同条件下的反应速率如下,其中反应速率最快的是( )A、v(A)=0.25mol·L-1·s-1 B、v(B)=0.6mol·L-1·s-1 C、v(C)=0.3mol·L-1·s-1 D、v(D)=0.4mol·L-1·s-16. 下列叙述错误的是( )A、汽车中小摆件“苹果花”的动力是以Si为原料制作的太阳能电池 B、SiO2是酸性氧化物,所以不与任何酸反应 C、黏土是制作水泥和陶瓷的主要原料 D、NaOH溶液不能盛装在带玻璃塞的磨口试剂瓶中7. 喷泉实验装置如图所示。应用下列各组气体—溶液,能出现喷泉现象的是( )

气体
溶液
A.
Cl2
饱和食盐水
B.
HCl
稀氨水
C.
NO
稀H2SO4
D.
CO2
饱和NaHCO3溶液
A、A B、B C、C D、D8. 下列每组物质中含有的化学键类型相同的是( )A、NaCl、HCl、H2O B、Cl2、Na2S、HCl C、HBr、H2O、CS2 D、Na2O、H2O2、O29. 已知金属单质X、Y、Z、W之间有下列关系:①2X+3Y2+=2X3++3Y;
②Z元素最高价氧化物对应的水化物的碱性比X元素的强;
③由Y、W与稀硫酸组成的原电池,Y为负极。
则X、Y、Z、W的还原性由强到弱的顺序为( )
A、X>Z>Y>W B、Z>W>X>Y C、Z>Y>X>W D、Z>X>Y>W10. 某反应由两步反应A→B→C构成,它的反应能量曲线如图,下列叙述正确的是( ) A、三种化合物中C最稳定 B、两步反应均为吸热反应 C、A与C的能量差为E4-E3 D、A→B的反应条件一定要加热11. 氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可用如图表示,下列关于海洋氮循环的说法中正确的是( )
A、三种化合物中C最稳定 B、两步反应均为吸热反应 C、A与C的能量差为E4-E3 D、A→B的反应条件一定要加热11. 氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可用如图表示,下列关于海洋氮循环的说法中正确的是( ) A、海洋中不存在游离态的氮 B、②中的含氮物质转化属于氮的固定 C、④中的含氮物质转化属于氮的还原 D、向海洋中排放含的废水不会影响的含量12. 下列指定反应的离子方程式书写正确的是( )A、硫化氢气体通入氯化铁溶液:2Fe3++S2-=S↓+2Fe2+ B、向碳酸氢铵溶液中加入足量石灰水:Ca2++HCO+OH-=CaCO3↓+H2O C、向稀硝酸中加入过量铁粉:Fe+NO+4H+=Fe3++NO↑+2H2O D、用氨水吸收少量SO2:2NH3•H2O+SO2=2NH+SO+H2O13. 如图是利用氯化氢和氢气生产高纯硅的工艺流程。容器 中发生的反应为 ,容器 中发生的反应为 ,已知 常温下为液态。
A、海洋中不存在游离态的氮 B、②中的含氮物质转化属于氮的固定 C、④中的含氮物质转化属于氮的还原 D、向海洋中排放含的废水不会影响的含量12. 下列指定反应的离子方程式书写正确的是( )A、硫化氢气体通入氯化铁溶液:2Fe3++S2-=S↓+2Fe2+ B、向碳酸氢铵溶液中加入足量石灰水:Ca2++HCO+OH-=CaCO3↓+H2O C、向稀硝酸中加入过量铁粉:Fe+NO+4H+=Fe3++NO↑+2H2O D、用氨水吸收少量SO2:2NH3•H2O+SO2=2NH+SO+H2O13. 如图是利用氯化氢和氢气生产高纯硅的工艺流程。容器 中发生的反应为 ,容器 中发生的反应为 ,已知 常温下为液态。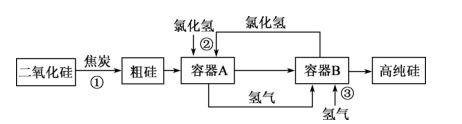
下列说法错误的是( )
A、反应①为 B、从容器B中获得高纯硅的操作为过滤 C、反应②和③中 均作氧化剂 D、该工艺中 和 可循环使用14. 将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器容积不变,固体试样体积忽略不计),在恒定温度下使其分解:NH2COONH4(s)2NH3(g)+CO2(g)。可以判断该分解反应已经达到化学平衡状态的是( )A、2v(NH3)=v(CO2) B、密闭容器中NH3与CO2的物质的量之比不变 C、密闭容器中混合气体的密度不变 D、密闭容器中NH3的体积分数不变15. 如图所示,将SO2通入下列不同溶液中,实验现象与所得结论均正确的是( )溶液
实验现象
实验结论

A
NaOH溶液
无明显现象
SO2与NaOH
溶液不反应
B
H2S溶液
产生黄色沉淀
SO2有氧化性
C
酸性KMnO4溶液
紫色溶液褪色
SO2有漂白性
D
紫色石蕊试液
溶液先变红,
后褪色
SO2的水溶液呈酸性,
且SO2有漂白性
A、A B、B C、C D、D16. 实验室制取少量干燥的氨气涉及下列装置,其中正确的是( ) A、①是氨气发生和干燥装置 B、②是氨气吸收装置 C、③是氨气发生装置 D、④是氨气收集、检验装置17. 将19.2g的铜屑投入到400 mL浓度均为0.5mol/L HNO3和H2SO4的混合溶液中,溶液增加的质量为( )A、4.5 g B、9.9 g C、13.2 g D、14.7 g18. 某单液电池如图所示,其反应原理为。下列说法正确的是( )
A、①是氨气发生和干燥装置 B、②是氨气吸收装置 C、③是氨气发生装置 D、④是氨气收集、检验装置17. 将19.2g的铜屑投入到400 mL浓度均为0.5mol/L HNO3和H2SO4的混合溶液中,溶液增加的质量为( )A、4.5 g B、9.9 g C、13.2 g D、14.7 g18. 某单液电池如图所示,其反应原理为。下列说法正确的是( ) A、右侧Pt电极为负极 B、左侧电极上发生还原反应 C、溶液中H+向右侧电极移动 D、右侧电极的电极反应式为19. 由下列实验及现象能推出相应结论的是( )
A、右侧Pt电极为负极 B、左侧电极上发生还原反应 C、溶液中H+向右侧电极移动 D、右侧电极的电极反应式为19. 由下列实验及现象能推出相应结论的是( )选项
实验
现象
结论
A
某FeCO3试样用稀硝酸溶解,然后加入KSCN溶液
溶液变红色
试样中含有Fe3+
B
NH3和Cl2分别通入溶有SO2的BaCl2溶液
均有白色沉淀
沉淀均为BaSO3
C
试管中某试样加入氢氧化钠溶液
试管口湿润的红色石蕊试纸不变蓝
原试样中不含NH
D
在实验室中将浓硝酸久置
变黄色
硝酸不稳定
A、A B、B C、C D、D20. 合成氨工业中氢气可由天然气和水反应制备,其主要反应为:CH4(g)+2H2O(g)CO2(g)+4H2(g)。已知下列键能数据:则该反应中能量变化为( )化学键
C-H
H-O
C=O
H-H
键能/kJ·mol-1
414
464
803
436
A、162kJ B、766kJ C、965kJ D、1470kJ二、填空题
-
21. 如表为元素周期表的一部分,请回答有关问题
IA
IIA
IIIA
IVA
VA
VIA
VIIA
0
1
①
2
②
③
④
3
⑤
⑥
⑦
⑧
4
⑨
⑩
(1)、已知元素⑩的一种核素,其中中子数为45,用原子符号表示该核素为。(2)、由元素③形成的单质分子的结构式为 , 用电子式表示⑤和⑧两元素形成化合物的过程。(3)、由上述元素构成的淡黄色固体化合物的电子式 , 该化合物所含的化学键类型(填“离子键”、“极性键”或“非极性键”)。(4)、元素⑦、⑧、⑨其离子半径由大到小的顺序是(用离子符号),元素⑤的最高价氧化物的水化物与元素⑥的最高价氧化物对应的水化物反应的离子方程式为。(5)、下列事实不能说明元素⑧的非金属性比元素⑦的非金属性强的是____。A.元素⑧的单质与⑦的氢化物的水溶液反应,溶液变浑浊A、元素⑧的单质能将Fe氧化成三价铁,而元素⑦的单质只能将铁氧化成二价铁 B、⑦和⑧两元素的简单氢化物受热分解,后者的分解温度高 C、元素⑧的氢化物的水溶液的酸性比元素⑦的氢化物水溶液的酸性强22. 如图为原电池装置。 (1)、若A极为铝B极为镁,烧杯内液体为氢氧化钠溶液,该电池工作时A极发生的电极反应式为。(2)、若A为Pb,B为PbO2 , 烧杯内液体为硫酸溶液,电池工作时的总反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O。写出A电极反应式:。该电池在工作时,A电极的质量将(填“增加”“减小”或“不变”)。(3)、若A、B均为铂片,烧杯内液体为氢氧化钾溶液,分别从A、B两极通入H2和O2 , 该电池即为氢氧燃料电池,写出B电极反应式:。该电池在工作一段时间后,溶液的碱性将(填“增强”“减弱”或“不变”)。(4)、若A、B均为铂片,烧杯内液体为硫酸溶液,分别从A、B两极通入CH4和O2 , 该电池即为甲烷燃料电池,若该电池反应消耗了3.2gCH4时转移电子的数目为(用含阿伏加德罗常数NA的式子表示)。(5)、若A为锌片B为银片浸入到稀硫酸中组成原电池,工作前该电池中两电极的总质量为60g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47g,试计算:这段时间产生氢气的体积L(标准状况下)。23. 回答下列问题:(1)、I.如表是该小组研究影响过氧化氢H2O2分解速率的因素时采集的一组数据:用10mLH2O2制取150mLO2所需的时间(秒)。
(1)、若A极为铝B极为镁,烧杯内液体为氢氧化钠溶液,该电池工作时A极发生的电极反应式为。(2)、若A为Pb,B为PbO2 , 烧杯内液体为硫酸溶液,电池工作时的总反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O。写出A电极反应式:。该电池在工作时,A电极的质量将(填“增加”“减小”或“不变”)。(3)、若A、B均为铂片,烧杯内液体为氢氧化钾溶液,分别从A、B两极通入H2和O2 , 该电池即为氢氧燃料电池,写出B电极反应式:。该电池在工作一段时间后,溶液的碱性将(填“增强”“减弱”或“不变”)。(4)、若A、B均为铂片,烧杯内液体为硫酸溶液,分别从A、B两极通入CH4和O2 , 该电池即为甲烷燃料电池,若该电池反应消耗了3.2gCH4时转移电子的数目为(用含阿伏加德罗常数NA的式子表示)。(5)、若A为锌片B为银片浸入到稀硫酸中组成原电池,工作前该电池中两电极的总质量为60g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47g,试计算:这段时间产生氢气的体积L(标准状况下)。23. 回答下列问题:(1)、I.如表是该小组研究影响过氧化氢H2O2分解速率的因素时采集的一组数据:用10mLH2O2制取150mLO2所需的时间(秒)。30%H2O2
15%H2O2
10%H2O2
5%H2O2
无催化剂、不加热
几乎不反应
几乎不反应
几乎不反应
几乎不反应
无催化剂、加热
360s
480s
540s
720s
MnO2催化剂、加热
10s
25s
60s
120s
该研究小组在设计方案时。考虑了浓度、、等因素对过氧化氢分解速率的影响。
(2)、II.100mL1mol·L-1稀硫酸与过量锌粒反应,一定温度下,为了减缓反应速率,又不影响生成氢气的总量,可采取的措施是____。A、加入少量碳酸钠粉末 B、加入少量硫酸铜溶液 C、加入适量Na2SO4溶液 D、加热 E、加水(3)、III.一定温度下某反应在体积为5L的恒容密闭的容器中进行,各物质的量随时间的变化情况如图所示(已知A、B、C均为气体)。
该反应的化学方程式为。
(4)、反应开始至2分钟时,B的平均反应速率为。(5)、由图求得平衡时A的转化率为。(6)、平衡时体系内的压强与初始时压强之比为。三、综合题
-
24. 某校课外活动小组为了探究铜与稀硝酸反应产生的气体主要是NO而设计了下列实验,装置如图所示(加热装置和固定装置均已略去)。图中K为止水夹(处于关闭状态),F是吸入一半空气的注射器。请回答有关问题:
 (1)、设计装置A的目的是 , 为达此目的应进行的操作是。(2)、在完成(1)中的“操作”后,将装置B中的铜丝插入稀硝酸,并微热之,观察到装置B中的现象是 , B中反应的离子方程式为。(3)、装置E和F的作用是 , 为实现此作用,将注射器中的空气推入E中,若气体变为则可证明。(4)、装置D的作用是。
(1)、设计装置A的目的是 , 为达此目的应进行的操作是。(2)、在完成(1)中的“操作”后,将装置B中的铜丝插入稀硝酸,并微热之,观察到装置B中的现象是 , B中反应的离子方程式为。(3)、装置E和F的作用是 , 为实现此作用,将注射器中的空气推入E中,若气体变为则可证明。(4)、装置D的作用是。