四川省成都市2022届高三第三次诊断考试理综化学试题
试卷更新日期:2022-05-30 类型:高考模拟
一、单选题
-
1. 北宋名画《千里江山图》流传千年依旧色彩艳丽璀璨,其中大量使用了石青[主要成分Cu3(CO3)2(OH)2]、石绿[主要成分Cu2(CO3)(OH)2]、赭石[主要成分Fe2O3]、朱砂[主要成分HgS]等颜料。下列叙述错误的是( )A、石青、石绿中“Cu(OH)2”比例不同其颜色不同 B、朱砂燃烧会产生刺激性气味的气体 C、赭石主要成分具有磁性 D、上述颜料中的金属元素均属于过渡元素2. 设NA代表阿伏加德罗常数的值。下列说法正确的是( )A、标准状况下,22.4L己烷中含有碳碳单键数目大于5NA B、将0.1mol乙醇完全催化氧化生成乙醛,转移电子数0.1NA C、1L0.5 mol/L 醋酸溶液中的分子总数目小于0.5NA D、8.7g MnO2与40mL 10 mol/L浓盐酸充分反应,生成Cl2分子数为0.1NA3. 实验室中对下列气体洗气除杂的方法可行的是( )
气体(杂质)
通过除杂试剂
A
C2H4(SO2)
酸性高锰酸钾溶液
B
NH3(H2O)
无水氯化钙
C
Cl2(HCl)
饱和食盐水
D
NO(HCl)
饱和NaHCO3溶液
A、A B、B C、C D、D4. a、b、c、d、e为原子序数依次增大的五种短周期元素。a、c同主族,离子化合物ca与水反应生成强碱X和a的单质。b、e同主族,化合物eb2是常见大气污染物。d的核电荷数比e少3。下列说法错误的是( )A、化合物a2e沸点比a2b的低 B、化合物c2b2中既含有离子键又有共价键 C、d单质可溶于X溶液 D、离子半径:c>d>e>b5. 某种钾-氧气可充电电池(示意图如图)的放电总反应为K+O2=KO2。“界面”可阻止电解液的持续降解,电解质是一种只允许K+传导的有机溶剂。下列说法正确的是( ) A、KO2是负极产物 B、放电时,外电路每转移1mole- , 正极区域质量增加32g C、充电时,碳电极上发生还原反应 D、有效抑制氧气在电池中扩散,可极大延长钾-氧气电池的循环性能6. 利用苯甲醛和乙酸酐发生Perkin 反应可制备香料分子肉桂酸:( )
A、KO2是负极产物 B、放电时,外电路每转移1mole- , 正极区域质量增加32g C、充电时,碳电极上发生还原反应 D、有效抑制氧气在电池中扩散,可极大延长钾-氧气电池的循环性能6. 利用苯甲醛和乙酸酐发生Perkin 反应可制备香料分子肉桂酸:( ) A、苯甲醛可发生氧化、加成反应 B、1 mol 肉桂酸最多可与5 mol H2发生加成反应 C、乙酸酐与乙酸既不是同分异构,也不是同系物 D、乙酸分子中最多6个原子共平面7. 分别向0.2 mol·L-1 NaX溶液加入少量NaOH固体或通入HCl气体时,所得溶液中部分微粒浓度的对数lgc与pH关系如图所示。已知HX为一元弱酸,lg2≈0.3。下列说法错误的是( )
A、苯甲醛可发生氧化、加成反应 B、1 mol 肉桂酸最多可与5 mol H2发生加成反应 C、乙酸酐与乙酸既不是同分异构,也不是同系物 D、乙酸分子中最多6个原子共平面7. 分别向0.2 mol·L-1 NaX溶液加入少量NaOH固体或通入HCl气体时,所得溶液中部分微粒浓度的对数lgc与pH关系如图所示。已知HX为一元弱酸,lg2≈0.3。下列说法错误的是( ) A、曲线代表lgc(HX)与pH的关系 B、甲、乙之间溶液存在c(Na+)>c(HX)>c(X-) C、0.2 mol·L-1NaX溶液的pH≈11.3 D、加水稀释甲点混合溶液,交点甲沿OH-线向左下移动
A、曲线代表lgc(HX)与pH的关系 B、甲、乙之间溶液存在c(Na+)>c(HX)>c(X-) C、0.2 mol·L-1NaX溶液的pH≈11.3 D、加水稀释甲点混合溶液,交点甲沿OH-线向左下移动二、综合题
-
8. 纯品氯化钠可用于食品、制药、氯碱工业等许多领域。实验室中利用下列装置进行从海水提取纯品氯化钠的实验。海水中主要离子及浓度见下表:
离子
Cl-
Na+
Mg2+
SO
Ca2+
K+
浓度(×10-3mol/L)
546
468
53.3
28.1
10.4
9.97
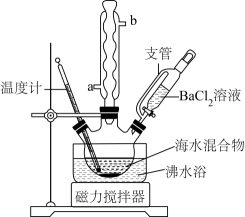
回答下列问题。
(1)、盛放BaCl2溶液的仪器名称为 , 球形冷凝管的出水管为(填“a”或“b”)。(2)、在95℃下对30mL海水混合物进行加热搅拌,同时缓慢滴加约2mL1mol·L-1BaCl2溶液,加热10min后取下,确定沉淀完全的实验方法是 , 能否用CaCl2代替BaCl2做沉淀剂(填“能”或“否”)。(3)、减压过滤(第一次)出泥沙与BaSO4 , 减压过滤的主要优点是(写一条)。(4)、加热滤液至沸,分别加入2mL3mol·L-1NaOH溶液和2mL饱和Na2CO3溶液,10min后减压过滤(第二次)。进行两次过滤而不是合并一次过滤的主要目的是:①防止泥沙溶于NaOH溶液;②防止发生沉淀转化:(写出离子方程式)。工业上不宜选择用Ba(OH)2同时除去Mg2+和SO , 可能的合理考虑是(双选)。A.Ba(OH)2比较贵
B.Ba(OH)2的溶解度比较低
C.Ba(OH)2属于二元强碱
D.SO恰好沉淀完全时,Mg2+不能完全沉淀
(5)、在滤液中滴加2mol·L-1盐酸,直至溶液pH在2~3之间,搅拌。有人认为调节溶液酸碱性呈中性即可,这样做的后果是。(6)、据下图分析,将调节pH后的溶液转移至蒸发皿中,小火加热,再经、 , 乙醇洗涤,干燥,得到纯品氯化钠。 9. 锂辉石矿[主要含有LiAlSi2O6 , 还有少量Fe2+、Mg2+]是主要锂源,现利用锂辉石矿制取LiBr,用于高级电池的电解质、医用镇静剂等。工艺流程如下:
9. 锂辉石矿[主要含有LiAlSi2O6 , 还有少量Fe2+、Mg2+]是主要锂源,现利用锂辉石矿制取LiBr,用于高级电池的电解质、医用镇静剂等。工艺流程如下: (1)、锂辉石中主要成分LiAlSi2O6改写为氧化物形式为。(2)、工业选择石灰石进行“中和”而不选择纯碱的主要考虑是 ;在“除镁除铁(调节pH≈11)”步骤中得到的滤渣中含铁成分是;写出“除铝”所发生的离子反应方程式。(3)、碳酸锂在水中的溶解度较小,其-lgKsp与温度t关系如下:
(1)、锂辉石中主要成分LiAlSi2O6改写为氧化物形式为。(2)、工业选择石灰石进行“中和”而不选择纯碱的主要考虑是 ;在“除镁除铁(调节pH≈11)”步骤中得到的滤渣中含铁成分是;写出“除铝”所发生的离子反应方程式。(3)、碳酸锂在水中的溶解度较小,其-lgKsp与温度t关系如下:t/℃
0
10
20
30
40
50
60
70
80
-1gKsp
1.44
1.53
1.63
1.71
1.80
1.90
2.00
2.21
2.43
由此可知碳酸锂在水中的溶解热效应ΔH0(填“>”或者“<”);加入纯碱试剂进行“沉锂”后,依次进行保温静置、(填写正确的顺序)。
①洗涤 ②趁热过滤 ③离心分离
(4)、在“合成”中,碳酸锂粉末分次少量加入到冰水中溶解,再加入尿素搅拌得到“料液”,料液中徐徐加入溴,控制pH=5.0,反应生成LiBr和两种无色无味气体,写出化学方程式。10. 环己烷和苯均是重要的化工原料,对环己烷一苯系统的研究既有生产实际价值,也具有理论意义。回答下列问题。(1)、环己烷脱氢生苯的热效应研究①已知下列物质的燃烧热数据如下:
物质
C(s,石墨)
H2(g)
 (g)
(g) (g)
(g)∆H/kJ·mol-1
-393.5
-285.6
-3264
-3920
则计算脱氢反应:
 (g,环己烷)
(g,环己烷) (g)+3 H2(g)的ΔH= kJ·mol-1;
(g)+3 H2(g)的ΔH= kJ·mol-1;②利用下列表格中的键能数据计算上述脱氢反应的ΔH时,计算值与实测值差异较大。试从分子结构的角度解释原因;
化学键
C-H
C-C
C=C
H-H
键能/kJ·mol-1
412
348
612
436
(2)、脱氢生苯的平衡研究将适量环己烷蒸气置于恒压密闭容器中,掺混水蒸气。在不同反应温度下,测得环己烷的平衡转化率如图实线所示:

①掺入水蒸气能提高环己烷的平衡转化率,解释说明该事实;
②要提高气态原料的平衡转化率,还可采取的措施是(写一条)。
(3)、脱氢生苯的动力学研究①一定条件下测得在2L恒容容器中单纯进行脱氢反应的n(H2)如下:
t/min
0
2.0
4.0
6.0
8.0
n(H2)/10-3mol
0
1.6
3.5
5.2
7.0
计算2.0min~8.0min内,(苯)=mol·min-1(保留两位有效数字);
②在催化剂作用下,产物苯的选择性(指各种可能的有机产物中苯的体积分数)如图中虚线所示。据此判断此时选择最佳温度为(填字母序号)左右。
A450℃ B.550℃ C.650℃ D.800℃
③在温度较高时,随温度升高环己烷的转化率升高,但苯的选择性降低,可能原因是。
(4)、一定条件下,如图所示装置可实现有机物的电化学储氢。阴极气体产物除环己烷和H2外,无其它有机产物。阴极上苯生成环己烷的电极反应式为;阴极产生H2的物质的量为mol。 11. 某笼形包合物Ni(CN)a(NH3)b(C6H6)c的晶胞如图所示。回答下列有关问题。
11. 某笼形包合物Ni(CN)a(NH3)b(C6H6)c的晶胞如图所示。回答下列有关问题。 (1)、基态镍原子的价层电子排布式为;该物质中非金属元素电负性由大到小是。(2)、NH3中N的杂化轨道类型为;从结构角度分析C、P原子之间不易形成π键的原因是。(3)、在晶胞中,镍离子与CN-之间产生配位键,配体CN-提供的配位原子有;镍离子的配位数为。(4)、推测该包合物中氨与苯分子数目比,即b:c为 , 其中Ni的平均化合价为。(5)、若此晶胞体积为Vnm3 , 阿伏加德罗常数为NAmol-1 , 晶胞的摩尔质量为Mg/mol,则晶体密度为g/cm3(列出计算表达式)。12. 氟硝西泮是一种强镇静剂,由2-氟甲苯合成其前体物质的路线如下:
(1)、基态镍原子的价层电子排布式为;该物质中非金属元素电负性由大到小是。(2)、NH3中N的杂化轨道类型为;从结构角度分析C、P原子之间不易形成π键的原因是。(3)、在晶胞中,镍离子与CN-之间产生配位键,配体CN-提供的配位原子有;镍离子的配位数为。(4)、推测该包合物中氨与苯分子数目比,即b:c为 , 其中Ni的平均化合价为。(5)、若此晶胞体积为Vnm3 , 阿伏加德罗常数为NAmol-1 , 晶胞的摩尔质量为Mg/mol,则晶体密度为g/cm3(列出计算表达式)。12. 氟硝西泮是一种强镇静剂,由2-氟甲苯合成其前体物质的路线如下: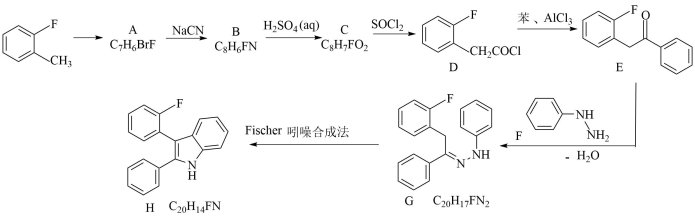 (1)、2-氟甲苯的等效氢有种;由它生成A的试剂与条件是。(2)、A生成B的反应类型为;C中含氧官能团名称为。(3)、由D与苯反应生成E的化学方程式为。(4)、由E与F反应生成G,经历多步反应。第一步为加成反应,生成产物的结构简式为;由G生成H步骤还产生了一种无机分子,它是。(5)、化合物C的同分异构体中,写出能同时满足下列条件的三种分子的结构简式。
(1)、2-氟甲苯的等效氢有种;由它生成A的试剂与条件是。(2)、A生成B的反应类型为;C中含氧官能团名称为。(3)、由D与苯反应生成E的化学方程式为。(4)、由E与F反应生成G,经历多步反应。第一步为加成反应,生成产物的结构简式为;由G生成H步骤还产生了一种无机分子,它是。(5)、化合物C的同分异构体中,写出能同时满足下列条件的三种分子的结构简式。a.能发生银镜反应; b.遇FeCl3溶液显色;
c.具有-CH2F基团; d.属1,2,3-三取代苯衍生物