山东省临沂市2022届高三第二次模拟考试化学试题
试卷更新日期:2022-05-30 类型:高考模拟
一、单选题
-
1. 实验室中下列做法正确的是( )A、用无水氯化钙干燥氨气 B、用二硫化碳清洗试管内壁附着的硫 C、用带橡胶塞的棕色瓶保存浓硝酸 D、用坩埚加热制备2. 下列生活应用或生产活动,没有运用相应化学知识的是( )
选项
生活应用或生产活动
化学知识
A
用二氧化碳跨临界直接制冰
液态二氧化碳汽化时吸热
B
用小苏打焙制糕点
受热易分解生成气体
C
用溶液蚀刻电路板上的铜
溶液呈酸性
D
丙三醇可用于配制化妆品
丙三醇与水形成氢键,有很强的保湿性
A、A B、B C、C D、D3. 利用下列仪器(夹持装置略)能完成的实验是( )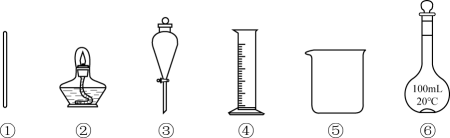 A、用四氯化碳萃取碘水中的碘 B、溶液的浓缩结晶 C、配制100mL的稀硫酸 D、除去苯甲酸晶体中的4. 某新型漂白剂的结构如图,其组成元素均为短周期元素,其中X与Y同周期,X与W对应的简单离子核外电子排布相同,且W、Y、Z的价电子数之和等于X的最外层电子数。下列说法错误的是( )
A、用四氯化碳萃取碘水中的碘 B、溶液的浓缩结晶 C、配制100mL的稀硫酸 D、除去苯甲酸晶体中的4. 某新型漂白剂的结构如图,其组成元素均为短周期元素,其中X与Y同周期,X与W对应的简单离子核外电子排布相同,且W、Y、Z的价电子数之和等于X的最外层电子数。下列说法错误的是( ) A、原子半径:W>Y>X>Z B、四种元素中X电负性最大 C、1mol该物质中含有2mol配位键 D、第一电离能介于X与Y之间的同周期元素有1种5. 某合成药物中间体的结构简式如图所示。下列关于该化合物的说法错误的是( )
A、原子半径:W>Y>X>Z B、四种元素中X电负性最大 C、1mol该物质中含有2mol配位键 D、第一电离能介于X与Y之间的同周期元素有1种5. 某合成药物中间体的结构简式如图所示。下列关于该化合物的说法错误的是( ) A、分子式为 B、该分子存在顺反异构体 C、分子中碳原子有3种杂化方式 D、1mol该分子最多能与5mol发生加成反应6. 液氨具有微弱的导电性,加入钠单质可快速得到深蓝色溶液,并慢慢产生气泡,溶液导电能力显著提升。下列说法错误的是( )
A、分子式为 B、该分子存在顺反异构体 C、分子中碳原子有3种杂化方式 D、1mol该分子最多能与5mol发生加成反应6. 液氨具有微弱的导电性,加入钠单质可快速得到深蓝色溶液,并慢慢产生气泡,溶液导电能力显著提升。下列说法错误的是( ) A、液氨能够发生电离,有和生成 B、钠和液氨可发生反应: C、蒸发钠的液氨溶液,蓝色会逐渐褪去 D、0.1mol钠投入液氨中生成0.01mol时,Na共失去0.02mol电子7. 一种提纯白磷样品(含惰性杂质)的工艺流程如图所示。下列说法错误的是( )
A、液氨能够发生电离,有和生成 B、钠和液氨可发生反应: C、蒸发钠的液氨溶液,蓝色会逐渐褪去 D、0.1mol钠投入液氨中生成0.01mol时,Na共失去0.02mol电子7. 一种提纯白磷样品(含惰性杂质)的工艺流程如图所示。下列说法错误的是( ) A、不慎将白磷沾到皮肤上,可用稀溶液冲洗 B、过程I中氧化产物和还原产物的物质的量之比为5∶6 C、过程II中,除生成外,还可能生成、 D、过程III的化学方程式为8. 环丙叉环丙烷(b)具有特殊的结构,其转化关系如图所示。下列说法正确的是( )
A、不慎将白磷沾到皮肤上,可用稀溶液冲洗 B、过程I中氧化产物和还原产物的物质的量之比为5∶6 C、过程II中,除生成外,还可能生成、 D、过程III的化学方程式为8. 环丙叉环丙烷(b)具有特殊的结构,其转化关系如图所示。下列说法正确的是( ) A、b的二氯代物有3种 B、m的所有原子都在一个平面内 C、p在氢氧化钠的乙醇溶液中加热生成烯烃 D、p和m可用红外光谱区分,但不能用核磁共振氢谱区分9. 三氯乙醛是生产农药、医药的重要中间体,实验室制备三氯乙醛的装置(加热仪器略)如图所示。已知:易溶于水和乙醇,易被HClO氧化生成。下列说法错误的是( )
A、b的二氯代物有3种 B、m的所有原子都在一个平面内 C、p在氢氧化钠的乙醇溶液中加热生成烯烃 D、p和m可用红外光谱区分,但不能用核磁共振氢谱区分9. 三氯乙醛是生产农药、医药的重要中间体,实验室制备三氯乙醛的装置(加热仪器略)如图所示。已知:易溶于水和乙醇,易被HClO氧化生成。下列说法错误的是( ) A、反应结束后可通过分液法分离出产品 B、反应过程中可能会生成副产物 C、装置c中主反应为 D、在b和c之间、d和e之间均需增加干燥装置10. 一种以硼镁矿(含2MgO·B2O3·H2O、SiO2及少量FeO、Fe2O3、Al2O3等)为原料生产硼酸(H3BO3)的工艺流程如下。
A、反应结束后可通过分液法分离出产品 B、反应过程中可能会生成副产物 C、装置c中主反应为 D、在b和c之间、d和e之间均需增加干燥装置10. 一种以硼镁矿(含2MgO·B2O3·H2O、SiO2及少量FeO、Fe2O3、Al2O3等)为原料生产硼酸(H3BO3)的工艺流程如下。
已知:与足量NaOH溶液反应生成。
下列说法错误的是( )
A、的电离方程式为 B、“热过滤”的目的是防止从溶液中结晶析出 C、“除杂”过程中加入的试剂X依次为MgO、 D、“母液”经蒸发浓缩、冷却结晶、过滤洗涤、干燥可得到硫酸镁晶体11. 根据下列实验操作和现象所得出的结论正确的是( )选项
实验操作和现象
结论
A
向新制的硫酸亚铁溶液中滴加邻二氮菲(
 )溶液,溶液变为橙红色
)溶液,溶液变为橙红色邻二氮菲能与亚铁离子形成配合物
B
向盛有Ag2O固体的两支试管中分别加入稀硝酸和氨水,Ag2O均溶解
Ag2O是两性氧化物
C
溴乙烷与NaOH的乙醇溶液混合、加热,将产生的气体通入盛有酸性KMnO4溶液的洗气瓶中,溶液褪色
反应生成了乙烯
D
向BaSO4固体中加入饱和Na2CO3溶液,过滤,沉淀洗净后加入足量稀盐酸,沉淀部分溶解,且产生气泡
A、A B、B C、C D、D12. 一种新型无隔膜可充电电池 , 水系电池以锌箔、石墨毡为集流体,和的混合液作电解质溶液,工作原理如图所示。
下列说法正确的是( )
A、过程I为充电过程,a接电源的正极 B、为增强电池效率,可向电解液中加入硫酸以增强溶液的导电性 C、过程II为放电过程,石墨毡极的电极反应式为 D、放电时,当外电路转移2mol时,两电极质量变化的差值为22g二、多选题
-
13. 一种以Pd―Cu为催化剂还原去除水体中的机理如图a所示;其他条件相同,不同pH时,转化率和不同产物在总还原产物中所占的物质的量的百分比如图b所示。

已知:溶液pH会影响Pd对的吸附,不影响对H的吸附。
下列说法正确的是( )
A、pH越大,Pd对的吸附能力越强 B、通过调节溶液的pH,可使更多的转化为 C、反应ii中生成的离子方程式为 D、pH=12时,每处理6.2g , 理论上消耗标准状况下5.6L14. 在2L恒容密闭容器中,充入2.0molNO和2.0mol , 在一定条件下发生反应 , 测得平衡体系中NO、的物质的量分数与温度的关系如图所示。下列说法正确的是( ) A、该反应正反应的活化能大于逆反应的活化能 B、时,当时反应达到平衡状态 C、时,若反应经t s达到平衡,则 D、b点时,往容器中再充入NO、、、各1.0mol,再次平衡时增大15. 常温下,向一定浓度H2C2O4溶液中加入KOH(s),保持溶液体积和温度不变,测得pH与-lg X[X为、、]变化如图所示。下列说法错误的是( )
A、该反应正反应的活化能大于逆反应的活化能 B、时,当时反应达到平衡状态 C、时,若反应经t s达到平衡,则 D、b点时,往容器中再充入NO、、、各1.0mol,再次平衡时增大15. 常温下,向一定浓度H2C2O4溶液中加入KOH(s),保持溶液体积和温度不变,测得pH与-lg X[X为、、]变化如图所示。下列说法错误的是( ) A、常温下,的 B、a点溶液中: C、溶液中: D、b点溶液中:
A、常温下,的 B、a点溶液中: C、溶液中: D、b点溶液中:三、综合题
-
16. 铜阳极泥(含有Cu2S、Se、Ag2Se、Au等)是粗铜电解精炼的副产品,常用作提取稀散元素和贵金属的重要原料。
 (1)、Cu2S溶解的离子方程式为;从“有机相”可回收的金属是。(2)、保持其他条件不变,测得Cu元素浸出率、Se元素浸出率和浸出渣率[]随加入的质量变化如图所示。
(1)、Cu2S溶解的离子方程式为;从“有机相”可回收的金属是。(2)、保持其他条件不变,测得Cu元素浸出率、Se元素浸出率和浸出渣率[]随加入的质量变化如图所示。
①加入的质量约为g时,Cu元素恰好完全浸出。
②当时,Se元素浸出率和浸出渣率均增加的原因是。
(3)、已知“溶浸”时发生的反应如下:;
则“沉银”时,溶液中时,可使Ag+沉淀完全[即]。
(4)、研究发现,硫代硫酸盐浸出金的过程是电化学催化腐蚀过程,催化机理如图所示。
①正极的电极反应式为;浸金过程中的催化剂是(填化学式)。
②若有标准状况下11.2L参加反应,浸出金的质量为g。
17. 金属镍及其化合物在军工机械、生产生活中有着广泛的用途。(1)、与丁二酮肟生成鲜红色丁二酮肟镍沉淀,该反应可用于检验。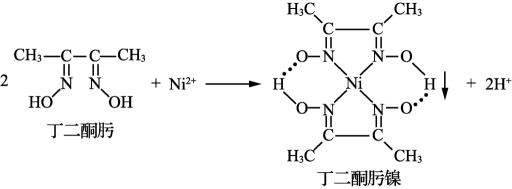
①基态核外电子排布式为。
②丁二酮肟镍分子中采取杂化,为平面正方形构型,则该分子中共面的原子最多为个。
③丁二酮肟镍分子内存在的化学键有(填标号)。
A.离子键 B.配位键 C.氢键 D.范德华力
(2)、镍能形成多种配合物,如、等。①晶体中含有的键与键数目之比为。
②中键角H-N-H比独立存在的分子中键角略大,其原因是。
(3)、苯与在氨水中可生成一种淡紫色苯包合沉淀物,苯分子位于晶胞的体心且2个碳碳键平行于z轴。该晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°。已知键长为 , 键长为。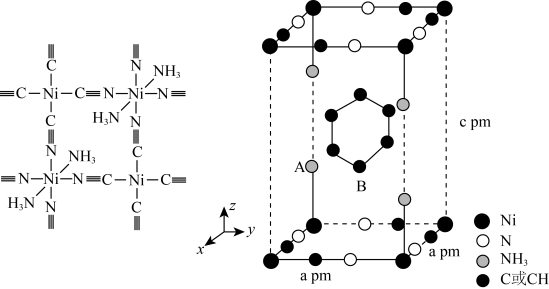
则该晶体的化学式为;A点的分数坐标为;晶胞中A、B间距离d=pm。
18. (三草酸合铁酸钾)易溶于水,难溶于乙醇,常用作有机反应的催化剂。某同学利用下图装置制备 , 然后再制备三草酸合铁酸钾。
回答下列问题:
(1)、打开、和 , 关闭 , 制备。为使生成的溶液与溶液接触,应进行的操作为 , B中生成沉淀的离子方程式为。(2)、向中加入过量饱和溶液,水浴加热并缓慢滴加溶液,制得 , 同时有红褐色沉淀生成,该反应的化学方程式为;将上述混合物煮沸,加入饱和溶液,充分反应后缓慢加入乙醇,结晶、抽滤、洗涤、干燥得到目标产物。将混合物煮沸的目的是;的作用是。(3)、制备的中可能含有 , 采用滴定法测定产品纯度,实验步骤如下。I.取a g样品于锥形瓶中,加入稀溶解,水浴加热至75℃。用的溶液趁热滴定,消耗溶液。
II.向上述溶液中加入适量还原剂将完全还原为 , 加入稀酸化后,在75℃继续用溶液滴定,又消耗溶液。
若省略步骤II,能否测定的质量分数(若能,写出表达式;若不能,说明原因);若样品中不含 , 则与的关系为;若步骤I中滴入不足,则测得样品中Fe元素含量(填“偏高”、“偏低”或“不变”)。
19. 用制备 , 有利于实现“双碳”目标。主要反应为:I.
II.
(1)、已知298K时,部分物质的相对能量如下表所示(忽略随温度的变化)。物质
相对能量(kJ·mol)
-393
-286
-242
-110
0
52
则。
(2)、向某刚性容器中,按投料比充入和 , 在不同催化剂(M、N)下发生上述反应。一段时间后,测得的转化率的选择性(含碳生成物中的百分含量)随温度的变化如图1所示。
①由图可知,的催化效果好(填“M”或“N”)。
②500~800K之间,乙烯的选择性随温度变化的原因是。
(3)、在一定条件下,向密闭容器中充入5.0mol和8.0mol , 发生反应。测得相同时间内,的转化率随温度的变化如图2所示(虚线表示的平衡转化率随温度的变化);速率常数的对数与温度的倒数之间的关系如图3所示。
①由图可知,(填“>”、“<”或“=”);已知z点体系的压强为200kPa,则时,该反应的标准平衡常数(保留2位小数,已知:分压=总压×该组分物质的量分数,对于反应 , , 其中 , 、、、为各组分的平衡分压)。
②已知速率方程 , , 、是速率常数。图中a、b、c、d分别代表x点、z点的速率常数,其中点表示x点的;升高温度时,(填“增大”、“减小”或“不变”)。
20. 某药物中间体F的合成路线如下
回答下列问题:
(1)、A→B的反应类型是;C中含氧官能团的名称为。(2)、A的结构简式为;符合下列条件的A的同分异构体有种(不考虑立体异构)。①含有苯环和两个
②能与NaOH溶液发生反应
③核磁共振氢谱为4组峰,且峰面积比为4∶2∶1∶1
(3)、B→C的化学方程式为;E的结构简式为。(4)、结合题给信息,写出 和
和 制备
制备 的合成路线。
的合成路线。