江西省鹰潭市2022届高三第二次模拟考试理科综合化学试题
试卷更新日期:2022-05-30 类型:高考模拟
一、单选题
-
1. 化学无处不在,化学科学与技术在宇宙探索、改进生活、改善环境与促进发展等方面均发挥着关键性的作用。下列说法正确的是( )A、“祝融号”火星车的供电装置太阳能电池板的主要成分为二氧化硅 B、2021年我国科学家以CO2为原料合成了淀粉,由CO2合成淀粉有利于实现碳达峰、碳中和的战略 C、航天服使用的棉针织品、羊毛、氯丁尼龙橡胶等都属于天然高分子材料 D、二氧化硫有毒,严禁将其添加到任何食品和饮料中2. 下列离子方程书写错误的是( )A、向 FeI2、FeBr2的混合溶液中通入少量氯气:2I-+Cl2= I2+2Cl- B、过量Ca(HCO3)2溶液与Ca(OH)2溶液反应:HCO + Ca2+ + OH- = CaCO3↓ + H2O C、向 NaHCO3溶液中加入氯化铁溶液:3HCO+Fe3+ =3CO2↑+Fe(OH)3↓ D、AgCl悬浊液中滴入Na2S溶液:2Ag++S2- =Ag2S↓3. 已知某兴奋剂乙基雌烯醇的结构如图所示。下列叙述正确的是( )
 A、在浓硫酸作用下,分子内消去一个水分子,产物有三种有机物 B、该物质可发生氧化反应,还原反应 C、该物质不可能有芳香族的同分异构体 D、该物质分子中的所有碳原子均共平面4. 根据下列实验操作和现象,得到的结论错误的是( )
A、在浓硫酸作用下,分子内消去一个水分子,产物有三种有机物 B、该物质可发生氧化反应,还原反应 C、该物质不可能有芳香族的同分异构体 D、该物质分子中的所有碳原子均共平面4. 根据下列实验操作和现象,得到的结论错误的是( )选项
实验操作和现象
结论
A
向盛溶液的试管中滴加溶液至不再有白色沉淀产生,再向其中滴加溶液,白色沉淀转化为黑色沉淀
证明
B
向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,有白色沉淀生成,溶液红色变浅
证明纯碱溶液呈碱性是由CO 水解引起的
C
向淀粉溶液中加适量20%H2SO4溶液,加热,冷却后加NaOH溶液至碱性,再滴加少量碘水,溶液未变蓝
淀粉完全水解
D
压缩装有H2、I2(g)和HI混合气体(已平衡)的密闭容器,观察到气体颜色加深
无法证明平衡发生了移动
A、A B、B C、C D、D5. 某多孔储氢材料结构如图,M、W、X、Y、Z五种短周期元素原子序数依次增大,Z比Y的原子序数大9。下列说法正确的是( ) A、最高价氧化物的水化物酸性 Y>X B、原子半径: C、简单氢化物的沸点: D、M、Y、Z不能形成离子化合物6. 2022年的北京冬奥会使用了液流电池做备用电源。液流电池具有储能时间长,安全稳定的优势,电池中的电解液在正负极附近各自循环。电池的总反应为 , 其中
A、最高价氧化物的水化物酸性 Y>X B、原子半径: C、简单氢化物的沸点: D、M、Y、Z不能形成离子化合物6. 2022年的北京冬奥会使用了液流电池做备用电源。液流电池具有储能时间长,安全稳定的优势,电池中的电解液在正负极附近各自循环。电池的总反应为 , 其中
下列说法正确的是( )
A、电池可用铁做负极 B、放电时正极反应为 C、电池充电时,转移1mol电子,阴极附近增加2mol离子 D、电池的离子选择膜可以用阳离子交换膜,也可用阴离子交换膜7. 25℃时,某混合溶液中c(H2A)+c(HA-)+c(A2-)=0.01 mol·L-1 , 由水电离出的c水(H+)的对数1g c水(H+)与的关系如图所示。下列说法正确的是( ) A、曲线L1表示1g c水(H+)与的变化关系 B、Y点时存在c(H2A)=c(HA-)=c(A2-) C、X点时溶液的pH=5 D、Ka2(H2A)=10-8
A、曲线L1表示1g c水(H+)与的变化关系 B、Y点时存在c(H2A)=c(HA-)=c(A2-) C、X点时溶液的pH=5 D、Ka2(H2A)=10-8二、综合题
-
8. 亚硫酰氯(SOCl2)又名氯化亚砜,是一种无色或淡黄色发烟液体,有强烈刺激性气味,其熔点-105℃,沸点79℃,140℃以上时易分解。遇水剧烈反应生成SO2和另一种酸性气体,常用作脱水剂,主要用于制造酰基氯化物,还用于医药、农药、染料等的生产。
实验室合成SOCl2的原理之一为SO2+Cl2+SCl22SOCl2 , 部分装置(夹持、加热装置略去)如图所示。
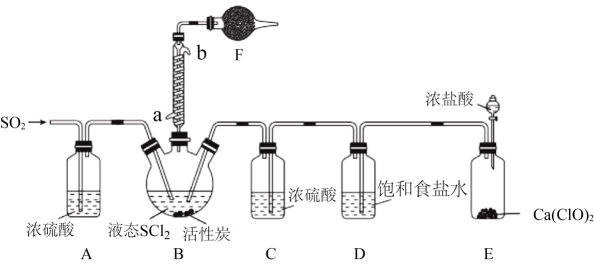 (1)、①仪器F的名称为 , 所盛的试剂是;
(1)、①仪器F的名称为 , 所盛的试剂是;②装置A、C除干燥气体外,另一作用可能是;
如果没有A、C,二氧化硫与氯气在装置B中会有副反应发生,该反应的离子方程式为
③E中反应的化学方程式:。
(2)、甲同学认为SOCl2和FeCl3∙6H2O混合加热可制得无水FeCl3 , 但乙同学认为该实验可能发生副反应使产品不纯。乙同学设计如下实验判断副反应的可能性:取少量FeCl3∙6H2O于试管中,加入足量SOCl2 , 充分反应后向试管中加水溶解,用四支试管各取溶解后的溶液少许,分别进行下列实验,通过现象能验证发生副反应的是(填选项字母)。a.滴加BaCl2溶液 b.滴加K3[Fe(CN)6]溶液
c.滴加酸性KMnO4溶液 d.滴加溴水
(3)、分离产物后,向获得的SOCl2中加入足量NaOH溶液,振荡、静置得到无色溶液,检验该溶液中存在Cl-的需要用到的试剂是9. 硫酸镍主要用于电镀、镍电池、催化剂以及制取其他镍盐等,并用于印染媒染剂、金属着色剂等。NiSO4·nH2O易溶于水,难溶于乙醇,其水溶液显酸性。从电镀污泥中回收制备NiSO4·nH2O和其它金属的工艺流程如下。
已知:Ⅰ.电镀污泥含有Cu(OH)2、Ni(OH)2、Fe(OH)3、Cr(OH)3和SiO2等。
Ⅱ.萃取剂(RH)萃取Ni2+的原理为Ni2++2RHNiR2+2H+。
回答下列问题:
(1)、“酸浸”时,为加快浸出速率,提高生产效益,降低生产成本,下列措施不合理的有____ (填标号)。A、搅拌 B、适当增大硫酸的浓度 C、对污泥进一步球磨粉碎(2)、“电解”时,铜的电解电压(U)较低,且电解速率很快,铁和铬存在形式随电解电压的变化如下表。为得到纯的NiSO4·nH2O,电解电压(U)的范围是(单位:V)。电解电压/V
1.0
1.2
1.5
2.0
2.5
3.0
3.5
Fe2+
有
有
有
无
无
无
无
Cr4+
无
无
无
无
无
有
有
(3)、萃取余液可在操作单元中循环利用(填选项),A.酸浸 B.调pH C.除Cr
反萃取剂X为 (填化学式)。
(4)、“反萃取”得到的NiSO4溶液,可在强碱溶液中被NaClO氧化,得到用作镍镉电池正极材料的NiOOH。该反应的离子方程式为。(5)、第三代混合动力车,可以用电动机,内燃机或二者结合推动车轮。汽车上坡或加速时,电动机提供推动力,降低汽油的消耗;在下坡时,电池处于充电状态。混合动力车目前一般使用镍氢电池。镍氢电池充放电原理如图1所示,根据所给信息判断,混合动力车上坡或加速时,乙电极的电极反应式为。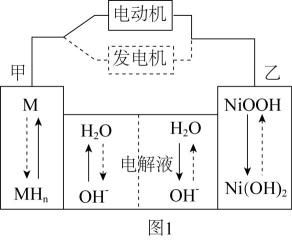 (6)、采用热重分析法测定NiSO4·nH2O样品所含结晶水数。将样品在900℃下进行煅烧,失重率随时间变化如下图,A点时失掉2个结晶水,n的值为。
(6)、采用热重分析法测定NiSO4·nH2O样品所含结晶水数。将样品在900℃下进行煅烧,失重率随时间变化如下图,A点时失掉2个结晶水,n的值为。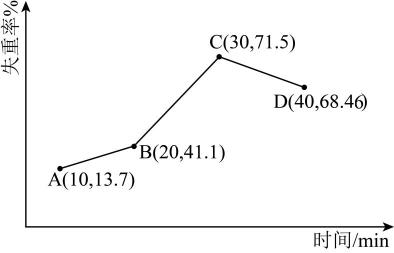 10. 合成氨是目前人工固氮最重要的途径,对人类生存具有重大意义,反应为:(1)、N2(g)+3H2(g)2NH3(g) ∆H=-92.4kJ/mol。
10. 合成氨是目前人工固氮最重要的途径,对人类生存具有重大意义,反应为:(1)、N2(g)+3H2(g)2NH3(g) ∆H=-92.4kJ/mol。①该反应在 (填“高温”“低温”或“任意温度”)下可自发进行。
我国科学家在合成氨反应机理研究中取得新进展,首次报道了LiH-3d过渡金属这一复合催化剂体系,并提出了“氮转移”催化机理。
i. 3LiH(s) + N2(g) =Li2NH(s) + LiNH2(g) ΔH1=+32.8kJ·mol-1
ii. Li2NH(s)+2H2(g)=2LiH(s)+NH3(g) ΔH2=-88kJ·mol-1
iii. LiNH2(g)+H2(g)=LiH(s)+NH3(g) ΔH3
②则ΔH3=。
(2)、为了研究反应的热效应,我国的科研人员计算了在一定范围内下列反应的平衡常数。i.
ii.
iii.
和的线性关系图如下所示:

①由图可知ΔH10(填“大于”或“小于”)。
②反应i的Kp0=(用Kp1和Kp2表示)。
反应i的0(填“大于”或“小于”),写出推理过程。
(3)、氨水可以吸收二氧化碳。已知常温下,Kb(NH3·H2O)=1.8×10-5 , Ka1(H2CO3) =4.4×10-7 , Ka2(H2CO3) =4.4×10-11 , . 此温度下某氨水的浓度为 2mol/L,则溶液中c(OH-)=mol/L,将CO2通入氨水中使溶液恰好呈中性,则此时 =(保留小数点后4位数字)11. 近年来,我国科学家对硫及其化合物进行广泛研究。硫及化合物应用于医药、半导体、颜料、光致发光装置、太阳能电池、红外检测器、光纤维通讯等。回答下列问题:(1)、硫原子的价电子轨道表示式为。(2)、硫化钠的熔点 (填“大于”“小于”或“等于”)硫化钾的熔点,原因是。(3)、硫酸根和硫代硫酸根的结构如下图所示:
S2O的空间构型为 , 中心硫原子的杂化轨道类型为。
(4)、硫原子和氧原子可形成多种链式硫酸根离子,连二硫酸根离子、连三硫酸根离子如下图所示:
这类硫原子数可变的多硫氧合阴离子的化学式可用通式表示为(用n代表硫原子数)。
(5)、天然硫化锌以闪锌矿和纤锌矿存在,ZnS的晶体结构如下图所示,闪锌矿中Zn2+的配位数为 , 已知原子A、B的分数坐标为(0, 0, 0)和(1, 1, 1),原子C的分数坐标为。 纤锌矿晶体堆积模型为。 (6)、闪锌矿中,设晶胞边长为a, Zn2+和 S2-的离子半径分别为和 , 则Zn2+和S2-离子的空间占有率为% (列出计算表达式)。12. 化合物M(
(6)、闪锌矿中,设晶胞边长为a, Zn2+和 S2-的离子半径分别为和 , 则Zn2+和S2-离子的空间占有率为% (列出计算表达式)。12. 化合物M(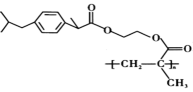 )是一种缓释型解热镇痛药。实验室由A和B制备M的一种合成路线如图所示:
)是一种缓释型解热镇痛药。实验室由A和B制备M的一种合成路线如图所示:
已知:①;
②
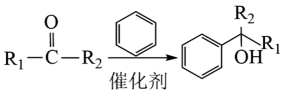 ;
;③。
回答下列问题:
(1)、A物质的名称为;B的结构简式为。(2)、X中官能团的名称为;由D生成E的反应类型为。(3)、由C到D的第一步反应的化学方程式为。(4)、由G到H的反应条件是。(5)、烃Y比B的相对分子质量小2,Y的结构含两个环,其中一个为苯环,两个环没有共用的碳原子,Y可能有种(不考虑立体异构)。(6)、参照上述合成路线和信息,以苯和乙醛为原料(无机试剂任选),设计制备聚苯乙烯的合成路线。