湖南省岳阳市2021-2022学年高三教学质量监测(三)化学试题
试卷更新日期:2022-05-30 类型:高考模拟
一、单选题
-
1. 生活是化学的源泉。下列叙述错误的是( )A、75%浓度的酒精、含氯消毒剂、过氧乙酸均可以有效灭活新型冠状病毒 B、许多食品包装盒里用小袋包装的铁粉来防止食品氧化变质 C、生产宇航服所用的碳化硅陶瓷和碳纤维材料,是一种新型无机非金属材料 D、可溶性铜盐有毒,故人体内不存在铜元素2. 新疆土质呈碱性、阳光充足等优势造就了新疆棉以绒长、品质好、产量高著称于世。下列有关说法错误的是( )A、新疆棉的主要成分为纤维素,属于天然有机高分子 B、新疆棉可被生物降解 C、新疆棉的主要成分和淀粉互为同分异构体 D、可用灼烧的方法鉴别新疆棉和蚕丝棉3. 设[aX+bY]为a个X微粒和b个Y微粒组成的一个微粒集合体,NA为阿伏加德罗常数的值。下列说法错误的是( )A、已知 2CO(g)+O2(g)=2CO2(g) ΔH=-221kJ·mol-1 , 则每 1 mol[CO(g)+O2(g)]完全燃烧放热 110.5kJ B、2 mol NO 和1 mol O2在密闭容器中充分反应,反应后容器中的分子数为 2NA C、22 gP4O6(分子结构:
 )中的共价键数目为 1.2NA
D、1molCl2与NaOH 稀溶液完全反应,则反应后的溶液中N(ClO-)+N(HClO)=1NA
4. 前20号主族元素W、X、Y、Z位于不同周期且原子序数依次增大,W的单质在Y的单质中可以安静地燃烧,火焰为苍白色,且伴有白雾生成;W、X、Y元素原子的最外层电子数之和为13,W与Z的族序数相邻。下列说法错误的是( )A、常温下,X的单质为气体 B、W与Z形成的化合物中可能含有共价键 C、W、X和Y三种元素可以形成离子化合物 D、简单离子半径:Y>Z>W5. 用下列装置进行实验(部分夹持仪器已省略),不能达到实验目的的是( )
)中的共价键数目为 1.2NA
D、1molCl2与NaOH 稀溶液完全反应,则反应后的溶液中N(ClO-)+N(HClO)=1NA
4. 前20号主族元素W、X、Y、Z位于不同周期且原子序数依次增大,W的单质在Y的单质中可以安静地燃烧,火焰为苍白色,且伴有白雾生成;W、X、Y元素原子的最外层电子数之和为13,W与Z的族序数相邻。下列说法错误的是( )A、常温下,X的单质为气体 B、W与Z形成的化合物中可能含有共价键 C、W、X和Y三种元素可以形成离子化合物 D、简单离子半径:Y>Z>W5. 用下列装置进行实验(部分夹持仪器已省略),不能达到实验目的的是( ) A、用甲装置制备并收集NH3 B、用乙装置进行NH3的喷泉实验 C、用丙装置制取少量乙酸乙酯 D、用丁装置制取氢氧化亚铁6. 合成新型多靶向性的治疗肿瘤的药物索拉非尼的部分流程如图。
A、用甲装置制备并收集NH3 B、用乙装置进行NH3的喷泉实验 C、用丙装置制取少量乙酸乙酯 D、用丁装置制取氢氧化亚铁6. 合成新型多靶向性的治疗肿瘤的药物索拉非尼的部分流程如图。
下列叙述错误的是( )
A、X结构中所有原子可能共面 B、上述转化过程均属于取代反应 C、X中环上二氯代物有6种 D、1molZ最多可与4molH2发生加成反应7. 用来解释下列事实的方程式错误的是( )A、钢铁发生吸氧腐蚀的正极反应:O2+4e-+2H2O=4OH- B、将氯气通入石灰乳制备漂白粉:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O C、向Na2SiO3溶液中通过量CO2制备硅酸凝胶:SiO32-+2CO2+2H2O=H2SiO3+2HCO3- D、溶质物质的量比为1:1的明矾溶液和Ba(OH)2溶液混合:2SO42-+2Ba2++Al3++4OH-=AlO2-+2BaSO4↓+2H2O8. 火法炼铜的原理Cu2S+O2 2Cu+SO2.下列说法正确的是( )A、+1的Cu被O2还原成了Cu单质 B、0.5 mol O2得到的电子,可氧化得到SO2 11.2 L C、每生成64 g Cu电子转移的总数约为3×6.02×1023 D、为了提高铜矿的利用率,O2应过量9. 氮氧化物(NOx)是一类特殊的污染物,它本身会对生态系统和人体健康造成危害。一种以沸石笼作为载体对氮氧化物进行催化还原的原理如图所示。下列叙述错误的是( )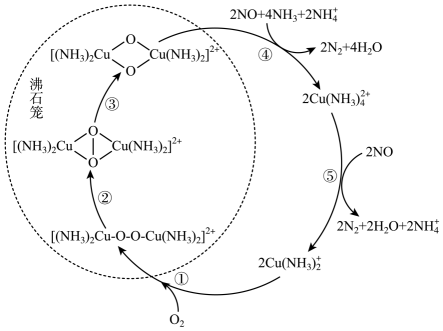 A、反应①变化过程可表示为2Cu(NH3)+O2=[(NH3)2Cu-O-O-Cu(NH3)2]2+ B、反应③属于非氧化还原反应 C、反应④涉及极性共价键的断裂与生成 D、图中总过程中每吸收1molNO需要标准状态下的NH344.8L10. 微生物电池在运行时,可同时实现无污染净化高浓度苯酚污水、高浓度酸性废水和海水淡化,其装置如图所示。图中 M 和 N 为阳离子交换膜或阴离子交换膜,Z以食盐水模拟海水。下列说法错误的是 ( )
A、反应①变化过程可表示为2Cu(NH3)+O2=[(NH3)2Cu-O-O-Cu(NH3)2]2+ B、反应③属于非氧化还原反应 C、反应④涉及极性共价键的断裂与生成 D、图中总过程中每吸收1molNO需要标准状态下的NH344.8L10. 微生物电池在运行时,可同时实现无污染净化高浓度苯酚污水、高浓度酸性废水和海水淡化,其装置如图所示。图中 M 和 N 为阳离子交换膜或阴离子交换膜,Z以食盐水模拟海水。下列说法错误的是 ( ) A、M 为阴离子交换膜,N为阳离子交换膜 B、X 为高浓度酸性废水,Y 为高浓度苯酚污水 C、每消耗苯酚 9.4 g,模拟海水理论上除盐163.8g D、电池工作一段时间后,正、负极产生气体的物质的量之比为7:1511. 下列实验操作不能达到实验目的的是( )
A、M 为阴离子交换膜,N为阳离子交换膜 B、X 为高浓度酸性废水,Y 为高浓度苯酚污水 C、每消耗苯酚 9.4 g,模拟海水理论上除盐163.8g D、电池工作一段时间后,正、负极产生气体的物质的量之比为7:1511. 下列实验操作不能达到实验目的的是( )实验目的
实验操作
A
配制 Na2S 溶液
将 Na2S 固体加入适量 NaOH 溶液,搅拌
B
除去MgCl2溶液中的Fe2+杂质
加入H2O2 , 再加入 MgO,搅拌、静置、过滤
C
测定 NaHCO3溶液的浓度
用标准 HCl 溶液滴定 NaHCO3溶液,用甲基橙作指示剂
D
证明2Fe3++2I-2Fe2++I2反应存在限度
将浓度均为 0.1mol/L 的硫酸铁溶液和 KI 溶液等体积混合, 充分反应后再滴加数滴 KSCN 溶液,振荡
A、A B、B C、C D、D二、多选题
-
12. 硫代硫酸钠晶体(Na2S2O3·5H2O)不溶于乙醇,可用作纸浆漂白时的脱氯剂等。用工业硫化钠(主要成分Na2S,含少量Na2SO4 )及纯碱等为原料制备Na2S2O3·5H2O的流程如下:

下列说法正确的是( )
A、Na2S2O3作脱氯剂时主要利用其还原性 B、“净化”时加入的试剂X可选用BaCl2溶液 C、“反应”过程中体系pH大小对产品产率无影响 D、提纯Na2S2O3·5H2O时,应先用水洗,再用乙醇洗涤13. 一定温度下,在2个容积均为1L的恒容密闭容器中,加入一定量的反应物,发生反应: , 相关数据见下表。容器编号
温度/℃
起始物质的量/mol
平衡物质的量/mol
Ⅰ
T1
0.2
0.2
0.1
Ⅱ
T2
0.2
0.2
0.12
下列说法错误的是( )
A、T1>T2 B、I中反应达到平衡时,CO的转化率为60% C、达到平衡所需要的时间:Ⅱ>Ⅰ D、对于I,平衡后向容器中再充入0.2 mol CO和0.2 mol CO2 , 平衡正向移动14. 25℃时,向10.00mL0.1000mol/L的NaHCO3溶液中滴加0.1000mol/L的盐酸,溶液的pH随加入的盐酸的体积V变化如图所示。下列有关说法错误的是( ) A、a点,溶液pH>7是由于水解程度大于电离程度 B、b点,c(Na+)=c()+c()+c(Cl−) C、c点,溶液中H+的主要来自的电离 D、d点,c(Na+)= c(Cl−)=0.0500mol/L
A、a点,溶液pH>7是由于水解程度大于电离程度 B、b点,c(Na+)=c()+c()+c(Cl−) C、c点,溶液中H+的主要来自的电离 D、d点,c(Na+)= c(Cl−)=0.0500mol/L三、综合题
-
15. 纳米级PbO是大规模集成电路(IC)制作过程中的关键性基础材料。一种以方铅矿(含PbS及少量Fe2O3、MgO、SiO2等)为原料制备PbO的工艺流程如图:

已知:[PbCl4]2-(aq)PbCl2(s)+2Cl-(aq) ΔH<0
回答下列问题:
(1)、“酸浸氧化”过程中被氧化的元素是: , 该过程需要加热,其目的是。FeCl3与PbS发生反应生成[PbCl4]2-的离子方程式为。(2)、检验滤液1中存在Fe2+ , 可取样后滴加少量溶液(填化学式),观察到有蓝色沉淀析出。(3)、“降温”步骤中析出的晶体主要是(填化学式);滤液2中的金属阳离子有Na+、Fe3+、。(填离子符号)(4)、要实现PbSO4转化为PbCO3 , 的最小值为。(Ksp(PbCO3)=7.4×10-14、Ksp(PbSO4)=1.6×10-8)(保留两位有效数字)(5)、“煅烧”时,PbCO3发生反应的化学方程式为。16. 蛋白质是生命的物质基础。某学习小组实验探究一种蛋白质的元素组成。(1)、I.确定该蛋白质中的某些组成元素为确定该蛋白质中含氮元素,将样品中有机氮转化成铵盐,能证明铵盐存在的实验方法是。
(2)、为确定该蛋白质中含碳、氢、硫三种元素,采用如图装置进行探究,通入氧气使样品在装置A中 充分燃烧,并使其产物依次缓缓通过其余装置。
①装置B中的试剂是。
②装置D的作用是。
③当装置B、C、E、F依次出现下列现象: , 品红溶液褪色, , 出现白色浑浊;可证明燃烧产物中含有H2O,SO2>CO2 , 结论:该蛋白质中含碳、氢、硫、氮等元素。
(3)、II.为测定该蛋白质中硫元素的质量分数,小组取蛋白质样品充分燃烧,先用足量碘水吸收二氧化硫, 再取吸收液,以淀粉为指示剂,用硫代硫酸钠溶液滴定过量的碘。已知:2+I2=+2I-写出二氧化硫与碘水反应的化学方程式:。
(4)、滴定终点的现象为。(5)、取蛋白质样品m g进行测定,采用c1 mol·L-1的碘水V1 mL进行吸收,滴定过量的碘样时消耗c2 mol·L-1硫代硫酸钠溶液V2mL。该蛋白质中的硫元素的质量分数为。(6)、若燃烧时过量氧气进入吸收液中,可能会导致该蛋白质中的硫元素的质量分数测定值(填“偏大*偏小”或“无影响”)。17. 甲醇、乙醇来源丰富、价格低廉、运输贮存方便,都是重要的化工原料,有着重要的用途和应用前景,可以用多种方法合成。(1)、I.用CO2生产甲醇、乙醇已知:H2的燃烧热为-285.8 kJ/mol,CH3OH(l)的燃烧热为-725.8kJ/mol,CH3OH(g)=CH3OH(l) △H= -37.3 kJ/mol,则CO2(g)+3H2(g)=CH3OH(g)+ H2O(1) △H=kJ/mol。
(2)、将CO2和H2按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应[生成 H2O(g)],如图1表示压强为0.1 MPa和5.0 MPa下CO2转化率随温度的变化关系。
①a、b两点化学反应速率分别用Va、Vb , 表示,则Va Vb(填“大于”、“小于”或“等于”)。
②列出a点对应的平衡常数表达式K= 。
(3)、在1.0 L恒容密闭容器中投入1 mol CO2和2.75 mol H2发生反应:CO2(g)+3H2(g) CH3OH (g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是____。A、该反应的正反应为放热反应 B、压强大小关系为p1<p2<p3 C、M点对应的平衡常数K的值约为1.04×10-2 D、在p2及512 K时,图中N点υ(正)<υ(逆)(4)、CO2催化加氢合成乙醇的反应为:2CO2(g)+6H2(g) C2H5OH(g) +3H2O(g) △H;m代表起始时的投料比,即m=
①图3中投料比相同,温度T3>T2>T1 , 则该反应的焓变△H0(填“>”、“<”)。
②m=3时,该反应达到平衡状态后p(总)=20a MPa,恒压条件下各物质的物质的量分数与温度的关系如图4所示,则曲线b代表的物质为(填化学式),T4温度时,反应达到平衡时物质d的分压p(d)=。
(5)、Ⅱ.甲醇的应用以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如图5所示。

离子交换膜a为(填“阳膜”、“阴膜”),阳极的电极反应式为。
18. 镍铜合金由60%镍、33%铜、6.5%铁三种金属组成的合金材料。镍铜合金有较好的室温力学性能和高温强度,耐蚀性高,耐磨性好,容易加工,无磁性,是制造行波管和其他电子管较好的结构材料。还可作为航空发动机的结构材料。(1)、基态铜原子的价层电子的轨道表示式为 , Cu与Fe的第二电离能分别为:ICu=1959kJ·mol-1 , IFe=1562kJ·mol-1 , 结合价层电子排布式解释Fe的第二电离能较小的原因是。(2)、向4mL0.1mol/LCuSO4溶液中滴加氨水可形成[Cu(NH3)4]SO4溶液,再向溶液中加入8mL95%的乙醇,并用玻璃棒摩擦器壁析出深蓝色晶体Cu(NH3)4]SO4·H2O。①NH3中心原子的轨道杂化类型为。NH3的沸点高于CH4的沸点,其原因是。
②简单说明加入乙醇后析出[Cu(NH3)4]SO4·H2O晶体的原因。
(3)、某镍铜合金的立方晶胞结构如图所示。
①在该晶胞中镍原子与铜原子的数量比为。
②若该晶胞的棱长为anm(1nm=1×10-7cm),ρ=g·cm-3(NA表示阿伏加德罗常数,列出计算式)。
19. 我国科学家发现化合物J对消除由蜈蚣叮咬产生的严重临床症状有良好效果。J的两条合成路线如图所示。
已知:ⅰ.R—NH2
 R—NH2(R代表烃基)
R—NH2(R代表烃基)ⅱ.—NH2易被氧化
回答下列问题:
(1)、A中官能团有:硝基和。(2)、D→E的化学方程式是。F的结构简式是。(3)、反应中 的作用。 (4)、B有多种同分异构体,写出任意一种同时满足下列条件的M的结构简式是。
的作用。 (4)、B有多种同分异构体,写出任意一种同时满足下列条件的M的结构简式是。①含有—NO2的芳香族化合物
②能发生水解反应且水解产物之一含有醛基
③苯环上一氯代物有两种
(5)、G→H的反应类型是。(6)、I→J的反应还可能有副产物,请写出其中一种的结构简式。(7)、苯胺( )和乙二酸(HOOC—COOH)为起始原料,可以制备
)和乙二酸(HOOC—COOH)为起始原料,可以制备 。选用必要的试剂完成合成路线。
。选用必要的试剂完成合成路线。