河南省新乡市2022届高三第三次模拟理科综合化学试题
试卷更新日期:2022-05-30 类型:高考模拟
一、单选题
-
1. 下列关于我国最新科技成果的化学解读错误的是( )
科技成果
化学解读
A
首次发现烷基型产甲烷的古菌,原油有望高效转化成天然气
天然气、沼气、坑气的主要成分都是CH4 , 它们都是不可再生能源
B
纳米Cu2O表面改性控制CO2电化学还原制备C2H4和合成气
其他条件相同时,接触面积越大,反应速率越快
C
利用催化剂Ni2Al3实现原生生物质大分子高选择性转化成CH4
催化剂能降低反应的活化能,提高活化分子的百分数
D
锂电池或二次电池的研究引领全球清洁能源
锂电池能将化学能转化成电能
A、A B、B C、C D、D2. 20世纪40年代,传统法合成己二酸工艺就已成熟,一直沿用至今。2020年我国科学家利用8种酶采用“一锅催化法”高效绿色合成了己二酸,其流程如图: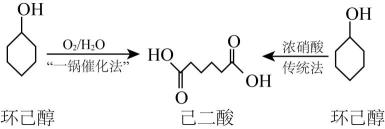
下列说法错误的是( )
A、温度越高,上述2种方法合成己二酸的速率越快 B、传统法合成己二酸会产生大气污染物,原子利用率低 C、“一锅催化法”属于绿色化学工艺 D、1mol己二酸与足量NaHCO3反应生成88gCO23. 碘仿(CHI3)是一种外用消毒剂。某实验小组通过电解KI和丙酮(CH3COCH3)来制备碘仿。制得的粗碘仿中含少量石墨粉,分离提纯碘仿的操作中,下列仪器没有用到的是( )已知几种物质的部分性质如表所示:
物质
熔点/℃
沸点/℃
溶解性
丙酮
-95
56
与水、乙醇互溶
碘仿
123
218
不溶于水,溶于热乙醇
A、 B、
B、 C、
C、 D、
D、 4. 设为阿伏加德罗常数的值。下列说法正确的是( )
4. 设为阿伏加德罗常数的值。下列说法正确的是( ) A、工业上电解制备时,产生气体的分子数为3 B、三硫化四磷( , 如图所示)中含有的极性键的数目为6 C、标准状况下,22.4L氯气与足量烧碱溶液反应,转移的电子数为2 D、与足量乙醇在一定条件下反应,生成的酯基的数目为25. 我国科学家研发出一种绿色锌碘单液流二次电池,工作原理如图所示。下列说法错误的是( )
A、工业上电解制备时,产生气体的分子数为3 B、三硫化四磷( , 如图所示)中含有的极性键的数目为6 C、标准状况下,22.4L氯气与足量烧碱溶液反应,转移的电子数为2 D、与足量乙醇在一定条件下反应,生成的酯基的数目为25. 我国科学家研发出一种绿色锌碘单液流二次电池,工作原理如图所示。下列说法错误的是( ) A、放电时,聚烯烃多孔电极上发生氧化反应 B、放电时,K+向多孔石墨电极迁移 C、充电时,阳极反应式为2I--2e-=I2 D、充电时,阴极净增65g时a区净增2mol离子6. 我国科学家开发出一种离子液体(EMIES),该物质由原子序数依次增大的短周期元素X、Y、Z、R、W组成,结构如图所示,只有Y、Z、R位于同一周期,R、W原子的最外层电子数相等。下列说法正确的是( )
A、放电时,聚烯烃多孔电极上发生氧化反应 B、放电时,K+向多孔石墨电极迁移 C、充电时,阳极反应式为2I--2e-=I2 D、充电时,阴极净增65g时a区净增2mol离子6. 我国科学家开发出一种离子液体(EMIES),该物质由原子序数依次增大的短周期元素X、Y、Z、R、W组成,结构如图所示,只有Y、Z、R位于同一周期,R、W原子的最外层电子数相等。下列说法正确的是( ) A、原子半径:Y>Z>R>W>X B、W的氧化物对应的水化物一定是强酸 C、EMIES中,Z、Y原子的最外层都达到8电子结构 D、由X、Z、R三种元素组成的化合物只有两种7. 已知:AgA、Ag2B都是难溶盐。室温下,向体积均为10mL、浓度均为0.1mol·L-1的NaA溶液、Na2B溶液中分别滴加0.1mol·L-1的AgNO3溶液,溶液中pX与AgNO3溶液体积的关系如图所示[已知:pX=—lgc(A—)或—lgc(B2—)]。下列推断错误的是( )
A、原子半径:Y>Z>R>W>X B、W的氧化物对应的水化物一定是强酸 C、EMIES中,Z、Y原子的最外层都达到8电子结构 D、由X、Z、R三种元素组成的化合物只有两种7. 已知:AgA、Ag2B都是难溶盐。室温下,向体积均为10mL、浓度均为0.1mol·L-1的NaA溶液、Na2B溶液中分别滴加0.1mol·L-1的AgNO3溶液,溶液中pX与AgNO3溶液体积的关系如图所示[已知:pX=—lgc(A—)或—lgc(B2—)]。下列推断错误的是( ) A、室温下,Ksp(Ag2B)=4×10-3a B、对应溶液中c(Ag+):e>f C、室温下,溶解度:S(AgA)<S(Ag2B) D、若c(AgNO3)变为0.05mol·L-1 , 则c点向e点移动
A、室温下,Ksp(Ag2B)=4×10-3a B、对应溶液中c(Ag+):e>f C、室温下,溶解度:S(AgA)<S(Ag2B) D、若c(AgNO3)变为0.05mol·L-1 , 则c点向e点移动二、综合题
-
8. 铂钌催化剂是甲醇燃料电池的阳极催化剂。一种以钌矿石[主要含Ru(CO3)2 , 还含少量的FeO、MgO、RuO4、CaO、SiO2]为原料制备钌(Ru)的流程如图。回答下列问题:
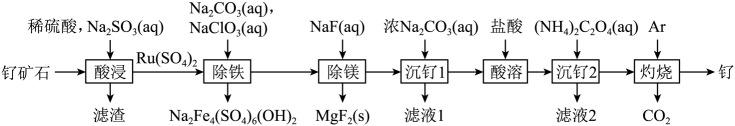 (1)、Na2Fe4(SO4)6(OH)2中Fe的化合价为。(2)、“酸浸”时,Na2SO3的作用。“滤渣”的主要成分有SiO2和(填化学式)。“酸浸”中钌的浸出率与浸出温度、pH的关系如图所示,“酸浸”的最佳条件是。
(1)、Na2Fe4(SO4)6(OH)2中Fe的化合价为。(2)、“酸浸”时,Na2SO3的作用。“滤渣”的主要成分有SiO2和(填化学式)。“酸浸”中钌的浸出率与浸出温度、pH的关系如图所示,“酸浸”的最佳条件是。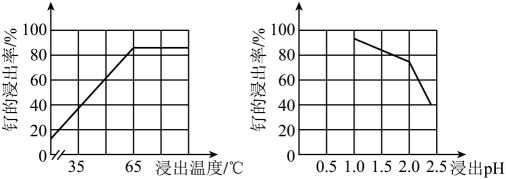 (3)、“除铁”的离子方程式为。(提示:1molNaClO3参与反应,转移6mol电子)(4)、从“滤液2”中可提取一种化肥,其电子式为。(5)、“灼烧”时Ar的作用是。(6)、某工厂用10t钌矿石[含8.84tRu(CO3)2、165kgRuO4],最终制得3636kgRu,则Ru的产率为。(保留三位有效数字)9. 苯硫酚是一种局部麻醉剂。某小组拟制备苯硫酚并探究其性质,已知相关物质的部分信息如下表所示:
(3)、“除铁”的离子方程式为。(提示:1molNaClO3参与反应,转移6mol电子)(4)、从“滤液2”中可提取一种化肥,其电子式为。(5)、“灼烧”时Ar的作用是。(6)、某工厂用10t钌矿石[含8.84tRu(CO3)2、165kgRuO4],最终制得3636kgRu,则Ru的产率为。(保留三位有效数字)9. 苯硫酚是一种局部麻醉剂。某小组拟制备苯硫酚并探究其性质,已知相关物质的部分信息如下表所示:物质
化学式
相对分子质量
熔点/
沸点/
相对密度
溶解性
苯硫酚
110
169.5
1.07
难溶于水
苯磺酰氯
176.5
14.5
251
1.38
难溶于水
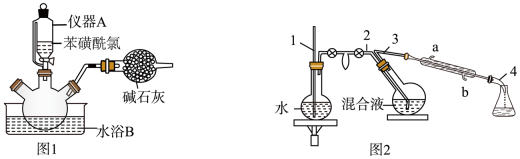
操作步骤:
①向三口烧瓶中加入冰和浓硫酸。
②再向三口烧瓶中慢慢加入苯磺酰氯,尽快地分次加入锌粉,继续反应 , 温度保持在左右,如图1。
③撤去水浴B,微热三口烧瓶,并保持一定的回流。反应平稳后,再加热。
④将反应后的混合液进行水蒸气蒸馏,分出苯硫酚,如图2。
⑤加入氯化钙,经操作X得粗品。再进行蒸馏,收集馏分,得纯品。
回答下列问题:
(1)、仪器A的名称是。(2)、已知:在水中加入盐,水的沸点会升高,凝固点会降低。水浴B应选择(填标号)。a.冰盐水浴 b.冷水浴 c.热水浴
(3)、在水蒸气蒸馏中(如图2),导管1的作用是 , 冷凝管中冷却水从(填“a”或“b”,下同)口进、口出。(4)、步骤⑤中操作X是。蒸馏时,收集馏分时温度计的读数为。(5)、本实验中,苯硫酚的产率约为(保留整数)。(6)、取少量苯硫酚产品于酸性溶液中,振荡,溶液褪色,说明苯硫酚具有(填“氧化”或“还原”)性。10. 氮氧化物治理是环境学家研究的热点之一。回答下列问题:(1)、NH3还原法。研究发现NH3还原NO的反应历程如图1。下列说法正确的是____(填标号)。
 A、Fe3+能降低总反应的活化能,提高反应速率 B、总反应为6NO+4NH3=5N2+6H2O C、该反应历程中形成了非极性键和极性键(2)、已知有关反应如下:
A、Fe3+能降低总反应的活化能,提高反应速率 B、总反应为6NO+4NH3=5N2+6H2O C、该反应历程中形成了非极性键和极性键(2)、已知有关反应如下:①C(s)+O2(g)=CO2(g) ΔH1=-393.5kJ·mol-1
②CO2(g)+C(s)=2CO(g) ΔH2=+172.5kJ·mol-1
③NO和CO反应的能量变化如图2所示。

2NO(g)=N2(g)+O2(g) ΔH=kJ·mol-1。
(3)、H2还原法。已知催化剂Rh表面H2催化还原NO的反应机理如表所示,其他条件一定时,决定H2的催化还原NO反应速率的基元反应为(填序号)。
序号
基元反应
活化能Ea/(kJ·mol-1)
①
H2(g)+Rh(s)+Rh(s)=H(s)+H(s)
12.6
②
2NO(g)+Rh(s)=2NO(s)
0.0
③
NO(s)+Rh(s)=N(s)+O(s)
97.5
④
H(s)+O(s)=OH(s)+Rh(s)
83.7
⑤
HO(s)+H(s)=H2O(s)+Rh(s)
33.5
⑥
H2O(s)=H2O(g)+Rh(s)
45.0
⑦
N(s)+N(s)=N2(s)+Rh(s)+Rh(s)
120.9
注明:N2(s)表示N2被吸附在Rh表面上。
(4)、CO还原法。一定温度下,在刚性密闭容器中充入1molNO(g)和1molCO(g)发生反应:2NO(g)+2CO(g)N2(g)+2CO2(g)。达到平衡后,再充入amolNO(g)和amolCO(g),NO的平衡转化率(“增大”、“减小”或“不变”,下同),气体总压强。
(5)、甲烷还原法。一定温度下,在2.0L刚性密闭容器中充入1molCH4和2molNO2 , 发生反应:CH4(g)+2NO2(g)CO2(g)+N2(g)+2H2O(g)。测得反应时间(t)与容器内气体总压强(p)的变化如表所示。
反应时间(t)/min
0
2
4
6
8
10
p/(100kPa)
4.80
5.44
5.76
5.92
6.00
6.00
达到平衡时,NO2的转化率为。若起始时加入3molCH4和2molNO2 , 则在该温度下的压强平衡常数Kp=(以分压表示的平衡常数为Kp , 分压=总压×物质的量分数)kPa。
(6)、电解氧化吸收法。电解0.1mol·L-1的NaCl溶液时,溶液中相关成分的质量浓度与电流强度的变化关系如图3。当电流强度为4A时,吸收NO的主要反应的离子方程式为(NO最终转化为NO) 11. 我国科学家构建了新型催化剂“纳米片”(Co-N-C),该“纳米片“可用于氧化SO和吸附Hg2+。回答下列问题:(1)、基态Co原子的价层电子排布式为 , N、C、Co中第一电离能最大的是(填元素符号)。(2)、在空气中SO会被氧化成SO。SO的空间构型是 , SO中S原子采用杂化。(3)、[Co(NH3)4(H2O)Cl]Cl2是钴的一种配合物,含1mol[Co(NH3)4(H2O)Cl]Cl2的溶液与足量AgNO3溶液能生成molAgCl,[Co(NH3)4(H2O)Cl]Cl2中Co2+的配位数为。(4)、氰气[(CN)2]称为拟卤素,它的分子中每个原子最外层都达到8电子结构,则(CN)2分子中σ键、π键个数之比为。(5)、氮和碳组成的一种新型材料,硬度超过金刚石,其部分结构如图1所示。它的化学式为 , 它的硬度超过金刚石的主要原因是。
11. 我国科学家构建了新型催化剂“纳米片”(Co-N-C),该“纳米片“可用于氧化SO和吸附Hg2+。回答下列问题:(1)、基态Co原子的价层电子排布式为 , N、C、Co中第一电离能最大的是(填元素符号)。(2)、在空气中SO会被氧化成SO。SO的空间构型是 , SO中S原子采用杂化。(3)、[Co(NH3)4(H2O)Cl]Cl2是钴的一种配合物,含1mol[Co(NH3)4(H2O)Cl]Cl2的溶液与足量AgNO3溶液能生成molAgCl,[Co(NH3)4(H2O)Cl]Cl2中Co2+的配位数为。(4)、氰气[(CN)2]称为拟卤素,它的分子中每个原子最外层都达到8电子结构,则(CN)2分子中σ键、π键个数之比为。(5)、氮和碳组成的一种新型材料,硬度超过金刚石,其部分结构如图1所示。它的化学式为 , 它的硬度超过金刚石的主要原因是。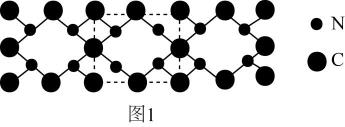 (6)、氮化镓是新型半导体材料,其晶胞结构可看作金刚石晶胞内部的碳原子被N原子代替,顶点和面心的碳原子被Ga原子代替。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。图2为沿y轴投影的氮化镓晶胞中所有原子的分布图。若原子1的原子分数坐标为( , , ),则原子3的原子分数坐标为。若氮化馆的晶体密度为ρg·cm-3 , 则晶胞中Ga-N键的键长为(用含ρ、NA的代数式表示)pm。已知NA为阿伏加德罗常数的值。
(6)、氮化镓是新型半导体材料,其晶胞结构可看作金刚石晶胞内部的碳原子被N原子代替,顶点和面心的碳原子被Ga原子代替。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。图2为沿y轴投影的氮化镓晶胞中所有原子的分布图。若原子1的原子分数坐标为( , , ),则原子3的原子分数坐标为。若氮化馆的晶体密度为ρg·cm-3 , 则晶胞中Ga-N键的键长为(用含ρ、NA的代数式表示)pm。已知NA为阿伏加德罗常数的值。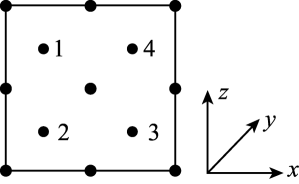
图2
12. 以芳香族化合物A为原料制备某药物中间体G的路线如图: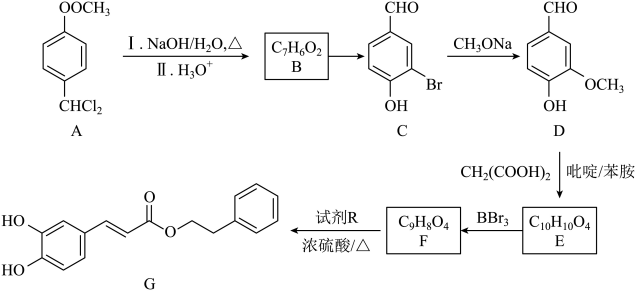
已知:①同一碳原子上连两个羟基时不稳定,易发生反应:RCH(OH)2→RCHO+H2O。
②R1CHO+R2CH2COOHR1CH=CHR2+CO2↑+H2O。
③
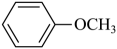
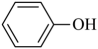
请回答下列问题:
(1)、G中含氧官能团的名称为。(2)、C→D的反应类型是 , C的分子式为。(3)、E的结构简式为。(4)、F→G的化学方程式为。(5)、H是D的同分异构体,同时满足下列条件的H有种(不包括立体异构)。①遇氯化铁溶液发生显色反应;
②能发生水解反应;
③苯环上只有两个取代基。
其中,核磁共振氢谱显示4组峰,且峰的面积之比为3:2:2:1的结构简式为(写一种即可)。
(6)、根据上述路线中的相关知识,设计以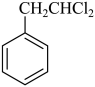 和乙酸为原料制备
和乙酸为原料制备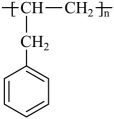 的合成路线。(无机试剂任选)
的合成路线。(无机试剂任选)