河南省商丘市2022届高三下学期第三次模拟考试化学试题
试卷更新日期:2022-05-30 类型:高考模拟
一、单选题
-
1. 化学与生产、生活密切相关。下列说法正确的是( )A、焊接金属时,焊接点可用NH4Cl溶液进行预处理 B、环保PVC(聚氯乙烯)可以制作食品包装袋、食品保鲜膜 C、烟熏腊肉中含有丰富的脂肪,脂肪属于天然高分子化合物 D、工业上,常用氯气处理水中的Cu2+、Hg2+等重金属离子2. 下列气体去除杂质的方法中,达不到实验目的的是( )
选项
气体(杂质)
方法
A
Cl2(HCl)
通过饱和的食盐水
B
N2(O2)
通过足量灼热的铜丝网
C
SO2(CO2)
通过饱和的碳酸氢钠溶液
D
NH3(H2O)
通过盛有碱石灰的干燥管
A、A B、B C、C D、D3. 下列过程中的化学反应,相应的离子方程式正确的是( )A、FeCl3溶液腐蚀印刷电路板上的铜:Fe3++Cu=Fe2++Cu2+ B、将Al2(SO4)3溶液与Na2CO3溶液混合:2Al3++3CO=Al2(CO3)3 C、用稀HNO3溶解FeS固体:FeS+2H+=Fe2++H2S↑ D、向Mg(OH)2悬浊液中滴加NH4Cl溶液,沉淀逐渐解:Mg(OH)2 +2NH=Mg2++2NH3•H2O4. 长时间看电子显示屏幕,会对眼睛有一定的伤害。人眼的视色素中含有视黄醛,而与视黄醛结构相似的维生素A常作为保健药物。下列有关叙述正确的是( ) A、视黄醛的分子式为C20H26O B、视黄醛与乙醛(CH3CHO)互为同系物 C、一定条件下,维生素A可被氧化生成视黄醛 D、视黄醛和维生素A互为同分异构体5. 某化合物可用作发酵助剂,结构如图所示。图中X、Y、Z、W为元素周期表中前20号元素,且位于不同周期,它们的原子序数依次增大,其中Y为地壳中含量最高的元素。下列有关说法正确的是( )
A、视黄醛的分子式为C20H26O B、视黄醛与乙醛(CH3CHO)互为同系物 C、一定条件下,维生素A可被氧化生成视黄醛 D、视黄醛和维生素A互为同分异构体5. 某化合物可用作发酵助剂,结构如图所示。图中X、Y、Z、W为元素周期表中前20号元素,且位于不同周期,它们的原子序数依次增大,其中Y为地壳中含量最高的元素。下列有关说法正确的是( ) A、该化合物中除X外,其他原子最外层不一定均为8 B、Z元素形成的单质均为白色固体 C、X分别与Y、Z、W形成的简单化合物中均含有共价键 D、Z的最高价氧化物的水化物的酸性强于硫酸6. 某科研团队研制了一种基于阳离子型活性分子的中性水系有机液流电池,以[Pyr-TEMPO]和[Pyr-PV]Cl4作中性水系有机液流电池的电极材料,已知放电时[Pyr-PV]2+先转化为[Pyr-PV]3+ , 后转化为[Pyr-PV]4+ , 电池工作原理如图所示。下列说法正确的是( )
A、该化合物中除X外,其他原子最外层不一定均为8 B、Z元素形成的单质均为白色固体 C、X分别与Y、Z、W形成的简单化合物中均含有共价键 D、Z的最高价氧化物的水化物的酸性强于硫酸6. 某科研团队研制了一种基于阳离子型活性分子的中性水系有机液流电池,以[Pyr-TEMPO]和[Pyr-PV]Cl4作中性水系有机液流电池的电极材料,已知放电时[Pyr-PV]2+先转化为[Pyr-PV]3+ , 后转化为[Pyr-PV]4+ , 电池工作原理如图所示。下列说法正确的是( ) A、放电的过程中,氯离子由b电极向a电极移动 B、放电时,负极的电极反应之一为[Pyr-PV]3+-=[Pyr-PV]4+ C、a电极的电势比b电极的低 D、充电时,b电极为阳极,发生氧化反应7. 用0.10的NaOH溶液分别滴定20.00mL浓度为c1的醋酸、c2的草酸(H2C2O4)溶液,得到如图滴定曲线,其中c、d为两种酸恰好完全中和的化学计量点。下列说法错误的是( )
A、放电的过程中,氯离子由b电极向a电极移动 B、放电时,负极的电极反应之一为[Pyr-PV]3+-=[Pyr-PV]4+ C、a电极的电势比b电极的低 D、充电时,b电极为阳极,发生氧化反应7. 用0.10的NaOH溶液分别滴定20.00mL浓度为c1的醋酸、c2的草酸(H2C2O4)溶液,得到如图滴定曲线,其中c、d为两种酸恰好完全中和的化学计量点。下列说法错误的是( ) A、由滴定曲线可判断:c1>c2 B、滴定过程中始终有n(CH3COOH)=0.02c1+n(OH-)-n(H+)-n(Na+) C、若a点V(NaOH)=7.95 mL,则a点有c(Na+)>c(C2O)>c(HC2O)>c(H2C2O4) D、若b点时溶液中c(CHCOO-)=c(CHCOOH),则b点消耗了8.60mL的NaOH溶液
A、由滴定曲线可判断:c1>c2 B、滴定过程中始终有n(CH3COOH)=0.02c1+n(OH-)-n(H+)-n(Na+) C、若a点V(NaOH)=7.95 mL,则a点有c(Na+)>c(C2O)>c(HC2O)>c(H2C2O4) D、若b点时溶液中c(CHCOO-)=c(CHCOOH),则b点消耗了8.60mL的NaOH溶液二、综合题
-
8. 三氧化二砷(As2O3)可用于治疗急性早幼粒细胞白血病。利用某酸性含砷废水(含H3AsO3、H2SO4)可提取As2O3 , 提取工艺流程如下:

已知:①As2O3为酸性氧化物;②As2S3易溶于过量的Na2S溶液中,故加入FeSO4 , 的目的是除去过量的S2-。
回答下列问题:
(1)、废水中H3AsO3中砷元素的化合价为(2)、“焙烧”操作中,As2S3参与反应的化学方程式为(3)、“碱浸”的目的 , “滤渣Y”的主要成分是。(写化学式)。(4)、“氧化”操作的目的是(用离子方程式表示)。(5)、“还原”过程中H3AsO4转化为H3AsO3然后将“还原”后溶液加热,H3AsO3分解为As2O3。某次“还原”过程中制得了1.98kgAs2O3 , 则消耗标准状况下气体X的体积是L。(6)、砷酸钠(Na3AsO4)可用于可逆电池,装置如图1所示,其反应原理为AsO+2H++2I-=AsO+I2+H2O。探究pH对AsO氧化性的影响,测得输出电压与pH的关系如图2所示。则a点时,盐桥中K+(填“向左”“向右”或“不”)移动,c点时,负极的电极反应为。 9. 六氨合氯化镁(MgCl2•6NH3)具有极好的可逆吸、放氨特性,是一种优良的储氨材料。某研究小组以MgCl2•6H2O为原料在实验室制备MgCl2•6NH3 , 并测定所得产品中氯的含量(1)、 (一)制备MgCl2•6NH3
9. 六氨合氯化镁(MgCl2•6NH3)具有极好的可逆吸、放氨特性,是一种优良的储氨材料。某研究小组以MgCl2•6H2O为原料在实验室制备MgCl2•6NH3 , 并测定所得产品中氯的含量(1)、 (一)制备MgCl2•6NH3I.首先制备无水MgCl2实验装置如下图(加热及夹持装置略去):

已知:SOCl2:熔点105℃、沸点76℃;遇水剧烈水解生成两种酸性气体。
滴液漏斗中支管的作用为。
(2)、三颈瓶中发生反应的化学方程式为。(3)、该实验装置中的不足之处为。(4)、II.将NH3通入无水MgCl2的乙二醇溶液中,充分反应()后,过滤、洗涤并自然风干,制得粗品。相关物质的性质如表:
NH3
MgCl2
MgCl2•NH3
水
易溶
易溶
易溶
甲醇(沸点65℃)
易溶
易溶
难溶
乙二醇(沸点197℃)
易溶
易溶
难溶
生成MgCl2•6NH3的反应需在冰水浴中进行,其可能原因有____(填字母)。
A、反应吸热,促进反应正向进行 B、加快反应速率 C、防止氨气挥发,提高氨气利用率 D、降低产物的溶解度(5)、洗涤产品时,应选择的洗涤剂为____(填字母)。A、冰浓氨水 B、乙二醇和水的混合液 C、氨气饱和的甲醇溶液 D、氨气饱和的乙二醇溶液(6)、(二)测定产品中氯的含量,步骤如下:步骤1:称取1.80g样品,加入足量稀硝酸溶解,配成250mL溶液;
步骤2:取25.00mL待测液于锥形瓶中,以K2CrO4为指示剂,用0.20的AgNO3标准液滴定溶液中 , 记录消耗标准液的体积;
步骤3:重复步骤2操作2~3次,平均消耗标准液10.00 mL。
步骒1中,用稀硝酸溶解样品的目的为。
(7)、该品中氯的质量分数为(保留小数点后2位);该实验值与理论值(36.04%)有偏差,造成该偏差的可能原因是(已知滴定操作均正确)。10. 环保是当今社会最重要的课题,故研究CO、NOx、SO2等大气污染物的妥善处理具有重义。回答下列问题(1)、已知在298K和101kPa条件下,有如下反应①C(s) +O2(g) = CO2(g) △H1=-393.5kJ/mol;②N2(g) +O2(g)=2NO(g) △H2=+180.5kJ/mol。则反应C(s) +2NO(g)= CO2(g)+N2(g)的△H=kJ/mol(2)、利用I2O5可消除CO污染,其反应为I2O5(s) + 5CO(g)=5CO(g)+I2(s)。不同温度下,向装有足量I2O5固体的容闭容器中通入2molCO,测得CO2气体体积分数φ(CO2)随时间t的变化曲线如图1所示。
①T1时,前0.5 min内平均反应速率v(CO)=
②b点和d点的化学平衡常数:Kb (填“>”“<”或“=”)Kd。
③b点时,CO的转化率为。
④下列能说明反应达到平衡的是(填字母)。
A.容器内压强不再变化
B.CO的质量不再变化,CO2的转化率不再增大
C.CO2的生成速率等于CO的消耗速率
D.混合气体的平均相对分子质量不再改变
(3)、用NaClO碱性溶液吸收SO2。工业上控制在40℃~50℃时,将含有SO2的烟气和NaClO碱性溶液按图2所示方式通入反应釜。
①反应釜发生的反应中,SO2表现出。
②反应釜中采用“气—液逆流”接触吸收法的优点是。
③工业上常加Ni2O3作催化剂,催化过程如图3所示。在催化过程中,反应产生的四价镍和氧原子具有强氧化能力,能加快吸收速度。试写出过程2的反应方程式:
11. CIGS靶材是一种主要含铜、铟(In)、镓(Ga)、硒(Se)的合金由于其良好的电学传导和光学透明性被广泛用于薄膜太阳能电池领域。回答下列问题:(1)、基态Ga的核外电子排布为[Ar]3d104s24p1 , 转化为下列激发态时所需能量最少的是____(填字母)。A、 B、
B、 C、
C、 D、
D、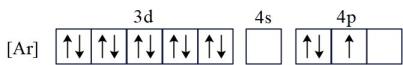 (2)、硫酸铜分别和氨水、EDTA[(HOOCCH2)2NCH2CH2N(CH2COOH)2]可形成配合物[Cu(NH3)4(H2O)2]SO4、[Cu(EDTA)]SO4。
(2)、硫酸铜分别和氨水、EDTA[(HOOCCH2)2NCH2CH2N(CH2COOH)2]可形成配合物[Cu(NH3)4(H2O)2]SO4、[Cu(EDTA)]SO4。①的空间构型为 ,EDTA中碳原子杂化方式为 。
②C、N、O、S四种元素中,第一电离能最大的是。
③在[Cu(NH3)4(H2O)₂]SO4化合物中,阳离子呈轴向狭长的八面体结构 (如图),该阳离子中存在的化学键类型 , 该化合物加热时首先失去的组分是。
 (3)、人体代谢甲硒醇(CH3SeH)后可增加抗癌活性,下表中有机物沸点不同的原因。
(3)、人体代谢甲硒醇(CH3SeH)后可增加抗癌活性,下表中有机物沸点不同的原因。有机物
甲醇
甲硫醇(CH3SH)
甲硒醇
沸点/℃
64.7
5.95
25.05
(4)、四方晶系CuInSe2的晶胞结构如图所示,晶胞参数为a=b=m pm,c=2m pm,晶胞棱边夹角均为90°。设阿伏加德罗常数的值为NA , CuInSe2的相对质量为M,则该晶体密度ρ=g•cm-3 (用含有m、M和NA的代数式表示)。该晶胞中,原子坐标分别为2号Cu原子(0,0.5,0.25),3号In原子(0,0.5,0.75),4号Se原子(0.75,0.75,0.125)。则1号Se原子的坐标为 , 晶体中与单个In键合的Se有个。 12. 一种活性物质H可通过以下路线合成。
12. 一种活性物质H可通过以下路线合成。
已知:
 (Z=-COOR,-COOH等)
(Z=-COOR,-COOH等)回答下列问题:
(1)、M所含官能团的名称为 , 在核磁共振氢谱中B有组吸收峰。(2)、CD的化学方程式为 , 反应类型为。(3)、FG的反应中有副产物X(分子式为C14H14O3)生成,写出X的结构简式:。(4)、A与乙醇在一定条件下生成N(C6H10O),N的同分异构体中能同时满足以下三个条件的有种(不考虑立体异构体)。①含有两个甲基;②含有酮羰基(但不含C=C=O);③不含有环状结构。
(5)、照上述信息,设计由 和
和 为原料,制备
为原料,制备 的合成路线(无机试剂和不超过2个碳的有机试剂任选):。
的合成路线(无机试剂和不超过2个碳的有机试剂任选):。