辽宁省沈阳市和平区2022年中考一模化学试题
试卷更新日期:2022-05-27 类型:中考模拟
一、单选题
-
1. 下列过程中不涉及化学变化的是( )A、米酒变酸 B、芦苇编席 C、釜底抽薪 D、烧制玻璃2. 沈阳位于东北的核心地带,周边物产丰富,下列物产中富含蛋白质的是( )A、法库叶茂台苹果 B、康平大米 C、新民血肠 D、辽中莲藕3. 可回收垃圾桶外侧标注有如下可回收的垃圾,其成分属于合成材料的是( )A、塑料器材 B、废旧纸张 C、破碎玻璃 D、金属残片4. 总结归纳是重要的学习方法。下列是某同学总结的部分内容,其中正确的是( )A、白色沉淀:AgCl、CaCO3、Cu(OH)2 B、干燥剂:浓硫酸、NaOH固体、熟石灰 C、可再生能源:石油、酒精、沼气 D、人体微量元素:铁、锌、硒、碘等5. 人类在经济的发展过程中,走了一段肆意发展工业,而罔顾环境影响的弯路。现在人们进行了反思,当政者提出了有远见的发展理念—绿水青山就是金山银山。下列物质的大量排放不违背该理念的是( )A、氮气 B、二氧化硫 C、固体粉尘 D、工业废水6. 下列做法或推理不合理的是( )A、森林着火,可在火场附近砍掉草木建立隔离带,阻止火势蔓延 B、煤大块不好燃烧,先敲碎,再做成蜂窝状饼块 C、可用肥皂水区别硬水和软水 D、家中遇到煤气泄漏,立即开灯检查7. 室内空气污染已经成为威胁人们健康的“隐形杀手”。下面说法错误的是( )A、新装修的房间里闻到刺激性气味,说明分子在不断运动 B、竹炭、活性炭可以用来吸附甲醛,说明原子可以保持化学性质 C、不同的有害成分对人体的影响也不同,说明分子不同化学性质也不同 D、夏天刚装修的房子气味比冬天大,说明温度越高分子运动越快8. 下列操作错误的是( )A、
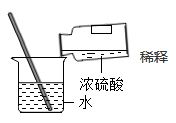 稀释
B、
稀释
B、 取药
C、
取药
C、 称量
D、
称量
D、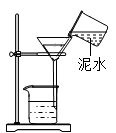 过滤
9. 下列除杂试剂错误的是( )A、氮气中氧气(碳) B、铜粉中氧化铜(一氧化碳) C、碳酸钙中的氯化钙(水) D、氯化钠溶液中的硫酸铜(氢氧化钡)10. 下列各组物质的鉴别方法错误的是( )A、鉴别氯化铵和磷矿粉—加水溶解 B、鉴别黄金和黄铜—观察颜色 C、鉴别棉线与羊毛线—点燃 D、鉴别O2和CO2—伸入燃着的木条11. 在pH=1的溶液中能大量共存,并且溶液为无色透明的离子组是( )A、 B、 C、 D、12. 甲、乙、丙有如图所示的转化关系(“一”表示相连的物质之间可以发生反应,“→”表示反应一步实现,部分物质和反应条件已略去,固液反应可以搅拌),下列各组物质按甲、乙、丙的顺序不符合要求的是( )
过滤
9. 下列除杂试剂错误的是( )A、氮气中氧气(碳) B、铜粉中氧化铜(一氧化碳) C、碳酸钙中的氯化钙(水) D、氯化钠溶液中的硫酸铜(氢氧化钡)10. 下列各组物质的鉴别方法错误的是( )A、鉴别氯化铵和磷矿粉—加水溶解 B、鉴别黄金和黄铜—观察颜色 C、鉴别棉线与羊毛线—点燃 D、鉴别O2和CO2—伸入燃着的木条11. 在pH=1的溶液中能大量共存,并且溶液为无色透明的离子组是( )A、 B、 C、 D、12. 甲、乙、丙有如图所示的转化关系(“一”表示相连的物质之间可以发生反应,“→”表示反应一步实现,部分物质和反应条件已略去,固液反应可以搅拌),下列各组物质按甲、乙、丙的顺序不符合要求的是( ) A、C、CO、O2 B、Mg、MgCl2、ZnSO4 C、Ca(OH)2、CaCl2、Na2CO3 D、BaCl2、BaCO3、H2SO413. 下图是 A、B、C 三种物质的溶解度曲线。下列说法错误的是( )
A、C、CO、O2 B、Mg、MgCl2、ZnSO4 C、Ca(OH)2、CaCl2、Na2CO3 D、BaCl2、BaCO3、H2SO413. 下图是 A、B、C 三种物质的溶解度曲线。下列说法错误的是( ) A、在 t1℃时,A 物质的溶解度小于 B 物质的溶解度 B、在 t1℃时,30gA 物质加入 50g 水中不断搅拌,形成的溶液质量为 65g C、将 t1℃时,A,B,C 三种物质的饱和溶液升温到 t2℃,则三种溶液的溶质质量分数大小关系 A=B>C D、在 t2℃时,A,B 两物质的溶解度相等
A、在 t1℃时,A 物质的溶解度小于 B 物质的溶解度 B、在 t1℃时,30gA 物质加入 50g 水中不断搅拌,形成的溶液质量为 65g C、将 t1℃时,A,B,C 三种物质的饱和溶液升温到 t2℃,则三种溶液的溶质质量分数大小关系 A=B>C D、在 t2℃时,A,B 两物质的溶解度相等二、填空题
-
14. “见著知微”是化学学习者应该具备的基本素养。也是学习化学的重要思想方法。
资料一:

资料二:氟及其化合物常运用于原子弹制造、航天工业等领域。氟气(F2)化学性质极其活泼,氟气能在水中剧烈反应,且产生氧气。
结合以上信息,回答下列问题:
(1)、氮原子核外有个电子层,图1中x= , 在氟元素形成的化合物中,氟元素通常显价。(2)、图2是水与氟气反应的微观示意图。图2方框内应填图3中的选项,选择此选项的理由是。
 (3)、作为航天大国,我国自主研发的运载火箭型号众多。某型火箭曾采用N2H4和H2O2作为火箭推进剂,N2H4和H2O2在点燃条件下生成一种常温下为液态的氧化物和一种单质,反应的化学方程式为 , 该反应是(填“放热”或“吸热”)反应。15. 图一、图二是某兴趣小组探究金属、酸的化学性质时所做的两组实验。实验结束后,将两组实验试管中的物质分别全部倒入甲、乙两个洁净的烧杯中,据图回答:
(3)、作为航天大国,我国自主研发的运载火箭型号众多。某型火箭曾采用N2H4和H2O2作为火箭推进剂,N2H4和H2O2在点燃条件下生成一种常温下为液态的氧化物和一种单质,反应的化学方程式为 , 该反应是(填“放热”或“吸热”)反应。15. 图一、图二是某兴趣小组探究金属、酸的化学性质时所做的两组实验。实验结束后,将两组实验试管中的物质分别全部倒入甲、乙两个洁净的烧杯中,据图回答:
 (1)、在图一所示的实验中,试管②中发生反应的化学方程式是。(2)、甲烧杯中的物质完全反应后,发现红色固体物质明显增多。下列说法正确的是____(填序号)。A、试管②反应后的固体中一定不含铁 B、完全反应后,甲烧杯中的固体一定含有铁 C、完全反应后,甲烧杯的溶液中可能含有Cu2+ D、完全反应后,甲烧杯的溶液中一定含有Mg2+、Fe2+(3)、乙烧杯中的物质充分反应后,仅观察到有白色沉淀,无其他现象。则试管④反应后的溶液中的溶质共有哪些(写化学式)(4)、将乙烧杯内的物质进行过滤,对所得滤液中溶质成分进行了如下探究:
(1)、在图一所示的实验中,试管②中发生反应的化学方程式是。(2)、甲烧杯中的物质完全反应后,发现红色固体物质明显增多。下列说法正确的是____(填序号)。A、试管②反应后的固体中一定不含铁 B、完全反应后,甲烧杯中的固体一定含有铁 C、完全反应后,甲烧杯的溶液中可能含有Cu2+ D、完全反应后,甲烧杯的溶液中一定含有Mg2+、Fe2+(3)、乙烧杯中的物质充分反应后,仅观察到有白色沉淀,无其他现象。则试管④反应后的溶液中的溶质共有哪些(写化学式)(4)、将乙烧杯内的物质进行过滤,对所得滤液中溶质成分进行了如下探究:实验操作
实验现象
实验结论
步骤1:取少量滤液于试管中,向其中滴加足量硝酸钡溶液
有白色沉淀生成
①生成的白色沉淀是(写化学式,下同)
步骤2:静置,向上层清液中滴加无色酚酞试液
溶液变红
②滤液中的溶质共有那些:。
(5)、在上述(4)的实验探究中、步骤1中加入足量硝酸钡溶液的目的是。16. 请根据所学的化学知识计算填空:(1)、已知酒精[乙醇(C2H5OH)]与水的混合物中,该混合物中乙醇分子与水分子的个数比1:3,则该混合物中乙醇的质量分数为。(2)、有一包FeSO4和Fe2(SO4)3的固体混合物,已测得硫元素质量分数为23%,则混合物中铁元素的质量分数为。三、综合题
-
17. 某同学设计的工业制备氢氧化钠的流程如图。

资料: ,两电极,一端得到NaOH和H2 , 另一端得到Cl2。
(1)、晾晒海水得到粗盐的原理是。(2)、实验室蒸发用到的仪器有铁架台(带铁圈)、坩埚钳、酒精灯、蒸发皿和。(3)、工业生产中应选择途径(“①”或“②”),理由是。(4)、Cl2可用于生产84消毒液,反应原理为 ,你认为上述反应中可能成为84消毒液的有效成分的是。(5)、电解水的实验可测定水的组成,不能加入NaCl增强水的导电性的理由是。电解水的化学方程式为。18. 某年5月某日,人民日报报道:中国科技大学曾杰教授研究团队发现新型催化剂,把CO2与H2高效转化为清洁液体燃料甲醇,实现了“人工碳循环”,如图为某科研小组设计的利用化学链燃烧产生的高浓度CO2制备甲醇的流程图,据图回答: (1)、图1是利用镍(Ni)进行化学链燃烧的流程图。与传统的燃料燃烧方式相比,化学链燃绕排放的CO2浓度高,易于收集。
(1)、图1是利用镍(Ni)进行化学链燃烧的流程图。与传统的燃料燃烧方式相比,化学链燃绕排放的CO2浓度高,易于收集。①空气反应器中,金属镍与氧气在一定条件下燃烧生成氧化镍(NiO);燃料反应器中发生的部分化学反应如下:
Ⅰ. Ⅱ.
其中属于置换反应的是(填“Ⅰ”或“Ⅱ”),反应Ⅱ属于高中所学的氧化还原反应,其中化合价降低的情况是。
②与CO、H2直接在空气中燃烧相比,化学链燃烧排放出的CO2浓度更高,其中的原因是。
(2)、图2是利用高浓度CO2制取甲醇的流程图:吸收池内,饱和碳酸钠溶液吸收高浓度CO2生成碳酸氢钠;分解池内,碳酸氢钠受热分解放出CO2;合成塔内,利用新型催化剂,CO2与H2反应生成甲醇(CH4O)与水。①吸收池内生成碳酸氢钠的化学方程式是。
②合成塔内生成甲醇的化学反应中,参加反应的H2与CO2的质量比是。该反应中,原料H2的最理想产生来源是。如果将来H2的制取技术取得突破。“CO2与H2反应高效变甲醇”这一世界领先的研究成果的正面意义是(答出一条即可)。
19. 某兴趣小组准备通过测量锌与稀硫酸反应产生的氢气,来测定稀硫酸中溶质的质量分数,装置如下:

 (1)、小明同学选用如图1所示装置进行实验,你认为D装置的位置和作用是:。(2)、小明若用图2装置收集氢气,应选择集气装置(填“A”或“B”),为保证测量结果的准确性,收集气体的最佳时机是(填序号)。
(1)、小明同学选用如图1所示装置进行实验,你认为D装置的位置和作用是:。(2)、小明若用图2装置收集氢气,应选择集气装置(填“A”或“B”),为保证测量结果的准确性,收集气体的最佳时机是(填序号)。a.导管口还没有气泡产生时
b.导管口连续均匀冒出气泡时
c.导管口冒出气泡很多时
(3)、小张同学用如图3所示装置进行了实验:Ⅰ.下列能说明装置气密性良好的是。
A.连接仪器后,向水准管中注水,直至左右两边管内形成稳定高度差
B.向水准管内注水,连接好左侧装置,抬高水准管,左右两边液面始终相平
Ⅱ.反应完毕后,每间隔1分钟读取气体体积、气体体积逐渐减小,直至体积不变。气体体积逐新减小的原因是(排除仪器和实验操作的影响因素)。
Ⅲ.若实验中测得稀硫酸的溶质质量分数偏大,下列可能的原因是。
a.装置漏气
b.读取数据时水准管的水面高于量气管的水面
c.未待冷却就读取量气管读数
20. 用如图所示装置进行实验: (1)、丙装置作用。(2)、如乙中澄清石灰水变浑浊,甲中发生反应的化学方程式为。(3)、探究反应后甲中黑色固体成分(本处不考虑生成黑色固体氧化亚铁的情况)。
(1)、丙装置作用。(2)、如乙中澄清石灰水变浑浊,甲中发生反应的化学方程式为。(3)、探究反应后甲中黑色固体成分(本处不考虑生成黑色固体氧化亚铁的情况)。已知:Fe3O4不与CuSO4反应。
猜想一:黑色固体成分为Fe;猜想二:黑色固体成分为Fe3O4;猜想三:。
步骤一:
加热/s
通入CO/s
样品
90
30
A
90
90
B
180
90
C
步骤二:向样品A、B、C中分别加入足量CuSO4溶液
样品
现象
结论
A
无明显现象
猜想正确
B
有红色固体析出,有少量黑色固体剩余
猜想正确
C
, 无黑色固体剩余
猜想正确
若通入CO时间为90s,要得到纯铁粉,则加热时间。