江苏省连云港市东海县2022年中考二模化学试题
试卷更新日期:2022-05-27 类型:中考模拟
一、单选题
-
1. 抗击新冠肺炎疫情离不开化学知识和技术。下列说法错误的是( )A、高温消毒餐具,使病毒在高温下失去活性 B、使用医用酒精消毒要远离火源,因为酒精有可燃性 C、将酒精加工成免洗消毒凝胶,使酒精分子停止运动而不挥发 D、测定新冠病毒的组成和结构,有助于研发治疗新冠肺炎的药物2. 下列O2的性质中,属于化学性质的是( )A、能支持燃烧 B、不易溶于水 C、无色气体 D、密度比空气略大3. 下列有关稀释浓硫酸及硫酸性质实验的原理和操作,正确的是( )A、稀释浓硫酸
 B、测稀硫酸pH
B、测稀硫酸pH 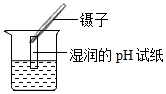 C、倾倒稀硫酸
C、倾倒稀硫酸  D、滴加稀硫酸
D、滴加稀硫酸 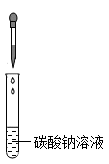 4. 制作景泰蓝的釉料中常含钴元素。钴元素在元素周期表中的信息如图。下列有关钴元素的说法错误的是( )
4. 制作景泰蓝的釉料中常含钴元素。钴元素在元素周期表中的信息如图。下列有关钴元素的说法错误的是( ) A、相对原子质量为58.93g B、元素符号是Co C、属于金属元素 D、原子核外电子数是275. 反应 可用于金属除锈。下列表示相关微粒的化学用语正确的是( )A、Fe2O3中铁元素的化合价: B、FeCl3名称:氯化亚铁 C、“3H2O”可表示3个水分子 D、Cl-的结构示意图:
A、相对原子质量为58.93g B、元素符号是Co C、属于金属元素 D、原子核外电子数是275. 反应 可用于金属除锈。下列表示相关微粒的化学用语正确的是( )A、Fe2O3中铁元素的化合价: B、FeCl3名称:氯化亚铁 C、“3H2O”可表示3个水分子 D、Cl-的结构示意图: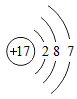 6. 柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂。下列有关柠檬酸亚铁的说法正确的是( )A、由5种元素组成 B、所含元素均属人体必需的微量元素 C、Fe元素的质量分数约为22.8% D、适量摄入可预防骨质疏松7. 化学是实验科学。下列实验方法不能达到实验目的的是( )
6. 柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂。下列有关柠檬酸亚铁的说法正确的是( )A、由5种元素组成 B、所含元素均属人体必需的微量元素 C、Fe元素的质量分数约为22.8% D、适量摄入可预防骨质疏松7. 化学是实验科学。下列实验方法不能达到实验目的的是( )选项
实验目的
实验方法
A
配制100g质量分数为5%的葡萄糖溶液
称取5.0g葡萄糖固体放入烧杯中,加入95g水,搅拌
B
检验久置的氢氧化钠溶液是否变质
取样,滴入几滴酚酞溶液,观察
C
探究Al与Cu的金属活动性顺序
将Cu丝放入Al2(SO4)3溶液中
D
鉴别化肥KCl和NH4NO3
取样,加入熟石灰粉末研磨,闻气味
A、A B、B C、C D、D8. 我国科学家成功合成一种新型催化剂,可将CO2和H2高效转化为甲醇(CH3OH)。该反应的微观过程如下图所示。
下列说法中正确的是( )
A、 表示甲醇分子
B、该反应属于置换反应
C、参加反应的CO2和H2质量比为22:1
D、该反应有利于减少CO2排放
9. 根据以下实验操作和现象所得出的结论正确的是( )
表示甲醇分子
B、该反应属于置换反应
C、参加反应的CO2和H2质量比为22:1
D、该反应有利于减少CO2排放
9. 根据以下实验操作和现象所得出的结论正确的是( )选项
实验操作和现象
结论
A
在点燃的石蜡火焰上方罩上冷而干燥的烧杯,烧杯内壁出现水雾
石蜡中一定含有氢元素和氧元素
B
向热水中的白磷上通O2 , 白磷接触O2时燃烧
白磷燃烧需要O2
C
硬铝片与铝片相互刻划,铝片上留有较明显的划痕
硬铝的硬度小于铝
D
将某服装面料置于酒精灯上灼烧,闻到烧焦羽毛气味
该面料中不含蛋白质
A、A B、B C、C D、D10. CuO是一种无机胶黏剂的组分之一,实验室中模拟制备的流程如下: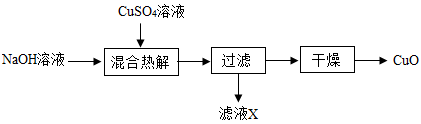

注:“混合热解”过程中发生①、②两步反应,其中反应①为复分解反应,反应②为分解反应。下列说法正确的是( )
A、“反应②”为 B、“过滤”时需使用上图所示装置 C、“滤液X”既可能呈中性,也可能呈强酸性 D、向“滤液X”中滴加BaCl2溶液,无明显现象二、选择题组
-
11. 请阅读下列材料,完成下面小题:
以NaCl、NH3、CO2等为原朴,通过反应 可制得小苏打。海水是获取NaCl的重要来源之一,每1000g水中所含NaCl、MgCl2的质量分别约为26.7g、3.3g。以海水为原料生产NaCl晶体的主要过程如下:
 (1)、下列有物质的性质与用途具有对应关系的是( )A、NaCl有咸味,可用作融雪剂 B、CO2能与水反应,可用作制冷剂 C、NaHCO3能与酸反应,可用作抗酸药物 D、NH4Cl易溶于水,可用作氮肥(2)、已知NaCl、MgCl2的部分溶解度数据如下表。下列关于海水制盐的说法中正确的是( )
(1)、下列有物质的性质与用途具有对应关系的是( )A、NaCl有咸味,可用作融雪剂 B、CO2能与水反应,可用作制冷剂 C、NaHCO3能与酸反应,可用作抗酸药物 D、NH4Cl易溶于水,可用作氮肥(2)、已知NaCl、MgCl2的部分溶解度数据如下表。下列关于海水制盐的说法中正确的是( )温度
0℃
10℃
20℃
30℃
40℃
NaCl的溶解度/g
35.7
35.8
36.0
36.3
36.6
MgCl2的溶解度/g
52.9
53.6
54.6
55.8
57.5
A、20℃时,NaCl饱和溶液中溶质的质量分数约为36% B、“晒盐”的过程中,NaCl和MgCl2的溶解度不断减小 C、20℃时,当海水中水量蒸发掉95%时,MgCl2可能会结晶析出 D、“洗盐”过程中,固体中NaCl的质量基本保持不变三、填空题
-
12. 阅读下列短文,回答问题。
秸秆是农业生产的废料,开展秸秆综合利用,不仅可以使秸秆资源化再利用,还能改善农村生态环境。
秸秆中合有大量的有机质,氮、磷、钾和微量元素,是农业生产重要的有机肥源。秸杆纤维中添加聚乙烯、阻燃剂【主要成分是Mg(OH)2 , 受热分解时生成水和耐高温的白色固体氧化镁,同时吸收大量的热】等物质,可制得具有阻燃性能的材科。
采用玉米秸秆压块燃料代替燃煤供热,能有效缓解大气环境污染。每供1GJ热,秸杆压块供热系统比燃煤供热系统可减少SO2、NOx和PM2.5排放量达98%、76%和58%。
(1)、在燃烧后,秸秆中钾元素转变成K2CO3 , K2CO3属于(填字母)。a.酸 b.碱 c.盐
(2)、用秸秆压块燃料代替燃煤,(填字母)的排放数据减少最为明显。a.SO2 b.NOx c.PM2.5
(3)、聚乙烯【(CH2)n】属于(填字母)。a.金属材料 b.合成材料 c.复合材料
(4)、秸秆压块燃料属于(填“可再生”或“不可再生”)能源。(5)、写出阻燃剂Mg(OH)2在阻燃时反应的化学方程式:。四、综合题
-
13. 兴趣小组对具有取暖功能的某品牌暖宝宝的工作原理、原料制备和物质回收进行探究学习。
 (1)、暖宝宝的工作原理:打开密封包装后,空气中的(填化学式)会通过微孔透气无纺布与铁粉、水接触,铁粉发生锈蚀,同时放出热量。(2)、为了探究暖宝宝中氯化钠和活性炭对铁锈蚀反应的影响,在密闭、干燥的锥形瓶中分别加入下表所示试剂,用温度传感器测定锥形瓶内温度随时间的变化如图所示。
(1)、暖宝宝的工作原理:打开密封包装后,空气中的(填化学式)会通过微孔透气无纺布与铁粉、水接触,铁粉发生锈蚀,同时放出热量。(2)、为了探究暖宝宝中氯化钠和活性炭对铁锈蚀反应的影响,在密闭、干燥的锥形瓶中分别加入下表所示试剂,用温度传感器测定锥形瓶内温度随时间的变化如图所示。
编号
试剂
a
5g铁粉,1.5mL水
b
5g铁粉,1g氯化钠固体,1.5mL水
c
5g铁粉,1g氯化钠固体、1g活性炭,X
①实验c中所用的试剂X是。
②根据题给信息,说明氯化钠和活性炭对铁锈蚀反应的影响:。
(3)、工业、上常用CO在高温下与Fe3O4反应制备铁粉,写出该反应的化学方程式:。(4)、使用后的暖宝宝剩余物中,除了氯化钠以外,均为难溶物。请设计实验方案从剩余物中回收氯化钠固体:将剩余物属于烧杯中,。14. 兴趣小组围绕实验室制取二氧化碳及其性质探究进行项目化学习。(1)、项目一 CO2气体的制取及净化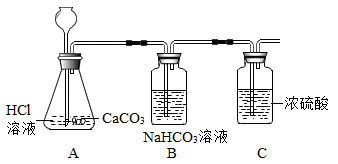
C装置中浓硫酸的作用是。
(2)、B装置的作用是除去CO2气体中混有的少量HCl,该反应的化学方程式为。(3)、项目二 不同收集方法所得CO2气体纯度的比较取相同规格的集气瓶,先用向上排空气法收集两瓶CO2 , 并用燃着的木条验满后,倒扣在题39图所示的水槽中、再用排水集气法收集两瓶CO2 , 也倒扣在水槽中,依次编号为1、2、3、4。
气体样本
1
2
3
4
收集方法
向上排空气法
排水法
2小时后进入的水量
13.7%
14%
15.3%
15.1%
24小时后进入的水量
54.7%
55.3%
94.2%
93.6%
通常情况下,1体积的水约能溶解1体积的CO2。能用排水法收集CO2的主要原因是。
(4)、与向上排空气法相比,用排水法收集CO2的优点是。(5)、项目三 探究CO2与NaOH的可视化反应实验操作
现象
①将少量水与Na2CO3粉末加入50mL乙醇中,搅拌
粉末基本没有溶解
②将少量水与NaOH粉末加入50mL乙醇中,搅拌
粉末消失
③向50mL乙醇中加入NaOH固体至其溶解达到饱和
/
④将CO2通入操作3中所得的NaOH乙醇饱和溶液中
?
预测实验操作4可能的实验现象:。
15. 以含铜酸性废水(主要溶质为CuSO4、H2SO4)为原料回收金属Cu的一种工艺流程如下: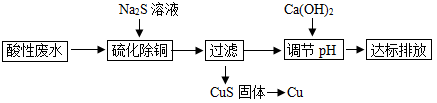
已知:硫化除铜时,溶液的pH会随着Na2S的加入量增多而逐渐增大。当溶液的pH<3.13时,发生的主要反应是 ,当溶液的pH>3.13时,发生的主要反应是 。
(1)、“硫化除铜”时,溶液中Cu2+的浓度随着Na2S的加入量增大而逐渐减小(反应的微观示意图如图所示)。
①从微观角度分析反应开始时Cu2+浓度逐渐下降的原因:。
②当Na2S的加入量超过0.8g·L-1后,溶液中剩余的Cu2+浓度几乎不再随Na2S的加入而改变,可能的原因是。
(2)、CuS炼制Cu过程中发生如下反应: :①炼制过程中,Cu元素的化合价发生的变化为。
②SO2会污染环境,其化学性质与CO2有相似之处,故可用(填化学式)与之反应生成CaSO3而将其除去。
(3)、“调pH”时,若要与溶液中所含的980gH2SO4恰好完全反应,应加入的Ca(OH)2质量是多少?(写出解题过程)。
-
-