福建省厦门市2022年中考一模化学试题
试卷更新日期:2022-05-27 类型:中考模拟
一、单选题
-
1. 为提升青少年身体免疫力,专家提倡多吃鸡蛋、牛奶。鸡蛋、牛奶提供的主要营养素是( )A、蛋白质 B、糖类 C、油脂 D、维生素2. 下列实验操作符合基本规范的是( )A、倾倒液体
 B、加热液体
B、加热液体  C、氧气验满
C、氧气验满  D、稀释浓硫酸
D、稀释浓硫酸  3. 2022年5月12日是我国第14个防灾减灾日。下列做法符合安全要求的是( )A、家中着火,直接开窗通风 B、炒菜时油锅着火,立即用水浇灭 C、在有明火的区域内喷洒含酒精的消毒剂 D、火灾逃生时应尽量将身体贴近地面匍匐或弯腰前进4. 光气(COCl2)是一种重要的化工原料,与水反应前后分子种类变化的微观示意图如下、下列说法正确的是( )
3. 2022年5月12日是我国第14个防灾减灾日。下列做法符合安全要求的是( )A、家中着火,直接开窗通风 B、炒菜时油锅着火,立即用水浇灭 C、在有明火的区域内喷洒含酒精的消毒剂 D、火灾逃生时应尽量将身体贴近地面匍匐或弯腰前进4. 光气(COCl2)是一种重要的化工原料,与水反应前后分子种类变化的微观示意图如下、下列说法正确的是( ) A、保持光气化学性质的最小微粒是C、O、Cl原子 B、反应前后氯元素的质量变小 C、该反应为置换反应 D、生成的丙与丁的分子个数比为2:15. 科学家发现一种奥林匹克烯(C19H12)分子,其结构形似奥运五环(如下图),宽度约1.2nm,被认为是世界上最小的“五环标志”。下列关于奥林匹克烯的说法正确的是( )
A、保持光气化学性质的最小微粒是C、O、Cl原子 B、反应前后氯元素的质量变小 C、该反应为置换反应 D、生成的丙与丁的分子个数比为2:15. 科学家发现一种奥林匹克烯(C19H12)分子,其结构形似奥运五环(如下图),宽度约1.2nm,被认为是世界上最小的“五环标志”。下列关于奥林匹克烯的说法正确的是( ) A、属于无机物 B、碳、氢两种元素质量比是19:12 C、奥林匹克烯由31个原子构成 D、480g奥林匹克烯含碳元素的质量为456g6.
A、属于无机物 B、碳、氢两种元素质量比是19:12 C、奥林匹克烯由31个原子构成 D、480g奥林匹克烯含碳元素的质量为456g6.甲物质的溶液可用作化肥、电镀液等.甲的溶解度曲线如图所示,下列说法正确的是( )
 A、甲的溶解度是102.5g B、甲的溶解度随温度的升高而增大 C、20℃时,100 g甲的饱和溶液中溶质质量为28.6g D、将70℃甲的饱和溶液升高温度或降低温度,都有晶体析出7. 下列实验操作不能达到实验目的的是( )
A、甲的溶解度是102.5g B、甲的溶解度随温度的升高而增大 C、20℃时,100 g甲的饱和溶液中溶质质量为28.6g D、将70℃甲的饱和溶液升高温度或降低温度,都有晶体析出7. 下列实验操作不能达到实验目的的是( )实验目的
实验操作
A
证明CaCl2溶液中含少量HCl
加入Ca(OH)2溶液,观察溶液变化
B
鉴别NaOH、NaCl、NH4NO3三种固体
分别加水溶解,测量溶液温度的变化
C
除去N2中少量O2
将混合气体通过足量灼热Cu粉
D
粗略测定雨水的酸碱度
用玻璃棒蘸取雨水滴在pH试纸上,再与标准比色卡比较,读数
A、A B、B C、C D、D8. 构建元素及其化合物的化合价与物质类别的二维图(即价类二维图)是学习化学的一种重要方法。硫元素的价类二维图如图。下列说法错误的是( ) A、甲点的物质可以是硫 B、乙点的物质是常见的空气污染物 C、丙点的物质可使无色酚酞变红 D、丁点的物质可以是Na2SO49. “铜的循环”如图。其中,箭号表示能一步实现的物质转化方向,X、Y、Z是初中化学常见的物质。下列说法正确的是( )
A、甲点的物质可以是硫 B、乙点的物质是常见的空气污染物 C、丙点的物质可使无色酚酞变红 D、丁点的物质可以是Na2SO49. “铜的循环”如图。其中,箭号表示能一步实现的物质转化方向,X、Y、Z是初中化学常见的物质。下列说法正确的是( ) A、反应①有氢气生成 B、物质X可能是NaOH C、反应④生成黄色溶液 D、物质Z可能是银10. 兴趣小组用pH传感器对市售的两种抗酸胃药(碳酸氢钠片和氢氧化铝片)的抗酸性能进行研究。用pH为1.5的盐酸模拟胃酸,按说明书上的使用剂量,将药片研成粉末,分别与一定量的盐酸混合(同时逐滴滴加盐酸),在其他条件相同情况下进行实验,实验过程中pH数据如图。依据图示得出的结论正确的是( )
A、反应①有氢气生成 B、物质X可能是NaOH C、反应④生成黄色溶液 D、物质Z可能是银10. 兴趣小组用pH传感器对市售的两种抗酸胃药(碳酸氢钠片和氢氧化铝片)的抗酸性能进行研究。用pH为1.5的盐酸模拟胃酸,按说明书上的使用剂量,将药片研成粉末,分别与一定量的盐酸混合(同时逐滴滴加盐酸),在其他条件相同情况下进行实验,实验过程中pH数据如图。依据图示得出的结论正确的是( ) A、服用碳酸氢钠片,能较快降低酸性 B、服用氢氧化铝片,药效持续时间较短 C、服用后,两种药片都只发生中和反应 D、服用后,两种药片都能使pH处于最佳药效范围
A、服用碳酸氢钠片,能较快降低酸性 B、服用氢氧化铝片,药效持续时间较短 C、服用后,两种药片都只发生中和反应 D、服用后,两种药片都能使pH处于最佳药效范围二、填空题
-
11. 2022年北京冬奥会蕴含许多化学知识。

 (1)、冬奥会场馆采用自主研发的碲化镉发电玻璃,它在低温条件下也能持续发电。根据图1信息,Te的相对原子质量为;Cd的质子数为 , Cd原子失去最外层电子形成离子,其离子符号为。(2)、比赛场馆用冰采用CO2跨临界直冷制冰技术,在该技术中CO2被压缩循环利用。从微观视角解释CO2气体能被压缩的原因是。(3)、火炬“飞扬”采用氢气作燃料,从环保角度分析,采用氢气作燃料的优点是。(4)、火种采用的燃料是丙烷(C3H8),写出丙烷在空气中完全燃烧的化学方程式:。(5)、冰墩墩内部填充物为聚酯纤维,常用方法区别聚酯纤维与棉花。12. 水和双氧水在生活中都有重要的用途。(1)、水是人体必需的营养素。
(1)、冬奥会场馆采用自主研发的碲化镉发电玻璃,它在低温条件下也能持续发电。根据图1信息,Te的相对原子质量为;Cd的质子数为 , Cd原子失去最外层电子形成离子,其离子符号为。(2)、比赛场馆用冰采用CO2跨临界直冷制冰技术,在该技术中CO2被压缩循环利用。从微观视角解释CO2气体能被压缩的原因是。(3)、火炬“飞扬”采用氢气作燃料,从环保角度分析,采用氢气作燃料的优点是。(4)、火种采用的燃料是丙烷(C3H8),写出丙烷在空气中完全燃烧的化学方程式:。(5)、冰墩墩内部填充物为聚酯纤维,常用方法区别聚酯纤维与棉花。12. 水和双氧水在生活中都有重要的用途。(1)、水是人体必需的营养素。①净水方法中,常用吸附水的异味,常用方法将硬水变为软水。
②日常生活中必须爱护水资源,写出保护水资源的一种措施:。
(2)、双氧水常用作消毒剂。①双氧水需阴凉避光保存,用化学方程式解释其原因:。
②双氧水溶液的溶剂是。
③配制100g6%的双氧水,需要30%的双氧水的质量是g。用量筒量取30%的双氧水时,仰视读数,会造成所配制溶液的浓度(选填“偏大”“偏小”或“不变”)。
(3)、水与过氧化氢性质不同的本质原因是。13. 东晋葛洪《食肉方》(即去除黑痣的药方)记载:“取白炭灰、获灰等分,煎令如膏……可去黑子。此不宜预作,十日则歇”。其意思主要为:取等质量“白炭灰”和“获灰”(即草木灰,含K2CO3),用水煎煮,去渣浓缩,得到的反应产物KOH可去除黑痣。此药不适宜提前制出来,否则放置十多天就会失效。(1)、用水煎煮时,溶液中Ca(OH)2与K2CO3 , 发生复分解反应,该反应的化学方程式为。(2)、上述过程涉及的实验操作除加热外,还有、(写两个)。(3)、KOH与NaOH具有相似的性质,KOH能去除黑痣是因为;《食肉方》中“不宜预作,十日则歇”的原因可能是。三、综合题
-
14. 我国CO2大规模利用技术已达到国际领先水平。我国科技人员研究的CO2转化为化学产品的技术路线如图1。

 (1)、“碳捕获”是指从空气中吸收CO2。若用生石灰通过化合反应“捕获”CO2 , 其产物是。(2)、借助零碳能源电解水制得氢气。写出电解水的化学方程式:。(3)、按图2微观示意图制甲醇(CH3OH)。写出该反应的化学方程式:。(4)、CO2可转化成甲酸(HCOOH)。甲酸是一种酸,工业上可用于除去钢铁表面的铁锈,此用途利用的酸的性质是。(5)、写出上述技术路线在解决环境和能源问题的作用:
(1)、“碳捕获”是指从空气中吸收CO2。若用生石灰通过化合反应“捕获”CO2 , 其产物是。(2)、借助零碳能源电解水制得氢气。写出电解水的化学方程式:。(3)、按图2微观示意图制甲醇(CH3OH)。写出该反应的化学方程式:。(4)、CO2可转化成甲酸(HCOOH)。甲酸是一种酸,工业上可用于除去钢铁表面的铁锈,此用途利用的酸的性质是。(5)、写出上述技术路线在解决环境和能源问题的作用:①环境问题:;
②能源问题:。
15. 在工业上,纯碱广泛应用于玻璃、造纸、纺织和洗涤剂的生产等。以半水煤气、食盐等为原料制取纯碱的工业流程如下图。已知半水煤气的主要成分为N2、H2、CO、CO2和H2O等。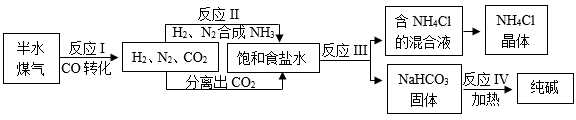 (1)、反应I在加热及催化条件下发生“CO转化”。写出反应的化学方程式:。(2)、该流程中利用沸点不同分离出CO2 , 分离过程发生的变化属于(选填“物理变化”或“化学变化”)。(3)、已知氨气极易溶于水,在反应Ⅲ制NaHCO3过程中,通常先向饱和食盐水中通入氨气,再通入CO2 , 这样做的目的是。(4)、制备过程所得的副产物有NaCl溶液、NH4Cl、CO2 , 其中可用作氮肥的是 , 可循环利用的物质是(写一种)。16. 实验装置的改进是不断创新的过程。
(1)、反应I在加热及催化条件下发生“CO转化”。写出反应的化学方程式:。(2)、该流程中利用沸点不同分离出CO2 , 分离过程发生的变化属于(选填“物理变化”或“化学变化”)。(3)、已知氨气极易溶于水,在反应Ⅲ制NaHCO3过程中,通常先向饱和食盐水中通入氨气,再通入CO2 , 这样做的目的是。(4)、制备过程所得的副产物有NaCl溶液、NH4Cl、CO2 , 其中可用作氮肥的是 , 可循环利用的物质是(写一种)。16. 实验装置的改进是不断创新的过程。

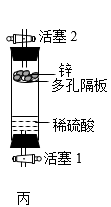 (1)、装置甲是荷兰科学家启普(Kipp)发明的,称为启普发生器。该装置常用于块状固体与液体反应,并可“随开随用,随关随停”制取气体。①,②是制取气体过程中的两种状态,其中处于暂停产生气体的状态是(选填“①”或“②”)。(2)、装置乙是根据启普发生器工作原理进行改进得到的简易装置,实验室可用该装置制取氢气。
(1)、装置甲是荷兰科学家启普(Kipp)发明的,称为启普发生器。该装置常用于块状固体与液体反应,并可“随开随用,随关随停”制取气体。①,②是制取气体过程中的两种状态,其中处于暂停产生气体的状态是(选填“①”或“②”)。(2)、装置乙是根据启普发生器工作原理进行改进得到的简易装置,实验室可用该装置制取氢气。①写出仪器a的名称:。
②写出用锌和稀硫酸制取氢气的化学方程式:。
③产生一定量气体后关闭活塞b,未观察到装置内固体与液体分离的现象,可能的原因是。
(3)、装置丙也可制取氢气,欲让反应发生,操作方法是。17. 某兴趣小组开展“铁的氧化反应”相关实验探究活动。【探究1】探究铁丝燃烧与氧气浓度的关系。在其他条件相同的情况下,取0.38mm粗的铁丝,分别在体积分数为90%、70%、65%、60%、55%的氧气中进行实验。
V(O2)%
实验现象
90%
燃烧剧烈,燃烧时间长,效果好
70%
燃烧比90%的弱,燃烧时间较长,实验成功
65%
燃烧比70%的弱,燃烧时间比70%的短,实验成功
60%
燃烧比65%的弱,燃烧时间更短,实验成功
55%
难以燃烧,只是发红
(1)、实验时要在瓶底留少量的水,目的是。(2)、欲用排水法收集一定体积分数的氧气。若集气瓶容积为250mL,收集前集气瓶中留有125mL水(其余为空气),盖上玻璃片后倒立于水槽中,排完集气瓶中的水后,收集的气体中氧气的体积分数是(氧气在空气中的体积分数以20%进行近似计算;收集后集气瓶中残留的少量水体积忽略不计)。(3)、结合本探究,可得出铁丝燃烧剧烈程度与氧气浓度的关系是 , 对燃烧条件的新认识是。(4)、【探究2】探究铁制品锈蚀的影响因素。已知铁制品通常含碳约2%。按图1所示装置,在广口瓶①、②、③中加入药品,采集数据,氧气的体积分数变化如图2。
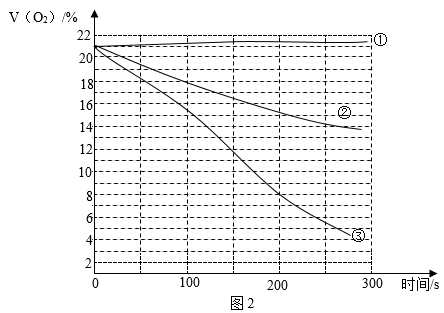
铁制品锈蚀是缓慢氧化的过程,是铁与氧气、水共同作用的结果。请结合图2,说明其依据:。
(5)、实验开始至约300s内,对比广口瓶②,③中氧气体积分数的变化,可以得出的结论是。(6)、实验前需将铁粉、活性炭粉及食盐混合均匀并密封分装,密封的目的是。(7)、欲探究纯铁粉与含少量碳的铁粉的锈蚀快慢,现用广口瓶④、⑤连接以上数据采集器,在其他条件相同的情况下完成实验,则在两个广口瓶中应分别装入的药品及用量:广口瓶④;广口瓶⑤。四、计算题
-
18. 固体酒精具有方便运输、燃烧时无刺激性气味等优点,是餐饮行业中常用的燃料。固体酒精的制作原料为酒精和醋酸钙,醋酸钙常用CaCO3与醋酸(CH3COOH)反应制取: 。现制作一定量的固体酒精,需醋酸钙15.8g,至少需要醋酸的质量是多少?