北京市丰台区2022年中考一模化学化学试题
试卷更新日期:2022-05-27 类型:中考模拟
一、单选题
-
1. 空气中体积分数约占21%的是( )A、CO2 B、N2 C、稀有气体 D、O22. 为了防止骨质疏松,人体必须摄入的元素是( )A、钙 B、铁 C、锌 D、碘3. 下列物质在氧气中燃烧,火星四射、生成黑色固体的是( )A、木炭 B、红磷 C、氢气 D、铁丝4. 下列食物中富含蛋白质的是( )A、面包 B、鸡蛋 C、西红柿 D、橄榄油5. 下列属于化学变化的是( )A、干冰升华 B、水蒸发 C、食物变质 D、蜡烛熔化6. 下列物质分别放入水中,能形成溶液的是( )A、泥土 B、面粉 C、植物油 D、蔗糖7. 下列不属于化石燃料的是A、煤 B、石油 C、酒精 D、天然气8. 能闻到花香的主要原因是( )A、分子间有间隔 B、分子在不断运动 C、分子质量很小 D、分子由原子构成9. 常喝牛奶可以补“钙”,这里的“钙”是指( )A、钙原子 B、钙单质 C、钙元素 D、钙分子10. 下列物质属于氧化物的是( )A、H2SO4 B、NaCl C、KOH D、H2O211. 下列金属活动性最强的是( )A、Cu B、Fe C、Al D、Zn12. 下列实验操作正确的是( )A、给液体加热
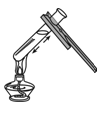 B、倾倒液体
B、倾倒液体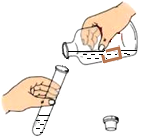 C、检查气密性
C、检查气密性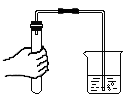 D、稀释浓硫酸
D、稀释浓硫酸 13. 下列物质中,能用作钾肥的是( )A、K2SO4 B、CO(NH2)2 C、NH4NO3 D、Ca(H2PO4)214. 下列物质敞口放置,质量会减少的是( )A、氧化钙 B、氢氧化钠 C、浓硫酸 D、浓盐酸15. 下列符号能表示两个氧原子的是( )A、2O2 B、2O C、O2 D、H2O16. 配制一定溶质质量分数的溶液,不需要用到的仪器是( )A、量筒 B、胶头滴管 C、天平 D、酒精灯17. 电解水实验如图所示。下列说法错误的是( )
13. 下列物质中,能用作钾肥的是( )A、K2SO4 B、CO(NH2)2 C、NH4NO3 D、Ca(H2PO4)214. 下列物质敞口放置,质量会减少的是( )A、氧化钙 B、氢氧化钠 C、浓硫酸 D、浓盐酸15. 下列符号能表示两个氧原子的是( )A、2O2 B、2O C、O2 D、H2O16. 配制一定溶质质量分数的溶液,不需要用到的仪器是( )A、量筒 B、胶头滴管 C、天平 D、酒精灯17. 电解水实验如图所示。下列说法错误的是( ) A、试管1中的气体是氢气 B、试管2中的气体能使带火星的木条复燃 C、正负两极产生气体的体积比为2:1 D、该实验说明水由氢、氧两种元素组成18. 下列说法错误的是( )A、用肥皂水鉴别硬水和软水 B、活性炭有杀菌消毒的作用 C、蒸馏可以得到纯水 D、工业废水处理后再排放19. 每年5月12日是我国的防灾减灾日,下列做法不符合安全要求的是( )A、使用医用酒精消毒要远离火源 B、加油站必须严禁烟火 C、天然气泄露应立刻关闭阀门,开窗通风 D、家用电器使用过程中着火,立即用水扑灭20. 氢氧化钠可以和硫酸铜反应:2NaOH + CuSO4= Na2SO4 + Cu(OH)2↓,该反应属于( )A、化合反应 B、分解反应 C、置换反应 D、复分解反应21. 如图所示实验可用于验证可燃物燃烧的条件,下列说法错误的是( )
A、试管1中的气体是氢气 B、试管2中的气体能使带火星的木条复燃 C、正负两极产生气体的体积比为2:1 D、该实验说明水由氢、氧两种元素组成18. 下列说法错误的是( )A、用肥皂水鉴别硬水和软水 B、活性炭有杀菌消毒的作用 C、蒸馏可以得到纯水 D、工业废水处理后再排放19. 每年5月12日是我国的防灾减灾日,下列做法不符合安全要求的是( )A、使用医用酒精消毒要远离火源 B、加油站必须严禁烟火 C、天然气泄露应立刻关闭阀门,开窗通风 D、家用电器使用过程中着火,立即用水扑灭20. 氢氧化钠可以和硫酸铜反应:2NaOH + CuSO4= Na2SO4 + Cu(OH)2↓,该反应属于( )A、化合反应 B、分解反应 C、置换反应 D、复分解反应21. 如图所示实验可用于验证可燃物燃烧的条件,下列说法错误的是( ) A、该实验利用了铜片的导热性 B、对比①和③,可验证可燃物燃烧需要与氧气接触 C、热水中白磷不燃烧是因为温度未达到着火点 D、热水起到隔绝氧气、提高温度的作用22. 如图是元素周期表中钛元素的信息,下列有关钛的说法错误的是( )
A、该实验利用了铜片的导热性 B、对比①和③,可验证可燃物燃烧需要与氧气接触 C、热水中白磷不燃烧是因为温度未达到着火点 D、热水起到隔绝氧气、提高温度的作用22. 如图是元素周期表中钛元素的信息,下列有关钛的说法错误的是( ) A、质子数为22 B、钛的相对原子质量是47.87g C、钛原子核外有22个电子 D、钛元素属于金属元素23. 二甲醚是一种无毒、无腐蚀、易液化的清洁燃料。合成二甲醚反应的微观示意图如下、下列说法中错误的是( )
A、质子数为22 B、钛的相对原子质量是47.87g C、钛原子核外有22个电子 D、钛元素属于金属元素23. 二甲醚是一种无毒、无腐蚀、易液化的清洁燃料。合成二甲醚反应的微观示意图如下、下列说法中错误的是( ) A、甲分子中碳、氧原子个数比为1:1 B、反应中乙与丁的分子个数比为3:1 C、丙的化学式为C2H6O D、甲物质中碳、氧元素的质量比为1:2
A、甲分子中碳、氧原子个数比为1:1 B、反应中乙与丁的分子个数比为3:1 C、丙的化学式为C2H6O D、甲物质中碳、氧元素的质量比为1:2二、选择题组
-
24. 天宫课堂“点水成冰”实验中用到了醋酸钠。20℃时按下表配制溶液,完成下面小题。
已知:20℃时醋酸钠溶解度为124g,60℃时,醋酸钠溶解度为140g。
序号
①
②
③
④
醋酸钠的质量/g
100
120
140
160
水的质量/g
100
100
100
100
(1)、所得溶液中为饱和溶液的是( )A、① B、①② C、③④ D、④(2)、下列说法错误的是( )A、①中溶质质量分数为50% B、②中溶液质量为220g C、③中溶质和溶剂的质量比为7:5 D、④中溶液升温至60℃,溶质质量分数增大三、填空题
-
25. 从A或B中任选一个作答,若均作答,按A计分。
A
B
⑴Ca(OH)2的俗称是。
⑵Ca(OH)2的用途之一是。
⑴NaHCO3的俗称是。
⑵NaHCO3的用途之一是。
26. 2022年2月27日,长征八号遥二运载火箭成功发射。(1)、火箭采用液氧煤油推进剂,体现氧气的性质是。(2)、制造火箭发动机的钢材需要具备良好的强度和防锈性能。工业上用赤铁矿(主要成分为Fe2O3)和一氧化碳炼铁的化学方程式为。(3)、下列物质可用于除铁锈的是____(填字母序号)。A、盐酸 B、氯化钠溶液 C、氢氧化钠溶液27. 我国科学家以二氧化碳、氢气为原料,通过多步反应制得淀粉[化学式为(C6H10O5)n],实现了二氧化碳到淀粉的人工合成。(1)、淀粉属于(填“有机”或“无机”)化合物。(2)、关于二氧化碳合成淀粉的意义,下列说法正确的是____(填字母序号)。A、能够消耗二氧化碳,将有助于减少温室效应 B、能够合成淀粉,将有利于解决粮食短缺问题 C、该反应可以完全替代光合作用28. 利用下图装置制备二氧化碳并验证其性质。 (1)、A中发生反应的化学方程式为。(2)、B中下方木条先熄灭的原因是。(3)、C中观察到的现象为试管中液面上升和。
(1)、A中发生反应的化学方程式为。(2)、B中下方木条先熄灭的原因是。(3)、C中观察到的现象为试管中液面上升和。四、科普阅读题
-
29. 阅读下面科普短文。
玫瑰红、草绿、钴蓝、柠檬黄…这些漂亮的颜色深受人们喜爱。每一种新的颜料出现,其所展现的颜色便被赋予了新的名字。
人类获取颜料主要有以下三个途径。
天然矿物:早期颜料主要来源,且大多数来自特殊地区出产的矿物。北宋《千里江山图》便是用朱砂、赭石(主要成分为Fe2O3)、石青和孔雀石等所绘,时隔千年,画卷中颜色依然层次分明、色彩浓丽、常见的矿石颜料还有紫云、蓝闪石、雄黄等。
动植物:从雌胭脂虫体内提取的胭脂虫红,用于食品、化妆品、纺织品等生产。
从蓝草、桑、紫草中提取的色素,广泛应用于各行各业、我们常见的紫甘蓝细胞液中含有一种花色苷的化合物,在pH环境不同的条件下,会发生反应,呈现出不同颜色(见下表),用其绘画十分有趣。
pH
1
3
5
7
9
11
13
颜色
红
紫红
浅紫
紫
蓝
绿
黄
合成:近代有机化学蓬勃发展,涌现出了大量合成颜料。但据记载早在公元四世纪,人类就掌握了合成颜料——铅白的加工方法。将铅条堆放在醋和发酵物上,置于密闭空间内,利用发酵产生的热量和二氧化碳,最终生成铅白。
随着科技的发展,一定会有更多靓丽的颜色点缀我们的生活。
依据文章内容回答下列问题。
(1)、写出一种来自天然矿物的颜料。(2)、千里江山图历经千年,颜色依然分明,说明所用矿石颜料化学性质(填“稳定”或“不稳定”)。(3)、向稀盐酸中加入紫甘蓝汁液,可能呈现的颜色是(填“红色”或“蓝色”)。(4)、公元四世纪,人类使用铅条(Pb)与氧气、水和二氧化碳发生反应,最终获得了铅白[Pb3(OH)4CO3]。铅白由种元素组成。(5)、下列说法正确的是____(填字母序号)。A、颜料的命名多与来源有关 B、矿物颜料取之不尽、用之不竭 C、新颜料的出现与科技发展有关 D、铅白可能具有毒性五、综合题
-
30. 二氧化氯(ClO2)可用于自来水消毒,用氯化钠生产ClO2的主要流程如下:
 (1)、Ⅰ中反应物一定有水,从元素守恒角度,说明理由。(2)、ClO2中氯元素的化合价为。(3)、上述流程中可循环利用的物质是。31. 利用碳酸钠溶液吸收工业尾气中的SO2制取亚硫酸钠(Na2SO3),可实现资源的综合利用,减少环境污染,其工艺流程如下。
(1)、Ⅰ中反应物一定有水,从元素守恒角度,说明理由。(2)、ClO2中氯元素的化合价为。(3)、上述流程中可循环利用的物质是。31. 利用碳酸钠溶液吸收工业尾气中的SO2制取亚硫酸钠(Na2SO3),可实现资源的综合利用,减少环境污染,其工艺流程如下。
提示:吸收塔中发生的主要反应是Na2CO3+H2O+2SO2=2NaHSO3+CO2
(1)、吸收塔中碳酸钠溶液以雾状喷洒的目的是。(2)、写出反应器中发生反应的化学方程式。(3)、干燥器的的主要作用是。32. 根据下图回答问题。 (1)、仪器a的名称是。(2)、加热KMnO4制取氧气的化学方程式为。(3)、实验一,用排水法收集氧气的原因是。(4)、实验二,验证木炭在氧气中燃烧的产物为二氧化碳,需要进行的操作是。33. “去除粗盐中难溶性杂质”的实验操作如下图所示。
(1)、仪器a的名称是。(2)、加热KMnO4制取氧气的化学方程式为。(3)、实验一,用排水法收集氧气的原因是。(4)、实验二,验证木炭在氧气中燃烧的产物为二氧化碳,需要进行的操作是。33. “去除粗盐中难溶性杂质”的实验操作如下图所示。 (1)、正确的操作顺序是(填字母序号)。(2)、除去难溶性杂质的操作为。(3)、B中玻璃棒的作用是。34. 用如图所示装置探究空气中氧气的含量。
(1)、正确的操作顺序是(填字母序号)。(2)、除去难溶性杂质的操作为。(3)、B中玻璃棒的作用是。34. 用如图所示装置探究空气中氧气的含量。 (1)、用凸透镜聚光照射白磷可将其引燃,白磷燃烧的化学方程式为。(2)、能证明“氧气约占空气体积1/5”的实验现象是。35. 利用如图装置研究二氧化碳与氢氧化钠溶液的反应。
(1)、用凸透镜聚光照射白磷可将其引燃,白磷燃烧的化学方程式为。(2)、能证明“氧气约占空气体积1/5”的实验现象是。35. 利用如图装置研究二氧化碳与氢氧化钠溶液的反应。
关闭K,推动注射器,将适量氢氧化钠溶液注入A中,待反应结束后,打开K,B中稀盐酸沿导管进入A。
(1)、氢氧化钠溶液与二氧化碳反应的化学方程式为。(2)、B中液体流入A后,观察到A中 , 说明二氧化碳与氢氧化钠发生了反应。36. 补全实验方案。序号
目的
操作
现象
结论
A
探究氢氧化钠与盐酸是否发生反应

氢氧化钠与盐酸发生了反应。
B

试管1中有气泡产生;
试管2中无明显现象
铁的金属活动性大于铜。
C
鉴别氢氧化钠溶液和碳酸钠溶液

试管1中无明显现象,试管2中溶液变浑浊
37. 食品脱氧剂主要成分有铁粉、活性炭、氯化钠,发生脱氧反应消耗食品包装袋内的氧气延长食品保质期。实验小组探究脱氧反应发生条件和影响脱氧反应速率的因素。(1)、实验一 探究脱氧反应发生条件按图1所示装置进行实验,利用氧气传感器测定密闭容器中氧气含量变化,如图2所示。


结合图2分析,集气瓶②中铁粉发生脱氧反应的依据是。
(2)、实验一得出的结论是发生脱氧反应需要铁粉与氧气和同时接触。(3)、实验二 探究氯化钠、活性炭用量对脱氧反应速率的影响室温下,利用5g铁粉和10滴水,改变活性炭和氯化钠的用量(见下表),用氧气传感器测定密闭容器中氧气含量变化,实验结果如图3、图4所示。
实验编号
铁粉/g
活性炭/g
氯化钠/g
1
5
0
1
2
5
0.75
0
3
5
0.75
1
4
5
1.5
1
5
5
a
2


实验5中,a=。
(4)、实验1、3、4的目的是。(5)、结合图4,对比实验2、3、5可以得到的结论是。(6)、实验三 探究硅藻土的用量对脱氧反应速率的影响脱氧剂中还经常添加硅藻土,主要作用是吸附水分, 同时疏松配料,使铁粉更易于与氧气接触。室温下,在一定量的脱氧剂中加入不同质量的硅藻土,测定密闭容器中氧气耗尽所需时间,如图5所示。

由图5可知,硅藻土用量和氧气耗尽所需时间的关系是。
(7)、结合以上实验分析,脱氧剂的反应速率还可能受哪些因素影响(写出一条即可)。六、计算题
-
38. 工业用二氧化碳和氨气(NH3)合成尿素[CO(NH2)2],反应的化学方程式如下:2NH3 + CO2CO(NH2)2 + H2O。计算68g氨气完全反应,消耗二氧化碳的质量。
-
-