云南省昆明市嵩明县2021-2022学年高二下学期期中考试化学试题
试卷更新日期:2022-05-26 类型:期中考试
一、单选题
-
1. 习近平总书记提出我国要在2030年实现“碳达峰”,2060 年前实现“碳中和”。碳中和是指CO2的排放总量和减少总量相当。下列不利于实现“碳达峰、碳中和”的是( )A、研发催化剂,将CO2合成为淀粉 B、倡导植树造林,绿色出行 C、推进电动汽车替代燃油汽车 D、大力推广燃煤发电2. 下列有关化学用语表示正确的是( )A、Mg2+的结构示意图:
 B、N2的结构式: N ≡N
C、核内有12个中子的Na:Na
D、H2C2O4在水溶液中的电离方程式为H2C2O4=2H++C2O
3. 化学与人类社会生产、生活有着密切联系。下列叙述中错误的是( )A、维生素C可用作水果罐头的抗氧化剂 B、明矾、活性炭的净水原理均相同 C、5G技术中使用的通信光缆不与任何酸碱反应 D、高温、75%酒精、84 消毒液(主要含NaClO)都可使新冠病毒蛋白质变性4. 设阿伏加德罗常数的值为NA , 下列说法正确的是( )A、0.1 mol·L-1AlCl3溶液中Al3+数目为0.1 NA B、16g O2和O3混合物中氧原子数目为1 NA C、标准状况下,11.2L 苯中含有的碳碳双键数目为3NA D、1molN2与足量的H2充分反应后,转移电子数为6 NA5. 下列离子方程式正确的是( )A、Cl2通入水中制氯水: Cl2+H2O 2H++Cl-+ClO- B、向稀硝酸中加入铜片: Cu+4H+ +2NO =Cu2+ + 2NO2↑+ 2H2O C、氯化铁腐蚀铜制电路板: Fe3++Cu= Fe2++Cu2+ D、二氧化硫与酸性高锰酸钾溶液反应: 5SO2+ 2H2O+ 2MnO=2Mn2++5SO+4H+6. 一种抗肿瘤活性物质PsilostchyinA的结构如图所示。下列关于该化合物说法正确的是( )
B、N2的结构式: N ≡N
C、核内有12个中子的Na:Na
D、H2C2O4在水溶液中的电离方程式为H2C2O4=2H++C2O
3. 化学与人类社会生产、生活有着密切联系。下列叙述中错误的是( )A、维生素C可用作水果罐头的抗氧化剂 B、明矾、活性炭的净水原理均相同 C、5G技术中使用的通信光缆不与任何酸碱反应 D、高温、75%酒精、84 消毒液(主要含NaClO)都可使新冠病毒蛋白质变性4. 设阿伏加德罗常数的值为NA , 下列说法正确的是( )A、0.1 mol·L-1AlCl3溶液中Al3+数目为0.1 NA B、16g O2和O3混合物中氧原子数目为1 NA C、标准状况下,11.2L 苯中含有的碳碳双键数目为3NA D、1molN2与足量的H2充分反应后,转移电子数为6 NA5. 下列离子方程式正确的是( )A、Cl2通入水中制氯水: Cl2+H2O 2H++Cl-+ClO- B、向稀硝酸中加入铜片: Cu+4H+ +2NO =Cu2+ + 2NO2↑+ 2H2O C、氯化铁腐蚀铜制电路板: Fe3++Cu= Fe2++Cu2+ D、二氧化硫与酸性高锰酸钾溶液反应: 5SO2+ 2H2O+ 2MnO=2Mn2++5SO+4H+6. 一种抗肿瘤活性物质PsilostchyinA的结构如图所示。下列关于该化合物说法正确的是( ) A、该物质分子式为C13H12O5 B、分子中含4种官能团 C、能使酸性KMnO4溶液和溴水褪色 D、该物质不存在含苯环的同分异构体7. 下列操作规范 且能达到实验目的的是( )
A、该物质分子式为C13H12O5 B、分子中含4种官能团 C、能使酸性KMnO4溶液和溴水褪色 D、该物质不存在含苯环的同分异构体7. 下列操作规范 且能达到实验目的的是( ) A、用图甲装置配制200 mL 0.1 mol·L-1的盐酸 B、用图乙装置进行酸碱中和滴定 C、用图丙装置分离乙醇和乙酸的混合溶液 D、用图丁装置研究不同催化剂对反应速率的影响8. X、 Y、Z、W是原子序数递增的短周期主族元素,其中X是地壳中含量最多的元素,X与Z最外层电子数相同,Y为短周期元素中金属性最强的元素,下列说法错误的是( )A、原子半径:Y>Z>W>X B、X、Y形成的化合物一定含离子键 C、简单氢化物的沸点: X>Z D、含氧酸酸性: Z<W9. 下列关于有机物的相关说法正确的是( )A、
A、用图甲装置配制200 mL 0.1 mol·L-1的盐酸 B、用图乙装置进行酸碱中和滴定 C、用图丙装置分离乙醇和乙酸的混合溶液 D、用图丁装置研究不同催化剂对反应速率的影响8. X、 Y、Z、W是原子序数递增的短周期主族元素,其中X是地壳中含量最多的元素,X与Z最外层电子数相同,Y为短周期元素中金属性最强的元素,下列说法错误的是( )A、原子半径:Y>Z>W>X B、X、Y形成的化合物一定含离子键 C、简单氢化物的沸点: X>Z D、含氧酸酸性: Z<W9. 下列关于有机物的相关说法正确的是( )A、 和
和 两者互为同分异构体
B、
两者互为同分异构体
B、 的系统命名为:1,5-二溴戊烷
C、用溴乙烷制取乙二醇(HOCH2CH2OH)需经过以下几步:消去→加成→水解
D、乙烯和环丙烷互为同系物
10. 已知某反应的反应历程如图所示,下列说法错误的是( )
的系统命名为:1,5-二溴戊烷
C、用溴乙烷制取乙二醇(HOCH2CH2OH)需经过以下几步:消去→加成→水解
D、乙烯和环丙烷互为同系物
10. 已知某反应的反应历程如图所示,下列说法错误的是( ) A、该反应的活化能为E1 B、该反应的热化学方程式为A+B=D ΔH=(E3-E1)kJ/mol C、该反应中,反应物的总能量大于生成物的总能量 D、C、D两种物质中,稳定性C<D11. 根据下列实验操作,判断现象及结论均正确的是( )
A、该反应的活化能为E1 B、该反应的热化学方程式为A+B=D ΔH=(E3-E1)kJ/mol C、该反应中,反应物的总能量大于生成物的总能量 D、C、D两种物质中,稳定性C<D11. 根据下列实验操作,判断现象及结论均正确的是( )选项
实验操作
现象
结论
A
向某溶液中先加入几滴KSCN溶液,再通入氯气
开始无明显现象,后溶液变红
溶液中一定含Fe2+ , 一定不含Fe3+
B
向BaCl2 溶液中通入SO2气体
有白色沉淀生成
该白色沉淀为BaSO3
C
常温下,测定等物质的量浓度的Na2CO3和Na2SO3溶液的pH
前者pH比后者的大
非金属性: S>C
D
在火焰上灼烧搅拌过某无色溶液的铂丝
火焰出现黄色
该溶液一定是钠盐溶液
A、A B、B C、C D、D12. 臭氧是理想的烟气脱硝试剂,其脱硝反应为2NO2(g)+O3(g) N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图象作出的判断正确的是( )



A.升高温度,平衡常数减小
B.0~3 s内,反应速率为v(NO2)=0.2 mol·L-1
C.t1时仅加入催化剂,平衡正向移动
D.t1时刻,该反应达平衡状态
A、A B、B C、C D、D13. 下列关于有机化合物的说法错误的是( )A、乙烷室温下不能与浓盐酸发生取代反应 B、用核磁共振氢谱可以区分HCOOCH3和HCOOCH2CH3 C、可用酸性KMnO4溶液除去乙烷中混有的乙烯 D、聚氯乙烯不能使溴水褪色14. 下列关于电解质溶液的说法正确的是( )A、向稀盐酸中加入氨水至中性,则溶液中c(NH)=c(Cl-)>c(H+)= c(OH-) B、常温下,向AgCl的悬浊液中加入少量蒸馏水,溶解平衡正向移动,故Ksp减小 C、升高温度,水的电离平衡正向移动,故c(H+)增大, Kw增大,pH值也随之增大。 D、因醋酸是弱酸,故等体积、等浓度的盐酸和醋酸分别与等浓度的NaOH溶液反应时,消耗NaOH的体积不同二、多选题
-
15. 电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图所示,其中NH3被氧化为常见的无毒物质。下列说法正确的是 ( )
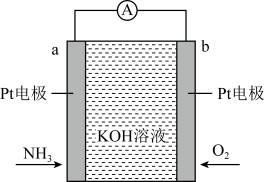 A、溶液中OH-向电极b移动 B、电极b上发生氧化反应 C、负极的电极反应为2NH3-6e -+6OH- =N2+6H2O D、理论上反应消耗的NH3与O2的物质的量之比为4:3
A、溶液中OH-向电极b移动 B、电极b上发生氧化反应 C、负极的电极反应为2NH3-6e -+6OH- =N2+6H2O D、理论上反应消耗的NH3与O2的物质的量之比为4:3三、综合题
-
16. 无水三氯化铁常用于净水剂、印染的媒染剂,印刷制版时的腐蚀剂,在化学工业中还可制造其他铁盐,及处理肥皂提取粗甘油等。实验室用铁粉与氯气反应制备无水FeCl3的实验装置如图所示((夹持装置已省略),已知: FeCl3具有易水解、 易升华的性质
 (1)、A的作用是 , 仪器G的名称为。(2)、请写出装置C中发生反应的化学方程式:。(3)、在D、F处收集产物是利用了FeCl3的性质:实验过程中若E处出现堵塞,则在B处可观察到的现象是。(4)、装置G的作用是。装置H中发生反应的离子方程式是。(5)、某同学用11.2g 干燥铁粉制得无水FeCl3样品29.9g,该次实验的产率是。17. CuI是阳极射线管复盖物,也是重要的有机反应催化剂,不溶于水和乙醇。下图是用废铜电缆(主要成分为Cu,含少量Fe)制取无水CuI的流程。
(1)、A的作用是 , 仪器G的名称为。(2)、请写出装置C中发生反应的化学方程式:。(3)、在D、F处收集产物是利用了FeCl3的性质:实验过程中若E处出现堵塞,则在B处可观察到的现象是。(4)、装置G的作用是。装置H中发生反应的离子方程式是。(5)、某同学用11.2g 干燥铁粉制得无水FeCl3样品29.9g,该次实验的产率是。17. CuI是阳极射线管复盖物,也是重要的有机反应催化剂,不溶于水和乙醇。下图是用废铜电缆(主要成分为Cu,含少量Fe)制取无水CuI的流程。 (1)、CuI中铜元素的化合价为 , 过程①得到的溶液呈蓝色,其原因是(用化学方程式表示)。(2)、当温度高于40℃时,过程①反应速率减慢,原因是。(3)、过程③需进行的实验操作是。(4)、过程③的氧化产物能使淀粉变蓝,对应的离子方程式为。(5)、过程④用乙醇洗涤沉淀的目的。18. 已知有机物1,4-环己二醇(
(1)、CuI中铜元素的化合价为 , 过程①得到的溶液呈蓝色,其原因是(用化学方程式表示)。(2)、当温度高于40℃时,过程①反应速率减慢,原因是。(3)、过程③需进行的实验操作是。(4)、过程③的氧化产物能使淀粉变蓝,对应的离子方程式为。(5)、过程④用乙醇洗涤沉淀的目的。18. 已知有机物1,4-环己二醇( )的合成路线如下图所示:
)的合成路线如下图所示:
根据要求回答下列问题:
(1)、B的结构简式为 , B中所含官能团的名称为。(2)、上述过程中属于加成反应的有 (填序号)。 反应②的反应类型是。(3)、反应②的化学方程式为。(4)、反应④的化学方程式为。(5)、F环状上的一氯代物共有种, 其中核磁共振氢谱比例为4:4:1:1:1的结构简式为。(6)、参照以上合成路线,以2-丁烯为原料合成1,3-丁二烯,其它试剂任选。19. 控制CO2的排放是防止温室效应等不良气候现象产生的有效途径。(1)、高炉炼铁中用CO还原Fe2O3得到Fe,同时会排放大量的CO2和烟尘,必须进行严格的控制。已知:
①C(石墨,s)+CO2(g)=2CO(g) △H= +172.5 kJ·mol-1
②3C(石墨,s)+Fe2O3(s)=2Fe(s)+3CO(g) △H= +489.0 kJ·mol-1
则CO还原Fe2O3的热化学方程式为。
(2)、在恒温恒容密闭容器中充入一定量CO与Fe2O3发生该反应。①以下能说明该可逆反应达到平衡状态的是 (选填字母)。
A.v正(CO)= v逆(CO2) B.容器内气体压强一定
C.CO与CO2浓度比为1∶1 D.Fe的质量不变
②若要提高CO的平衡转化率,可以采取的措施是(写任意一个即可)
(3)、可将炼铁产生的CO2与CH4反应得到气体燃料,其反应原理为:CO2(g)+CH4(g) 2CO(g)+2H2(g)。某小组向体积是1L的密闭容器中充入物质的量均是1mol的CH4与CO2 , 反应过程中CO2的平衡转化率与温度、压强的关系如图所示
①压强:p1p2 , △H0(填“>”、“<”或“=”)
②1100℃、p1条件下,反应的平衡常数K=若在平衡体系再充入0.6molCO2和0.8molH2 , 此时v正 v逆(填“大于”, “小于”或者“等于”)
-