山东省滕州市2021-2022学年高二下学期期中考试化学试题
试卷更新日期:2022-05-26 类型:期中考试
一、单选题
-
1. 中央经济工作会议将碳达峰和碳中和列为主要任务之一,在此背景下,“新能源”、“低碳”、“节能减排”、“绿色化学”等概念愈来愈受到人们的重视。下列说法错误的是( )
 A、太阳能、地热能、氢能均属于“新能源” B、“低碳”是指采用含碳量低的烃类作为燃料 C、图中HCl的循环使用体现了“节能减排”思想 D、用乙烷和氯气光照制取氯乙烷不是最理想的“原子经济性反应”2. 某烯烃与HCl加成后只能得到唯一产物2,3-二甲基-2-氯丁烷,则该烯烃的名称是( )A、3,3-二甲基-1-丁烯 B、2,3-二甲基-2-丁烯 C、2,3-二甲基-3-丁烯 D、2,3-二甲基-1-丁烯3. 下列说法中正确的是 ( )
A、太阳能、地热能、氢能均属于“新能源” B、“低碳”是指采用含碳量低的烃类作为燃料 C、图中HCl的循环使用体现了“节能减排”思想 D、用乙烷和氯气光照制取氯乙烷不是最理想的“原子经济性反应”2. 某烯烃与HCl加成后只能得到唯一产物2,3-二甲基-2-氯丁烷,则该烯烃的名称是( )A、3,3-二甲基-1-丁烯 B、2,3-二甲基-2-丁烯 C、2,3-二甲基-3-丁烯 D、2,3-二甲基-1-丁烯3. 下列说法中正确的是 ( )①晶体中分子间作用力越大,分子越稳定 ②原子晶体中共价键越强,熔点越高 ③干冰是CO2分子通过氢键和分子间作用力有规则排列成的分子晶体 ④在Na2O和Na2O2晶体中,阴、阳离子数之比相等 ⑤正四面体构型的分子,键角都是109°28′,其晶体类型可能是原子晶体或分子晶体 ⑥分子晶体中都含有化学键 ⑦含4.8 g碳元素的金刚石晶体中的共价键的物质的量为0.8 mol
A、①②③④⑤ B、②④⑦ C、⑤⑥⑦ D、③④⑤⑥⑦4. 下列说法错误的是( )A、分子式为C3H8与C6H14的两种有机物一定互为同系物 B、具有相同的分子式,但结构不同的有机物一定互为同分异构体 C、两个相邻同系物一定相差“CH2” D、具有相同的相对分子质量,但结构不同的有机物一定互为同分异构体5. 下列化合物中,核磁共振氢谱只出现三组峰且峰面积之比为3∶2∶2的是( )A、 B、
B、 C、
C、 D、
D、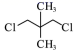 6. 型物质在生产、生活中有广泛应用。下列有关说法正确的是( )A、、分子的空间结构均为平面三角形 B、、均易与、等离子形成配位键 C、、分子都是极性分子且前者极性较强 D、、均为离子晶体且含有的化学键类型相同7. 镍能形成多种不同的化合物。图a是镍的一种配合物结构,图b是镍的一种氧化物晶胞下列说法错误的是( )
6. 型物质在生产、生活中有广泛应用。下列有关说法正确的是( )A、、分子的空间结构均为平面三角形 B、、均易与、等离子形成配位键 C、、分子都是极性分子且前者极性较强 D、、均为离子晶体且含有的化学键类型相同7. 镍能形成多种不同的化合物。图a是镍的一种配合物结构,图b是镍的一种氧化物晶胞下列说法错误的是( ) A、镍原子位于元素周期表中第四周期Ⅷ族,属于d区元素 B、图a分子中存在的化学键有共价键、配位键、氢键 C、氧化镍中、的配位数都是6 D、图b表示的可能是氧化镍()的晶胞8. 下列说法正确的是( )A、构成共价晶体的原子的半径越大,晶体的硬度越大 B、施加电场时,液晶分子垂直于电场方向排列 C、冰融化时,分子中氢氧键发生断裂 D、液晶分子在特定方向排列比较整齐,但不稳定9. 下列实验操作能达到目的的是( )
A、镍原子位于元素周期表中第四周期Ⅷ族,属于d区元素 B、图a分子中存在的化学键有共价键、配位键、氢键 C、氧化镍中、的配位数都是6 D、图b表示的可能是氧化镍()的晶胞8. 下列说法正确的是( )A、构成共价晶体的原子的半径越大,晶体的硬度越大 B、施加电场时,液晶分子垂直于电场方向排列 C、冰融化时,分子中氢氧键发生断裂 D、液晶分子在特定方向排列比较整齐,但不稳定9. 下列实验操作能达到目的的是( )实验目的
实验操作
A
除去乙烷中的乙烯
将混合气体通入酸性高锰酸钾溶液
B
除去乙醇中的水
加入生石灰,蒸馏
C
鉴别苯和环己烷
加入溴水振荡,静置后观察分层及颜色差异
D
分离苯和溴苯
加水后分液
A、A B、B C、C D、D10. 众多的配合物溶于水后易电离为配离子,但配离子难以进一步发生电离。+3价的钴形成的配合物为CoClm·nNH3 , 若中心原子配位数为6,1mol配合物与AgNO3溶液反应时最多可得到1mol沉淀物,则m、n的数值分别为( )A、1、5 B、5、1 C、3、4 D、3、511. 中药丹参的有效成分是丹参醇( ),能改善心脑血管、活血化瘀。有关该化合物的叙述错误的是( ) A、可与溴水发生取代反应 B、可与酸性KMnO4溶液反应 C、能够发生消去反应 D、分子式为C18H16O512. 某化合物的结构(键线式)及球棍模型如图1所示,该有机分子的核磁共振氢谱图如图2。
),能改善心脑血管、活血化瘀。有关该化合物的叙述错误的是( ) A、可与溴水发生取代反应 B、可与酸性KMnO4溶液反应 C、能够发生消去反应 D、分子式为C18H16O512. 某化合物的结构(键线式)及球棍模型如图1所示,该有机分子的核磁共振氢谱图如图2。

下列关于该有机物的叙述正确的是( )
A、该有机物不同化学环境的氢原子有6种 B、该有机物属于芳香族化合物 C、键线式中的Et代表的基团为-CH3 D、该有机物在一定条件下能完全燃烧生成CO2和H2O13. 向溶液中逐滴滴加浓氨水,先生成蓝色沉淀,后蓝色沉淀逐渐溶解为深蓝色溶液;向深蓝色溶液中加入95%乙醇,深蓝色溶液变浑浊,静置后有深蓝色硫酸四氨合铜晶体析出,上层溶液颜色变浅。下列有关说法错误的是( )A、极易溶于水是因为氨分子间易形成氢键 B、比更容易与反应形成配合物 C、硫酸四氮合铜在乙醇中的溶解度小于在水中的溶解度 D、蓝色沉淀溶解的离子方程式为二、多选题
-
14. 硼酸()是一种片层状结构的白色晶体,层内的分子通过氢键相连(如图所示)。下列有关说法正确的是( )
 A、在分子中各原子最外层均满足8电子稳定结构 B、分子的稳定性与氢键有关 C、1mol的晶体中有6mol极性共价键 D、1mol的晶体中有3mol氢键15. 下列说法正确的是( )A、向1L1mo/L的溶液中加入足量溶液有3mol沉淀产生 B、分子式为的有机物有4种可能结构(不考虑立体异构) C、1mol石墨晶体中含有的键数目为1.5 D、金属的导电性和导热性都是通过自由电子的定向运动实现的
A、在分子中各原子最外层均满足8电子稳定结构 B、分子的稳定性与氢键有关 C、1mol的晶体中有6mol极性共价键 D、1mol的晶体中有3mol氢键15. 下列说法正确的是( )A、向1L1mo/L的溶液中加入足量溶液有3mol沉淀产生 B、分子式为的有机物有4种可能结构(不考虑立体异构) C、1mol石墨晶体中含有的键数目为1.5 D、金属的导电性和导热性都是通过自由电子的定向运动实现的三、填空题
-
16. 按要求回答问题:(1)、对下列有机物进行命名。
 (2)、分子结构中处于同一平面上的原子个数最多有个。(3)、中含有官能团的名称为。(4)、乙烯和丙烯按物质的量之比为聚合时,可生成聚合物乙丙树脂,该聚合物的结构简式可能是、。(5)、化学式为 , 已知其核磁共振氢谱表明只有一种化学环境的氢,则该有机物的结构简式为。(6)、丙烷的二氯代物共有种(不考虑立体异构)。17. 如图是异辛烷的球棍模型:
(2)、分子结构中处于同一平面上的原子个数最多有个。(3)、中含有官能团的名称为。(4)、乙烯和丙烯按物质的量之比为聚合时,可生成聚合物乙丙树脂,该聚合物的结构简式可能是、。(5)、化学式为 , 已知其核磁共振氢谱表明只有一种化学环境的氢,则该有机物的结构简式为。(6)、丙烷的二氯代物共有种(不考虑立体异构)。17. 如图是异辛烷的球棍模型: (1)、异辛烷与乙烷的关系是。(2)、写出异辛烷完全燃烧的化学方程式(异辛烷用分子式表示)。1mol异辛烷和1mol正庚烷分别完全燃烧生成水和二氧化碳,消耗氧气的物质的量之差mol。(3)、异辛烷的同分异构体有很多,其中一种同分异构体X的分子结构中含有6个甲基,则X的结构简式为。(4)、将11.2L(标准状况)乙烯和乙烷的混合气体通入足量溴水中,充分反应后,溴水的质量增加了5.6g,原气体混合物中乙烯与乙烷的物质的量之比为。(5)、实验室制备溴苯的装置如图所示。下列关于实验操作或叙述错误的是____。
(1)、异辛烷与乙烷的关系是。(2)、写出异辛烷完全燃烧的化学方程式(异辛烷用分子式表示)。1mol异辛烷和1mol正庚烷分别完全燃烧生成水和二氧化碳,消耗氧气的物质的量之差mol。(3)、异辛烷的同分异构体有很多,其中一种同分异构体X的分子结构中含有6个甲基,则X的结构简式为。(4)、将11.2L(标准状况)乙烯和乙烷的混合气体通入足量溴水中,充分反应后,溴水的质量增加了5.6g,原气体混合物中乙烯与乙烷的物质的量之比为。(5)、实验室制备溴苯的装置如图所示。下列关于实验操作或叙述错误的是____。 A、作催化剂,可用铁屑代替 B、装置b的作用是吸收挥发的苯 C、装置c中石蕊溶液变为红色,可证明苯与溴发生取代反应 D、反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯18. 1,2-二氯乙烷是制备杀菌剂和植物生长调节剂的中间体,已知其沸点为83.5℃,熔点为-35℃。下图为实验室中制备1,2-二氯乙烷的装置,无水乙醇的密度约为 , 其中加热和夹持装置已略去。
A、作催化剂,可用铁屑代替 B、装置b的作用是吸收挥发的苯 C、装置c中石蕊溶液变为红色,可证明苯与溴发生取代反应 D、反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯18. 1,2-二氯乙烷是制备杀菌剂和植物生长调节剂的中间体,已知其沸点为83.5℃,熔点为-35℃。下图为实验室中制备1,2-二氯乙烷的装置,无水乙醇的密度约为 , 其中加热和夹持装置已略去。 (1)、装置A中还缺少的一种必要仪器是 , 使用冷凝管的目的是。(2)、装置A中发生主要反应的化学方程式为。(3)、装置B中玻璃管a的作用是。(4)、实验时A中三颈烧瓶内可能会产生一种刺激性气味的气体,为吸收该气体,在装置B中应加入的最佳试剂为____(填字母序号)。A、浓硫酸 B、饱和溶液 C、酸性溶液 D、溶液(5)、实验结束后收集得到0.24mol1,2-二氯乙烷,则乙醇的利用率为%。19. 第四周期过渡金属元素,其单质及化合物在诸多领域中都有广泛的应用。(1)、二茂铁[]是由一个二价铁离子和2个环戊烯基负离子构成,熔点是173℃(在100℃时开始升华),沸点是249℃,不溶于水,易溶于苯、乙醚等非极性溶剂。据此可推断二茂铁晶体为晶体,在二茂铁结构中,与之间形成的化学键类型是。(2)、向黄色的三氯化铁溶液中加入无色的溶液,溶液变成红色。可用方程式表示。经研究表明,是配合物,与不仅能以的个数比配合,还可以其他个数比配合。
(1)、装置A中还缺少的一种必要仪器是 , 使用冷凝管的目的是。(2)、装置A中发生主要反应的化学方程式为。(3)、装置B中玻璃管a的作用是。(4)、实验时A中三颈烧瓶内可能会产生一种刺激性气味的气体,为吸收该气体,在装置B中应加入的最佳试剂为____(填字母序号)。A、浓硫酸 B、饱和溶液 C、酸性溶液 D、溶液(5)、实验结束后收集得到0.24mol1,2-二氯乙烷,则乙醇的利用率为%。19. 第四周期过渡金属元素,其单质及化合物在诸多领域中都有广泛的应用。(1)、二茂铁[]是由一个二价铁离子和2个环戊烯基负离子构成,熔点是173℃(在100℃时开始升华),沸点是249℃,不溶于水,易溶于苯、乙醚等非极性溶剂。据此可推断二茂铁晶体为晶体,在二茂铁结构中,与之间形成的化学键类型是。(2)、向黄色的三氯化铁溶液中加入无色的溶液,溶液变成红色。可用方程式表示。经研究表明,是配合物,与不仅能以的个数比配合,还可以其他个数比配合。①所得与的配合物中,主要是与以个数比配合所得离子显红色。含该离子的配合物的化学式是。
②铁的另一种配合物铁氰化钾俗称赤血盐,可用于检验 , 两者反应生成带有特征蓝色的沉淀,该赤血盐中心原子的配位数是 , 请写出一种与其配体互为等电子体的分子。
(3)、已知的立体结构如下图,其中1~6处的小圆圈表示分子,且各相邻的分子间的距离相等(图中虚线长度相等)。位于八面体的中心,若其中两个被取代,所形成的的结构有种。 20. 回答下列问题:(1)、沸点:(填“>”或“<”),判断依据是。(2)、X的某种晶体为层状结构,可与熔融金属钾作用,钾原子填充在各层之间,形成间隙化合物,其常见结构的平面投影如图所示,则其化学式可表示为。
20. 回答下列问题:(1)、沸点:(填“>”或“<”),判断依据是。(2)、X的某种晶体为层状结构,可与熔融金属钾作用,钾原子填充在各层之间,形成间隙化合物,其常见结构的平面投影如图所示,则其化学式可表示为。 (3)、若与通过B原子与Z原子间的配位键结合形成配合物,则该配合物提供孤电子对的原子是。(4)、肼(N2H4)分子可视为分子中的一个氢原子被(氨基)取代形成的另一种氮的氢化物。肼能与硫酸反应生成。晶体类型与硫酸铵相同,则的晶体内存在(填序号,下同)。
(3)、若与通过B原子与Z原子间的配位键结合形成配合物,则该配合物提供孤电子对的原子是。(4)、肼(N2H4)分子可视为分子中的一个氢原子被(氨基)取代形成的另一种氮的氢化物。肼能与硫酸反应生成。晶体类型与硫酸铵相同,则的晶体内存在(填序号,下同)。a.离子键 b.配位键 c.共价键
(5)、难溶于水易溶于氨水,是因为可与氨形成易溶于水的配位化合物,若配位数是4,则络离子的化学式为。(6)、白铜(铜镍合金)的立方晶胞结构如下图所示,其中原子A的坐标参数为。原子B的坐标参数为。