陕西省西安市鄠邑区2021-2022学年高一下学期期中考试化学试题
试卷更新日期:2022-05-26 类型:期中考试
一、单选题
-
1. 据科学家推测,月球的土壤吸附着数百万吨的 , 在地球上氦元素主要以的形式存在,下列有关和的说法正确的是( )A、属于同一种核素 B、质量数相同 C、与心互为同素异形体 D、和互为同位素2. 下列化学用语表达正确的是( )A、溴化钙的化学式是CaBr B、氯化氢分子的电子式是
 C、的结构式是N≡N
D、氯原子的结构示意图是
C、的结构式是N≡N
D、氯原子的结构示意图是 3. 某金属元素的一个原子失去两个电子后,转变为具有Ne原子的电子层结构的离子,则该金属元素在元素周期表中的位置是( )A、第三周期第IA族 B、第三周期第ⅡA族 C、第四周期第IA族 D、第四周期第ⅡA族4. 元素在周期表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是( )A、只有非金属元素能形成含氧酸或含氧酸盐 B、除短周期外,其他周期均有18种元素 C、第三周期元素的最高正化合价等于它所处的主族序数 D、除稀有气体外的非金属元素都能形成不同价态的含氧酸5. 元素X的原子核外M电子层上有3个电子,元素Y2-的离子核外有18个电子,则这两种元素可形成的化合物( )A、XY2 B、X2Y C、X2Y3 D、X3Y26. 下列关于碱金属元素的说法中,正确的是( )A、IA族元素都是碱金属元素 B、在常温下Cs与水反应会发生爆炸 C、金属钾具有强还原性,K+具有强氧化性 D、碱金属单质可将铜从其盐溶液中置换出来7. 下列有关化学反应与能量变化的说法正确的是( )A、化学键的形成需要吸收能量 B、碳在氧气中燃烧属于吸热反应 C、酸碱中和反应是放热反应 D、化学反应过程中,化学能只转化成热能8. 如图是一种氢能的制取、贮存及利用的关系图,图中能量转化方式不涉及( )
3. 某金属元素的一个原子失去两个电子后,转变为具有Ne原子的电子层结构的离子,则该金属元素在元素周期表中的位置是( )A、第三周期第IA族 B、第三周期第ⅡA族 C、第四周期第IA族 D、第四周期第ⅡA族4. 元素在周期表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是( )A、只有非金属元素能形成含氧酸或含氧酸盐 B、除短周期外,其他周期均有18种元素 C、第三周期元素的最高正化合价等于它所处的主族序数 D、除稀有气体外的非金属元素都能形成不同价态的含氧酸5. 元素X的原子核外M电子层上有3个电子,元素Y2-的离子核外有18个电子,则这两种元素可形成的化合物( )A、XY2 B、X2Y C、X2Y3 D、X3Y26. 下列关于碱金属元素的说法中,正确的是( )A、IA族元素都是碱金属元素 B、在常温下Cs与水反应会发生爆炸 C、金属钾具有强还原性,K+具有强氧化性 D、碱金属单质可将铜从其盐溶液中置换出来7. 下列有关化学反应与能量变化的说法正确的是( )A、化学键的形成需要吸收能量 B、碳在氧气中燃烧属于吸热反应 C、酸碱中和反应是放热反应 D、化学反应过程中,化学能只转化成热能8. 如图是一种氢能的制取、贮存及利用的关系图,图中能量转化方式不涉及( ) A、电能→化学能 B、光能→化学能 C、化学能→电能 D、电能→机械能9. 下列反应既属于吸收能量的反应,又属于氧化还原反应的是( )A、锌粒与稀硫酸的反应 B、铁丝在氧气中燃烧的反应 C、碳酸钙高温分解的反应 D、灼热的木炭与的反应10. 某反应的能量图如图所示,下列说法正确的是( )
A、电能→化学能 B、光能→化学能 C、化学能→电能 D、电能→机械能9. 下列反应既属于吸收能量的反应,又属于氧化还原反应的是( )A、锌粒与稀硫酸的反应 B、铁丝在氧气中燃烧的反应 C、碳酸钙高温分解的反应 D、灼热的木炭与的反应10. 某反应的能量图如图所示,下列说法正确的是( ) A、一个放热反应 B、拆开1moAB(g)中的化学键需要吸收bkJ的能量 C、1mol和1mol的能量之和为akJ D、该反应中,反应物的总能量小于生成物的总能量11. 化学电源在日常生活和高科技领域中都有广泛应用。下列说法错误的是( )
A、一个放热反应 B、拆开1moAB(g)中的化学键需要吸收bkJ的能量 C、1mol和1mol的能量之和为akJ D、该反应中,反应物的总能量小于生成物的总能量11. 化学电源在日常生活和高科技领域中都有广泛应用。下列说法错误的是( ) A、甲:向Cu电极方向移动,Cu电极附近溶液中浓度增加 B、乙:正极的电极反应式为 C、丙:锌筒作负极,发生氧化反应,锌筒会变薄 D、丁:使用一段时间后,电解质溶液的酸性减弱,导电能力下降12. 锌空气电池具有蓄电量大、充电循环次数多等优点。下列有关说法错误的是( )
A、甲:向Cu电极方向移动,Cu电极附近溶液中浓度增加 B、乙:正极的电极反应式为 C、丙:锌筒作负极,发生氧化反应,锌筒会变薄 D、丁:使用一段时间后,电解质溶液的酸性减弱,导电能力下降12. 锌空气电池具有蓄电量大、充电循环次数多等优点。下列有关说法错误的是( ) A、电池放电时实现了化学能向电能的转化 B、电池放电时Zn电极逐渐溶解 C、石墨为正极 D、电子由石墨经导线流向Zn片13. 2A(g)+ 3B(g)=C(g)+ 3D(g)的反应中,表示相同条件下反应速率最快的是( )A、v(A)=3.5mol·L-1·s-1 B、v(B) =2.4mol·L-1·s-1 C、v(C) =2mol·L-1·s-1 D、v(D) =3mol·L-1·s-114. 下列措施能减慢化学反应速率的是( )A、将煤块粉碎后燃烧 B、食物贮藏在冰箱内 C、利用KClO3固体加热制O2时添加少量MnO2固体 D、用2g锌粒替代1g锌粒与同浓度同体积的过量盐酸反应15. 一定温度下,向2 L某恒容密闭容器中加入1 mol X气体和2 molY气体,发生如下反应: , 5 min时测得Z的物质的量为1.2 mol,下列说法正确的是( )A、此时Y的浓度为0.6 mol/L B、5 min内v(X)=0.06 mol/(L·min) C、容器内X、Y、Z的浓度之比为1:2:2,则该反应达到平衡状态 D、单位时间消耗0.1 mol X同时生成0.2 mol Z,则该反应达到平衡状态16. 某温度时,在容积为3 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。由图中数据分析,下列结论错误的是( )
A、电池放电时实现了化学能向电能的转化 B、电池放电时Zn电极逐渐溶解 C、石墨为正极 D、电子由石墨经导线流向Zn片13. 2A(g)+ 3B(g)=C(g)+ 3D(g)的反应中,表示相同条件下反应速率最快的是( )A、v(A)=3.5mol·L-1·s-1 B、v(B) =2.4mol·L-1·s-1 C、v(C) =2mol·L-1·s-1 D、v(D) =3mol·L-1·s-114. 下列措施能减慢化学反应速率的是( )A、将煤块粉碎后燃烧 B、食物贮藏在冰箱内 C、利用KClO3固体加热制O2时添加少量MnO2固体 D、用2g锌粒替代1g锌粒与同浓度同体积的过量盐酸反应15. 一定温度下,向2 L某恒容密闭容器中加入1 mol X气体和2 molY气体,发生如下反应: , 5 min时测得Z的物质的量为1.2 mol,下列说法正确的是( )A、此时Y的浓度为0.6 mol/L B、5 min内v(X)=0.06 mol/(L·min) C、容器内X、Y、Z的浓度之比为1:2:2,则该反应达到平衡状态 D、单位时间消耗0.1 mol X同时生成0.2 mol Z,则该反应达到平衡状态16. 某温度时,在容积为3 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。由图中数据分析,下列结论错误的是( ) A、该反应的化学方程式为2Z+Y3X B、反应开始至2 min末,X的化学反应速率为0.2 mol·L-1·s-1 C、该反应是由正、逆反应同时开始的,最终建立平衡 D、若增加或减少X的物质的量,化学反应速率一定会发生明显的变化
A、该反应的化学方程式为2Z+Y3X B、反应开始至2 min末,X的化学反应速率为0.2 mol·L-1·s-1 C、该反应是由正、逆反应同时开始的,最终建立平衡 D、若增加或减少X的物质的量,化学反应速率一定会发生明显的变化二、填空题
-
17. 下表列出了①~⑤五种元素在周期表中的位置:
族
周期
ⅠA
0
1
①
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
2
②
③
3
④
⑤
⑥
按要求回答下列问题:
(1)、元素⑥的最高正化合价是。(2)、元素⑤在周期表中的位置是。(3)、元素②和元素③的非金属性强弱关系是②③(选填“>”或“<”);表中所列六种元素的单质,常温下为有色气体的是(填化学式)。(4)、①~⑥六种元素中原子半径最大的是(填元素符号)。②③两种元素的最简单氢化物中最稳定的是(填化学式)(5)、元素③与元素④能形成原子个数比为1:1的化合物 Y,Y 在常温下为固态,焰色反应为黄色,常用与呼吸面具中做供氧剂。写出Y与水反应的化学方程式:。18. 按要求回答下列问题:(1)、某同学做如下实验,以检验反应中的能量变化。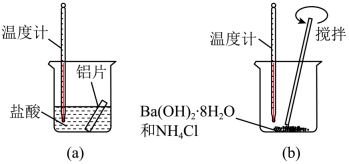
①在实验中发现反应后(a)中温度升高,由此可以判断(a)中反应是热反应,(b)中温度降低,由此可以判断(b)中反应是热反应。
②写出铝与盐酸反应的离子方程式:。
③根据能量守恒定律,(b)中反应物的总能量应该(填“高于”或“低于”)其生成物的总能量。
(2)、如图表示1mol与1mol反应生成2molHCl的能量变化的理论分析示意图。
①化学键断裂需要(填“释放”或“吸收”)能量。
②图中共释放的能量为kJ。
③该反应的反应物的总能量(填“大于”、“等于”或“小于”)生成物的总能量,所以该反应是反应。
19. 在400℃时,将一定量的A和14molB压入一个盛有催化剂的10L密闭容器中进行反应: , 已知2min后,容器中剩余2molA和12molB,按要求回答下列问题:(1)、生成了molC,A的起始物质的量浓度是。(2)、2min内平均反应速率:υ(B)=。(3)、下列能说明该反应已达到平衡状态的是(填字母)。a. b.容器内压强保持不变
c. d.容器内混合气体的密度保持不变
(4)、在密闭容器里,通入amolA(g)、bmolB(g)、cmolC(g),发生上述反应,当改变下列条件时,反应速率会减小的是。a.降低温度 b.加入催化剂 c.增大容器体积
20. 原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。将锌片和铜片插入相同浓度的稀硫酸中,如图所示。按要求回答下列问题: (1)、下列说法正确的是(填字母)。
(1)、下列说法正确的是(填字母)。a.甲、乙均为化学能转变为电能的装置
b.甲中锌片是负极,乙中铜片是正极
c.甲、乙溶液中的pH均增大
d.若将稀硫酸换为硫酸铜溶液,则甲、乙中铜片的质量均增加
(2)、甲、乙中构成原电池的正极电极反应式为 , 原电池工作过程中,电流由(填“铜片”或“锌片”)经导线流向(填“铜片”或“锌片”)。溶液中的向(填“正极”或“负极”)移动。(3)、原电池工作一段时间后,若溶液质量增加3.15g,则放出气体mol。(4)、对甲、乙装置做如下变化后,可形成原电池的是(填字母)。a.甲中铜片换成锌片
b.乙中锌片和铜片相互倾斜至上端接触
c.甲中稀硫酸用乙醇代替
21. 某研究性学习小组设计了一组实验探究影响化学反应速率的因素。按要求回答下列问题:(1)、甲同学在a、b、c三只烧杯里分别加入50mL水,再分别滴加几滴酚酞试液,依次加入大小相近的锂、钠、钾块,观察现象。反应最快最剧烈的烧杯是(填字母)。这说明对不同化学反应,影响其反应速率快慢的主要因素是。(2)、用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,实验过程中气体标准状况下的体积[]与时间(t/min)的关系如图甲所示。根据图像分析,该反应过程中化学反应速率随时间变化的曲线可能是(填字母)。
 (3)、如果将生成的气体通入溶液中(装置如图乙)从而比较碳和硅的非金属性的强弱,则b溶液是 , c溶液是。为了能快速观察到明显现象可以采取的措施是。
(3)、如果将生成的气体通入溶液中(装置如图乙)从而比较碳和硅的非金属性的强弱,则b溶液是 , c溶液是。为了能快速观察到明显现象可以采取的措施是。