湖南省衡阳市2021-2022学年高一下学期期中考试化学试题
试卷更新日期:2022-05-26 类型:期中考试
一、单选题
-
1. 中国传统文化对人类文明贡献巨大。对下列古代文献涉及的化学知识说法错误的是( )A、《格物粗谈》有这样的记载:“红柿摘下未熟,每篮用木瓜三枚放入,得气即发,并无涩昧”,文中的“气”是指乙烯 B、《物理小识》记载“青矾(绿矾)厂气熏人,衣服当之易烂。”青矾厂气是CO和CO2 C、《周易参同契》有对汞的描述:“……得火则飞,不见埃尘。将欲制之,黄芽为根”。其中“黄芽”是指硫 D、《杨柳歌》中名句:“独忆飞絮鹅毛下,非复青丝马尾垂”,其中“飞絮”与“马尾”的主要化学成分分别为纤维素和蛋白质2. 宏观辨识与微观探析是化学学科核心素养之一。下列实验或原理对应的离子方程式书写错误的是( )A、实验室盛放NaOH溶液的试剂瓶用磨砂玻璃塞,可能发生:SiO2+2OH-=SiO+H2O B、亚硫酸钠溶液与足量氯气反应:SO+Cl2+H2O=SO+2Cl-+2H+ C、用醋酸除去水垢中的碳酸钙:CaCO3+2H+=Ca2++CO2↑+H2O D、同物质的量浓度同体积的NH4HSO4溶液与NaOH溶液混合:H++OH-=H2O3. 2022年北京冬奥会火炬“飞扬”(如图)以耐高温碳纤维材料为外壳,铝合金为点火段材料,氢气为燃料,辅以可调节火焰颜色的“配方”。下列说法错误的是( )
 A、碳纤维属于天然高分子材料 B、氢气作燃料对环境友好无污染 C、铝合金密度小、硬度大、耐腐蚀 D、含钾元素的“配方”可使火焰呈紫色4. 现有下列物质:①CH3CH2CH2CH3②
A、碳纤维属于天然高分子材料 B、氢气作燃料对环境友好无污染 C、铝合金密度小、硬度大、耐腐蚀 D、含钾元素的“配方”可使火焰呈紫色4. 现有下列物质:①CH3CH2CH2CH3② ③CH3CH2CH2CH2CH3④
③CH3CH2CH2CH2CH3④ ⑤CH3CH2CH(CH3)2⑥CH3(CH2)3CH3 , 下列说法正确的是( ) A、①和②互为同系物 B、④和⑤互为同分异构体 C、③和⑥为同种物质 D、②的名称为异丙烷5. 光气(COCl2)是一种重要的有机中间体。实验室可用反应CHCl3+H2O2=COCl2↑+HCl+H2O制备光气。下列叙述错误的是( )A、CHCl3的空间结构为正四面体 B、COCl2的电子式为
⑤CH3CH2CH(CH3)2⑥CH3(CH2)3CH3 , 下列说法正确的是( ) A、①和②互为同系物 B、④和⑤互为同分异构体 C、③和⑥为同种物质 D、②的名称为异丙烷5. 光气(COCl2)是一种重要的有机中间体。实验室可用反应CHCl3+H2O2=COCl2↑+HCl+H2O制备光气。下列叙述错误的是( )A、CHCl3的空间结构为正四面体 B、COCl2的电子式为 C、H2O2既含有极性键又有非极性键
D、Cl-比O2-原子核外多一个电子层
6. 聚氯乙烯是生活中常用的塑料的主要化学成分。工业生产聚氯乙烯的一种合成路线如图:
C、H2O2既含有极性键又有非极性键
D、Cl-比O2-原子核外多一个电子层
6. 聚氯乙烯是生活中常用的塑料的主要化学成分。工业生产聚氯乙烯的一种合成路线如图:
下列说法正确的是( )
A、上述反应①为取代反应 B、1,2—二氯乙烷和氯乙烯所有原子均共平面 C、乙烯和聚氯乙烯均能使酸性高锰酸钾溶液褪色 D、乙烯的产量可以用来衡量一个国家石油化学工业的发展水平7. 在一定条件下,向1L密闭容器中进行一定量MgSO4和CO的反应:MgSO4(s)+CO(g)MgO(s)+CO2(g)+SO2(g),反应时间与残留固体质量的关系如图所示。下列说法正确的是( ) A、升高温度时,正反应速率增大,逆反应速率减小 B、在0~10min内,v(CO)=0.010mol·L-1·min-1 C、增加MgSO4的质量时,正反应速率将增大 D、随着反应的进行,混合气体的平均相对分子质量减小8. Ag催化刻蚀Si晶片的反应原理如图所示,刻蚀液由一定浓度的HF和H2O2混合而成,刻蚀时间为2~16min,由Ag薄膜覆盖的部分硅晶片被刻蚀掉,剩余部分就形成了硅纳米线。下列说法错误的是( )
A、升高温度时,正反应速率增大,逆反应速率减小 B、在0~10min内,v(CO)=0.010mol·L-1·min-1 C、增加MgSO4的质量时,正反应速率将增大 D、随着反应的进行,混合气体的平均相对分子质量减小8. Ag催化刻蚀Si晶片的反应原理如图所示,刻蚀液由一定浓度的HF和H2O2混合而成,刻蚀时间为2~16min,由Ag薄膜覆盖的部分硅晶片被刻蚀掉,剩余部分就形成了硅纳米线。下列说法错误的是( ) A、该刻蚀过程利用了原电池原理,Si作负极 B、Ag极发生的反应为H2O2+2e-+2H+=2H2O C、Ag、Si两极附近溶液酸性均增强 D、每刻蚀14gSi,有2mol电子流入Ag电极9. 科学家已获得了气态N4分子,其空间结构为正四面体形(如图所示)。已知断裂1molN—N键吸收193kJ能量,断裂1molN≡N键吸收946kJ能量。下列说法正确的是( )
A、该刻蚀过程利用了原电池原理,Si作负极 B、Ag极发生的反应为H2O2+2e-+2H+=2H2O C、Ag、Si两极附近溶液酸性均增强 D、每刻蚀14gSi,有2mol电子流入Ag电极9. 科学家已获得了气态N4分子,其空间结构为正四面体形(如图所示)。已知断裂1molN—N键吸收193kJ能量,断裂1molN≡N键吸收946kJ能量。下列说法正确的是( ) A、N4(g)=4N(g)的过程中吸收772kJ能量 B、N4属于种新型化合物 C、N4(g)=2N2(g)为吸热反应 D、N4和N2互为同素异形体10. Cl2O起一种高效消毒剂,在0℃时1体积水能溶解100体积以上的Cl2O,与有机物接触时可能爆炸。实验室将Cl2通过HgO粉末制取并收集Cl2O,装置如图所示(部分夹持仪器已省略)。已知:Cl2O的熔点为-116℃沸点为3.8℃,Cl2的沸点为-34.6℃;NH3的熔点为-77.8℃,沸点为-33.5℃;②HgO+2Cl2HgCl2+Cl2O。下列有关该实验的说法错误的是( )
A、N4(g)=4N(g)的过程中吸收772kJ能量 B、N4属于种新型化合物 C、N4(g)=2N2(g)为吸热反应 D、N4和N2互为同素异形体10. Cl2O起一种高效消毒剂,在0℃时1体积水能溶解100体积以上的Cl2O,与有机物接触时可能爆炸。实验室将Cl2通过HgO粉末制取并收集Cl2O,装置如图所示(部分夹持仪器已省略)。已知:Cl2O的熔点为-116℃沸点为3.8℃,Cl2的沸点为-34.6℃;NH3的熔点为-77.8℃,沸点为-33.5℃;②HgO+2Cl2HgCl2+Cl2O。下列有关该实验的说法错误的是( ) A、组装装置时,玻璃导管接口之间尽可能靠近,橡胶塞用锡箔包住 B、装置B中,理论上若参加反应的HCl为4mol,则反应中转移电子的物质的量为2.5mol C、装置D中的试剂为浓硫酸;装置G中的试剂为无水CaCl2 D、装置F中液氨的作用是冷凝,便于收集产品Cl2O并使其与Cl2分离11. 某科研小组用氧化—沉淀法从废电池浸出液中去除铁;用MnO2氧化废电池浸出液中的Fe2+ , 再加适量Na2CO3调节溶液pH使Fe3+转化为沉淀[Fe(OH)3],同时放出一种无色气体(CO2)。研究发现pH对Fe2+的氧化率和铁去除率的影响如图1和图2所示。
A、组装装置时,玻璃导管接口之间尽可能靠近,橡胶塞用锡箔包住 B、装置B中,理论上若参加反应的HCl为4mol,则反应中转移电子的物质的量为2.5mol C、装置D中的试剂为浓硫酸;装置G中的试剂为无水CaCl2 D、装置F中液氨的作用是冷凝,便于收集产品Cl2O并使其与Cl2分离11. 某科研小组用氧化—沉淀法从废电池浸出液中去除铁;用MnO2氧化废电池浸出液中的Fe2+ , 再加适量Na2CO3调节溶液pH使Fe3+转化为沉淀[Fe(OH)3],同时放出一种无色气体(CO2)。研究发现pH对Fe2+的氧化率和铁去除率的影响如图1和图2所示。
已知:
I.pH=-lgc(H+);II.酸性条件下MnO2被还原为Mn2+。
下列说法错误的是( )
A、若起始浸出液pH=1.0,MnO2与Fe2+反应一段时间后,浸出液pH会减小 B、由图1可知,Fe2+氧化率随浸出液pH增大而减小 C、Fe3+转变为沉淀的离子方程式为:2Fe3++3CO+3H2O=2Fe(OH)3↓+3CO2↑ D、若用氨水调节溶液pH也可以使Fe3+转化为沉淀二、多选题
-
12. 我国科技的发展日新月异。下列对我国最新科技成果解读正确的是( )
选项
科技成果
解读
A
2021年首次实现As2O3“仿生递送”治疗白血病
As2O3是两性氧化物
B
北京冬奥会国家速滑馆是应用二氧化碳跨临界直冷制冰技术的大型冰雪运动场馆
液态二氧化碳汽化时吸热降温制冰
C
北京冬奥会全部场馆采用光伏发电实现绿色供电
光伏发电电池板主要材料是SiO2
D
室温下,在Pt/CoNi催化下实现CO的高效氧化
催化剂能加快化学反应速率
A、A B、B C、C D、D13. 向含有amolCu2O和bmolCuO的混合物中加入20mL5mol·L-1的稀硝酸,固体恰好完全溶解,得到标准状况下224mL气体(纯净物)。已知NA为阿伏加德罗常数的值。下列说法正确的是( )A、a:b=1:1 B、反应过程中转移的电子数目为0.01NA C、将过量铁粉投入该稀硝酸中生成Fe(NO3)2 D、被还原的硝酸为0.07mol14. A、B、M、D、E为短周期主族元素,且原子序数依次增大,质子数之和为39,B、M同周期,A、D同主族,A为短周期原子半径最小的元素。M原子最外层电子数为次外层的3倍,A、M常温下能形成两种液态化合物A2M和A2M2 , E元素的周期数与主族序数相等。下列说法错误的是( )A、B元素在元素周期表中的位置为第二周期IVA族 B、A2M分子的空间结构为直线形 C、D,E,M形成的简单离子的半径从大到小的顺序为M>D>E D、将0.1molDA加入足量的水中,充分反应后生成的气体的体积为2.24L三、综合题
-
15. 如表是A、B、C三种烃的有关信息。
A
B
C
①球棍模型为

②能和Cl2在光照条件下反应生成多种氯代物
①能使溴水褪色
②标准状况下,气体密度为1.25g•L-1
①能使溴水褐色
②1molC能和2molH2发生加成反应
③空间充填模型为
 (1)、烃分子C的空间结构为。(2)、三种烃中,和甲烷互为同系物的是(填结构简式,下同);完全燃绕,生成CO2和H2O的物质的量之比为1:1的是。(3)、烃B能使溴水褪色,其原因为(用化学方程式表示),反应类型为。(4)、已知B和C具有相似的化学性质,将烃C通入少量酸性KMnO4溶液中的现象是。16. 查阅资料可知:
(1)、烃分子C的空间结构为。(2)、三种烃中,和甲烷互为同系物的是(填结构简式,下同);完全燃绕,生成CO2和H2O的物质的量之比为1:1的是。(3)、烃B能使溴水褪色,其原因为(用化学方程式表示),反应类型为。(4)、已知B和C具有相似的化学性质,将烃C通入少量酸性KMnO4溶液中的现象是。16. 查阅资料可知:I.碳化铝(Al4C3)与水反应可制得CH4。
II.银氨溶液{含[Ag(NH3)2]+、OH-与CO反应产生银镜(Ag)。
III.CH4被CuO氧化的氧化产物为CO和CO2。
某学习小组对III表示质疑并在老师的指导下进行实验探究。回答下列问题:
 (1)、写出甲装置中反应的化学方程式。(2)、该实验装置的接口连接顺序为(填字母),连接好装置后,进行的第一步实验操作为。(3)、乙装置的作用是 , 丙中实验现象是。(4)、若丁、戊两装置中出现了特征实验现象,则说明反应产生了(填化学式)。综合以上实验现象,CH4和CuO的反应还有一种产物没有检验,若要检验该产物,应。17. 近日IPCC发布了由来自40个国家的91位科学家编写的《全球升温1.5℃特别报告》,报告表明:温室效应引发的环境问题日益严重,CO2的减排和综合利用是解决温室效应及能源问题的有效途径,将CO2转化成有机物可有效实现碳循环。在容积为2L的恒温恒容密闭容器中,充入3molCO2和9molH2 , 一定条件下发生反应CO2(g)+3H2(g)CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的物质的量随时间变化情况如表所示,并根据数据绘制图像如图(已知相同条件下气体的压强之比等于物质的量之比):
(1)、写出甲装置中反应的化学方程式。(2)、该实验装置的接口连接顺序为(填字母),连接好装置后,进行的第一步实验操作为。(3)、乙装置的作用是 , 丙中实验现象是。(4)、若丁、戊两装置中出现了特征实验现象,则说明反应产生了(填化学式)。综合以上实验现象,CH4和CuO的反应还有一种产物没有检验,若要检验该产物,应。17. 近日IPCC发布了由来自40个国家的91位科学家编写的《全球升温1.5℃特别报告》,报告表明:温室效应引发的环境问题日益严重,CO2的减排和综合利用是解决温室效应及能源问题的有效途径,将CO2转化成有机物可有效实现碳循环。在容积为2L的恒温恒容密闭容器中,充入3molCO2和9molH2 , 一定条件下发生反应CO2(g)+3H2(g)CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的物质的量随时间变化情况如表所示,并根据数据绘制图像如图(已知相同条件下气体的压强之比等于物质的量之比):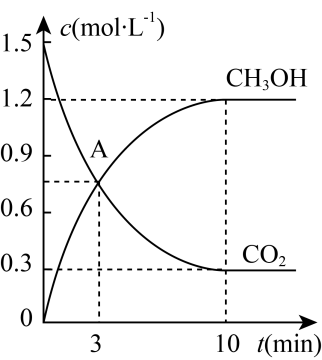
时间
0min
3min
6min
10min
12min
n(CH3OH)/mol
0
1.5
2.1
2.4
2.4
n(CO2)/mol
3
1.5
0.9
a
0.6
回答下列问题:
(1)、a=;A点(填“是”或“不是”)化学平衡状态。(2)、5min时,正反应速率(填“>”、“<”或“=”)逆反应速率。(3)、相同条件下,10min时体系的压强与开始反应时的压强之比为。(4)、为提高此反应的速率,下列措施可行的是____(填字母代号)。A、恒容时充入氦气 B、降低温度 C、使用合适的催化剂 D、移出CO2(5)、该反应的能量变化关系如图所示:
该反应属于(填“放热”或“吸热”)反应。
(6)、所得的CH3OH可以作燃料电池的燃料。CH3OH燃料电池是目前开发最成功的燃料电池之一,从节约能源和保护生态环境的角度来看是很有发展前途的发电技术。CH3OH燃料电池由CH3OH、空气(氧气)、KOH(电解质溶液)构成。下列说法正确的是____(填字母代号)。已知:该燃料电池的总反应为2CH3OH+3O2+4OH-=2CO+6H2O
A、电池放电时,通入空气的电极为负极 B、电池放电时,电解质溶液的碱性逐渐减弱 C、电池放电时,理论上每消耗6.4gCH3OH转移1.2mol电子 D、负极的电极反应式为CH3OH-6e-+H2O=CO2+6H+18. 物质的类别和核心元素的价态是学习研究物质性质的两个重要角度。根据硫元素的价类二维图回答下列问题: (1)、Z为钠的正盐,在反应中既可作氧化剂,又可作还原剂。当Z作氧化剂时,理论上可被还原为____(填字母)。A、Na2S B、S C、H2SO4 D、Na2SO4(2)、W的浓溶液与碳单质在加热条件下发生反应的化学方程式为 , 反应中W表现的性质为。(3)、若将Y气体通入足量的稀硝酸钡溶液中有白色沉淀生成,再滴入稀盐酸,沉淀无明显变化。请写出该反应的离子方程式:。(4)、集居民区靠近硫酸工厂,为监测该居民区的空气中Y的含量是否超标(已知居民区的空气中Y的含量不超过0.15mg/m3),某化学小组进行如下实验:取标准状况下的空气20.00mL(含N2、O2、CO2、SO2等),缓慢通入足量氯水中,在所得溶液中加入稍过量的BaCl2溶液,产生白色沉淀,过能后将沉淀洗涤、干燥,称得其质量为0.233g。
(1)、Z为钠的正盐,在反应中既可作氧化剂,又可作还原剂。当Z作氧化剂时,理论上可被还原为____(填字母)。A、Na2S B、S C、H2SO4 D、Na2SO4(2)、W的浓溶液与碳单质在加热条件下发生反应的化学方程式为 , 反应中W表现的性质为。(3)、若将Y气体通入足量的稀硝酸钡溶液中有白色沉淀生成,再滴入稀盐酸,沉淀无明显变化。请写出该反应的离子方程式:。(4)、集居民区靠近硫酸工厂,为监测该居民区的空气中Y的含量是否超标(已知居民区的空气中Y的含量不超过0.15mg/m3),某化学小组进行如下实验:取标准状况下的空气20.00mL(含N2、O2、CO2、SO2等),缓慢通入足量氯水中,在所得溶液中加入稍过量的BaCl2溶液,产生白色沉淀,过能后将沉淀洗涤、干燥,称得其质量为0.233g。①将上述空气缓慢通入足量氯水后所得溶液的pH(填“增大”或“减小)。
②检验沉淀是否洗涤干净的方法是。
③通过计算得出:该居民区的空气中Y的含量超标(填“已”或“未”)。