北京市丰台区2021-2022学年高一下学期期中考试化学试题(B卷)
试卷更新日期:2022-05-26 类型:期中考试
一、单选题
-
1. 下列能量的转化过程中,由化学能转化为电能的是( )
A
B
C
D




太阳能集热
燃气燃烧
风力发电
手机电池工作
A、A B、B C、C D、D2. 下列物质不属于有机化合物的是( )A、酒精 B、甲烷 C、次氯酸钠 D、四氯化碳3. 下列元素中,非金属性最强的是( )A、C B、N C、O D、F4. 下列元素的原子半径最小的是( )A、Na B、Mg C、Al D、Cl5. 某元素原子的结构示意图为 。下列关于该元素或原子的说法中,正确的是( ) A、元素符号是Ne B、在周期表中的位置是第三周期、IA族 C、在化学反应中易得电子 D、原子半径小于Mg6. 下列物质中,含离子键的是( )A、CO2 B、KCl C、H2O D、Cl27. 高铁车厢中安装的烟雾传感器中有一个放有镅()放射源的电离室。下列关于的说法错误的是( )
。下列关于该元素或原子的说法中,正确的是( ) A、元素符号是Ne B、在周期表中的位置是第三周期、IA族 C、在化学反应中易得电子 D、原子半径小于Mg6. 下列物质中,含离子键的是( )A、CO2 B、KCl C、H2O D、Cl27. 高铁车厢中安装的烟雾传感器中有一个放有镅()放射源的电离室。下列关于的说法错误的是( ) A、核外电子数为146 B、质量数为241 C、质子数为95 D、中子数为1468. 下列有机化合物中,不属于烃的是( )A、CH4 B、CH2=CH2 C、C6H6 D、CH3COOH9. 下列分子中,含羟基的是( )A、C2H6 B、C2H4 C、C2H2 D、C2H5OH10. 下列物质属于共价化合物的是( )A、H2 B、H2O C、KCl D、NaOH11. 下列对化学用语的描述中,错误的是( )A、硫离子的结构示意图:
A、核外电子数为146 B、质量数为241 C、质子数为95 D、中子数为1468. 下列有机化合物中,不属于烃的是( )A、CH4 B、CH2=CH2 C、C6H6 D、CH3COOH9. 下列分子中,含羟基的是( )A、C2H6 B、C2H4 C、C2H2 D、C2H5OH10. 下列物质属于共价化合物的是( )A、H2 B、H2O C、KCl D、NaOH11. 下列对化学用语的描述中,错误的是( )A、硫离子的结构示意图: B、Bi和Bi互为同位素
C、由H和Cl形成HCl的过程:
B、Bi和Bi互为同位素
C、由H和Cl形成HCl的过程: D、由Na和Cl形成NaCl的过程:
D、由Na和Cl形成NaCl的过程: 12. 下列属于吸热反应的是( )A、镁条与盐酸反应 B、氢氧化钠和稀硫酸反应 C、氢气在氯气中点燃 D、碳酸氢钠和柠檬酸反应13. 在一定条件下的密闭容器中,进行可逆反应:。下列说法中,能说明该反应已经达到化学平衡状态的是( )A、、、的浓度均不再变化 B、、、三者的浓度相等 C、、、在容器中共存 D、正、逆化学反应速率均为014. 下列表示化学反应2H2(g)+ O2(g)= 2H2O(g)过程能量变化的示意图中,合理的是( )A、
12. 下列属于吸热反应的是( )A、镁条与盐酸反应 B、氢氧化钠和稀硫酸反应 C、氢气在氯气中点燃 D、碳酸氢钠和柠檬酸反应13. 在一定条件下的密闭容器中,进行可逆反应:。下列说法中,能说明该反应已经达到化学平衡状态的是( )A、、、的浓度均不再变化 B、、、三者的浓度相等 C、、、在容器中共存 D、正、逆化学反应速率均为014. 下列表示化学反应2H2(g)+ O2(g)= 2H2O(g)过程能量变化的示意图中,合理的是( )A、 B、
B、 C、
C、 D、
D、 15. 变量控制是科学研究的重要方法。相同质量的锌粒与相同体积的硫酸分别在下列条件下发生反应,开始阶段化学反应速率最大的是( )
15. 变量控制是科学研究的重要方法。相同质量的锌粒与相同体积的硫酸分别在下列条件下发生反应,开始阶段化学反应速率最大的是( )选项
A
B
C
D
c(H2SO4)/ (mol·L-1)
1
1
2
2
实验温度/ ℃
20
40
20
40
A、A B、B C、C D、D16. 下列关于化学反应与能量变化的说法中,错误的是( )A、放热反应都是不需要加热条件的 B、能量变化是化学反应的基本特征之一 C、化学键的断裂与形成是化学反应中能量变化的主要原因 D、反应物的总能量高于生成物的总能量,发生反应时能够向环境放出能量17. 如图为一种氢氧燃料电池的装置示意图,下列说法错误的是( ) A、该装置中氧化反应和还原反应在不同区域进行 B、石墨是电极材料 C、O2是正极反应物、H2是负极反应物 D、H2SO4可以传导电子和离子18. 下列化合物中,与CH3CH2CH2CH2CH3互为同分异构体的是( )A、CH4 B、CH2=CH2 C、CH3CH3 D、
A、该装置中氧化反应和还原反应在不同区域进行 B、石墨是电极材料 C、O2是正极反应物、H2是负极反应物 D、H2SO4可以传导电子和离子18. 下列化合物中,与CH3CH2CH2CH2CH3互为同分异构体的是( )A、CH4 B、CH2=CH2 C、CH3CH3 D、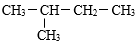 19. 从海带中提取碘涉及到下列操作步骤,其中错误的是( )A、
19. 从海带中提取碘涉及到下列操作步骤,其中错误的是( )A、 将海带灼烧成灰
B、
将海带灼烧成灰
B、 过滤得含的溶液
C、
过滤得含的溶液
C、 向滤液中加稀和溶液
D、
向滤液中加稀和溶液
D、 加入 , 萃取
20. 关于如图的说法错误的是( )
加入 , 萃取
20. 关于如图的说法错误的是( ) A、I2(g)与H2(g)生成2HI(g)的反应是吸热反应 B、2molHI(g)分解生成1molI2(g)与1molH2(g)时,需要吸收12kJ的能量 C、1molI2(s)变为1molI2(g)时需要吸收17kJ的能量 D、1molI2(s)与1molH2(g)化合生成2molHI(g)时,需要吸收5kJ的能量21. 下列制作热干面的主要操作中,属于过滤的是( )
A、I2(g)与H2(g)生成2HI(g)的反应是吸热反应 B、2molHI(g)分解生成1molI2(g)与1molH2(g)时,需要吸收12kJ的能量 C、1molI2(s)变为1molI2(g)时需要吸收17kJ的能量 D、1molI2(s)与1molH2(g)化合生成2molHI(g)时,需要吸收5kJ的能量21. 下列制作热干面的主要操作中,属于过滤的是( )A.调酱
B.煮面
C.捞面
D.拌面



 A、A B、B C、C D、D22. 已知X、Y、Z、W四种短周期元素在周期表中的相对位置如图所示,下列说法错误的是( )
A、A B、B C、C D、D22. 已知X、Y、Z、W四种短周期元素在周期表中的相对位置如图所示,下列说法错误的是( ) A、Z元素的原子半径比Y元素的大 B、若Y的最低化合价为-2,则W的最高正化合价为+6 C、若Z的最高正化合价为+5,则X元素的化合物种类最多 D、若Z的最高价氧化物对应水化物为强酸,则Y是活泼非金属元素23. 根据元素周期律,由下列事实进行归纳推测,推测不合理的是( )
A、Z元素的原子半径比Y元素的大 B、若Y的最低化合价为-2,则W的最高正化合价为+6 C、若Z的最高正化合价为+5,则X元素的化合物种类最多 D、若Z的最高价氧化物对应水化物为强酸,则Y是活泼非金属元素23. 根据元素周期律,由下列事实进行归纳推测,推测不合理的是( )选项
事实
推测
A
Mg与冷水较难反应,Ca与冷水较易反应
Be(铍)与冷水更难反应
B
Na与Cl形成离子键,Al与Cl形成共价键
Si与Cl形成共价键
C
HCl在1500℃时分解,HI在230℃时分解
HBr的分解温度介于二者之间
D
随核电荷数递增,第ⅠA族元素单质的沸点逐渐降低
随核电荷数递增,第ⅦA族元素单质的沸点也逐渐降低
A、A B、B C、C D、D24. N2转化为NH3的微观过程示意图如图。下列说法中,错误的是( ) A、催化剂能改变该反应速率 B、在催化剂表面形成氮氢键时,有电子转移 C、催化剂表面只发生了极性共价键的断裂和形成 D、氮氮键断裂时需要吸收能量25. Fe和Mg与H2SO4反应的实验记录如下:
A、催化剂能改变该反应速率 B、在催化剂表面形成氮氢键时,有电子转移 C、催化剂表面只发生了极性共价键的断裂和形成 D、氮氮键断裂时需要吸收能量25. Fe和Mg与H2SO4反应的实验记录如下:实验




现象
Fe表面产生大量无色气泡
Fe表面产生少量气泡后迅速停止
Mg表面迅速产生大量气泡
Fe表面有大量气泡,Mg表面有少量气泡
关于上述实验说法不合理的是( )
A、Ⅰ中产生气体的原因是:Fe+2H+=Fe2++H2↑ B、取出Ⅱ中的铁棒放入CuSO4溶液立即析出亮红色固体 C、Ⅲ中现象说明Mg在浓H2SO4中没被钝化 D、Ⅳ中现象说明Mg的金属性比Fe强二、综合题
-
26. 如表是元素周期表的一部分,请参照元素①~⑨在表中的位置,回答下列问题:
 (1)、⑥在元素周期表中的位置是;②、③、④三种元素的原子半径最小的是(填元素符号)。③和④的气态氢化物中稳定性更强的是(填化学式)。(2)、写出①和②形成的一种化合物的电子式。(3)、⑤和⑦分别形成的最高价氧化物对应的水化物发生反应的离子方程式是。(4)、④和⑨分别形成的简单阴离子还原性较弱的是(填离子符号)。(5)、⑤和⑥分别形成的简单离子的半径为>(填离子符号)。(6)、砷(As)与②同主族,下列推断正确的是(填序号)。
(1)、⑥在元素周期表中的位置是;②、③、④三种元素的原子半径最小的是(填元素符号)。③和④的气态氢化物中稳定性更强的是(填化学式)。(2)、写出①和②形成的一种化合物的电子式。(3)、⑤和⑦分别形成的最高价氧化物对应的水化物发生反应的离子方程式是。(4)、④和⑨分别形成的简单阴离子还原性较弱的是(填离子符号)。(5)、⑤和⑥分别形成的简单离子的半径为>(填离子符号)。(6)、砷(As)与②同主族,下列推断正确的是(填序号)。a.砷元素的最低负化合价为-3
b.热稳定性:AsH3>NH3
c.最高价氧化物对应的水化物的酸性:HClO4>H3AsO4
(7)、设计实验方案证明⑧和⑨的非金属性强弱:。27. 化学电池的发明,是贮能和供能技术的巨大进步。(1)、如图所示装置的总反应的离子方程式是。其中铜片是(填“正极”或“负极”),该电极的反应式为。 (2)、能证明该装置将反应释放的能量转化为电能的实验现象是:、。(3)、外电路中,电子从电极流出(填“Zn”或“Cu”)。(4)、汽车尾气中NO含量可通过NO传感器监测,工作原理如图:
(2)、能证明该装置将反应释放的能量转化为电能的实验现象是:、。(3)、外电路中,电子从电极流出(填“Zn”或“Cu”)。(4)、汽车尾气中NO含量可通过NO传感器监测,工作原理如图:
①NiO电极是(填“正”或“负”)极。
②Pt电极上的电极反应式为。
28. 500℃时,在2L的密闭容器中,SO2和足量的O2在催化剂的条件下发生反应:2SO2+O22SO3。SO2和SO3的物质的量随时间变化的关系曲线如图所示。回答下列问题。 (1)、在前5min内,以SO2的浓度变化表示的化学反应速率是mol/(L·min)。加快反应速率的措施有(至少提出两条)。(2)、该反应在(填2或5)min达到限度。(3)、反应达到平衡状态的依据是____。A、单位时间内消耗1molSO2 , 同时生成1molSO3 B、SO2的浓度与SO3浓度相等 C、SO2的浓度与SO3浓度均不再变化(4)、用微观示意图的形式表示上述反应:。
(1)、在前5min内,以SO2的浓度变化表示的化学反应速率是mol/(L·min)。加快反应速率的措施有(至少提出两条)。(2)、该反应在(填2或5)min达到限度。(3)、反应达到平衡状态的依据是____。A、单位时间内消耗1molSO2 , 同时生成1molSO3 B、SO2的浓度与SO3浓度相等 C、SO2的浓度与SO3浓度均不再变化(4)、用微观示意图的形式表示上述反应:。 29. 海洋是巨大的化学资源宝库,如图是从海水中提取溴的流程图(部分)。
29. 海洋是巨大的化学资源宝库,如图是从海水中提取溴的流程图(部分)。 (1)、过程1发生反应的离子方程式是。该反应可证明氧化性:Cl2Br2(填“>”、“<”或者“=”),从原子结构角度解释原因。(2)、写出过程2中发生的主要反应的化学方程式:。(3)、上述过程2中将Br2转化成Br-的目的是。(4)、若过程2用Na2CO3溶液吸收溴,补全方程式:。
(1)、过程1发生反应的离子方程式是。该反应可证明氧化性:Cl2Br2(填“>”、“<”或者“=”),从原子结构角度解释原因。(2)、写出过程2中发生的主要反应的化学方程式:。(3)、上述过程2中将Br2转化成Br-的目的是。(4)、若过程2用Na2CO3溶液吸收溴,补全方程式:。3Br2+ Na2CO3+ H2O= NaBr+ NaBrO3+ NaHCO3
反应中消耗3molBr2转移电子的物质的量为。
三、实验题
-
30. 某小组同学探究FeCl3溶液与KI溶液的反应是否存在限度。
【查阅资料】a.Fe3+能将I-氧化为I2 , 所得溶液呈黄色或棕黄色。
b.利用色度计可测定溶液的透光率,通常溶液颜色越深,透光率数值越小。
【实验过程】

用图1所示装置进行如表所示的3个实验。
序号
实验步骤1
实验步骤2
实验I
将盛有2mL蒸馏水的比色皿放入色度计的槽孔中
向比色皿中逐滴滴入5滴(每滴约0.025mL)0.1mol·L-1FeCl3溶液,同时采集上述过程中溶液的透光率数据
实验II
将盛有2mL0.05mol·L-1KI溶液的比色皿放入色度计的槽孔中
同上
实验III
将盛有a mL0.1mol·L-1KI溶液的比色皿放入色度计的槽孔中
同上
实验数据:

【分析与解释】
(1)、实验I的目的是。(2)、实验III中a=。(3)、通过上述实验可推断:FeCl3溶液与KI溶液的反应存在限度。其证据及相应的推理过程是。(4)、FeCl3溶液与KI溶液反应的离子方程式为。