云南省名校联盟2021-2022学年高一下学期期中考试化学试题
试卷更新日期:2022-05-24 类型:期中考试
一、单选题
-
1. 科技元素已成为2022年北京冬奥会的一大亮点。下列涉及的材料不属于无机非金属材料的是( )
A
B
C
D




使用双向拉伸聚丙烯(塑料)制作的冬奥纪念钞
石英碱长正长岩制作的冰壶
“飞扬”火炬的碳纤维外壳
柔性石墨烯发热材料制作的防寒衣服
A、A B、B C、C D、D2. 下列诗句或成语中包含的化学变化属于吸热反应的是( )A、烈火焚烧若等闲 B、火上浇油 C、爆竹声中一岁除 D、蜡炬成灰泪始干3. 下列化合物中仅含离子键不含共价键的是( )A、 B、 C、 D、4. 从高温热浪到暴雨洪水,近年来全球多地频频遭遇罕见极端天气,造成重大损失。加强气候适应、应对气象灾害成为人类社会需要共同研究的重要课题。下列有关说法正确的是( )A、氮氧化物、硫氧化物的排放会导致酸雨(即pH<7的雨水)的形成 B、燃煤中加入石灰石,可以减少SO2、CO2等污染环境的气体排放 C、汽车使用的燃油质量越高,排放的汽车尾气中NO、NO2的含量越少 D、大力发展太阳能、风能、核能等,有助于改善空气质量5. 硫单质能与许多金属单质和非金属单质发生反应。下列说法正确的是( )A、硫蒸气与红热的铁丝反应后,残留的硫可用二硫化碳洗涤 B、硫蒸气与红热的铜丝反应生成黑色的CuS固体 C、硫单质在化合反应中只体现氧化性 D、硫元素广泛存在于自然界中,火山口附近的环境中硫元素只以游离态形式存在6. 据研究,NO广泛分布于生物体内各组织中,可将积存在血管壁上的脂肪、胆固醇带走,被称为“血管清道夫”。下列说法中错误的是( )A、NO极易与氧气反应生成一种红棕色气体 B、实验室中,可利用铜与稀硝酸的反应制取NO C、人体吸入大量NO气体,可以预防心血管疾病 D、雷雨天气,氮气和氧气能生成NO7. 下列实验事实与硫酸性质不对应的一组是( )A、稀硫酸能使紫色石蕊溶液变红——酸性 B、浓硫酸久置于空气中浓度降低——脱水性 C、浓硫酸可用于干燥氧气——吸水性 D、铁粉与热的浓硫酸反应放出二氧化硫——强氧化性和酸性8. 实验室制取氨气并验证其化学性质和用途,图中装置对应的说法正确的是( )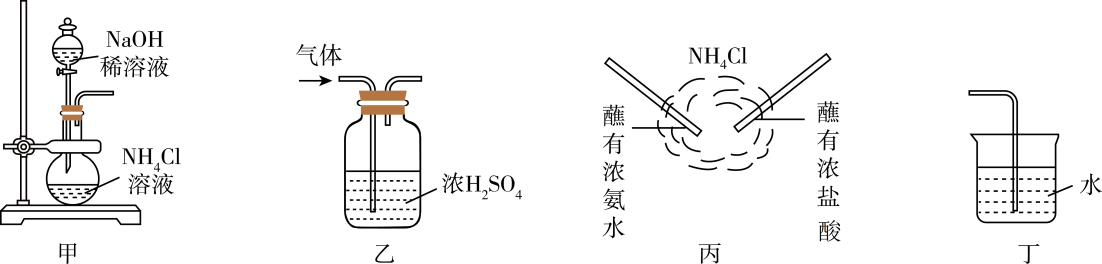 A、可利用装置甲制取大量氨气 B、可利用装置乙干燥氨气 C、根据装置丙的原理和现象,可用浓氨水检验氯气管道是否漏气 D、利用装置丁可吸收氨气并防倒吸9. 类比是研究物质性质常用的方法之一、下列类比错误的是( )A、由与水反应生成NaOH,推测与水反应生成KOH B、由可与水反应生成HCl和HClO,推测可与水反应生成HBr和HBrO C、由Mg可以置换出溶液中的铜,推测Na可以置换出溶液中的铜 D、由能与NaOH溶液反应,推测能与NaOH溶液反应10. 结合化学反应与能量的知识,下列说法正确的是( )
A、可利用装置甲制取大量氨气 B、可利用装置乙干燥氨气 C、根据装置丙的原理和现象,可用浓氨水检验氯气管道是否漏气 D、利用装置丁可吸收氨气并防倒吸9. 类比是研究物质性质常用的方法之一、下列类比错误的是( )A、由与水反应生成NaOH,推测与水反应生成KOH B、由可与水反应生成HCl和HClO,推测可与水反应生成HBr和HBrO C、由Mg可以置换出溶液中的铜,推测Na可以置换出溶液中的铜 D、由能与NaOH溶液反应,推测能与NaOH溶液反应10. 结合化学反应与能量的知识,下列说法正确的是( ) A、图Ⅰ所示装置能将化学能转化为电能 B、通常,伴有能量变化的物质变化都是化学变化 C、能量变化符合图Ⅱ所示的化学反应是放热反应 D、断裂化学键会吸收能量,形成化学键会放出能量11. 下列化学反应对应的离子方程式书写正确的是( )A、将溴水滴加到Na2SO3溶液中: B、Fe和稀盐酸反应: C、硫酸铜和氢氧化钡溶液反应: D、用高锰酸钾与盐酸反应制取少量氯气:12. 某同学以大小相同的铜片和锌片为电极研究水果电池,得到的实验数据如表所示:
A、图Ⅰ所示装置能将化学能转化为电能 B、通常,伴有能量变化的物质变化都是化学变化 C、能量变化符合图Ⅱ所示的化学反应是放热反应 D、断裂化学键会吸收能量,形成化学键会放出能量11. 下列化学反应对应的离子方程式书写正确的是( )A、将溴水滴加到Na2SO3溶液中: B、Fe和稀盐酸反应: C、硫酸铜和氢氧化钡溶液反应: D、用高锰酸钾与盐酸反应制取少量氯气:12. 某同学以大小相同的铜片和锌片为电极研究水果电池,得到的实验数据如表所示:实验编号
水果种类
电极间距离/cm
电流/
①
番茄
1
98.7
②
番茄
2
72.5
③
苹果
2
27.2
下列说法错误的是( )
A、电流从铜片经外电路流向锌片 B、实验②和③探究的是水果种类对电流的影响 C、实验①和③探究的是电极间距离对电流的影响 D、锌片上发生氧化反应,锌片作水果电池的负极13. 氮及其化合物在催化剂作用下的转化过程中的能量变化及机理如图,下列分析正确的是( ) A、过程Ⅰ、Ⅱ均属于氮的固定 B、由图可知,过程Ⅰ发生的总反应为放热反应 C、过程Ⅱ中,在催化剂b表面被氧化的过程中没有能量变化 D、过程Ⅱ中,发生反应的化学方程式为14. 常温下,某同学用25 mL0.2 mol/L酸性KMnO4溶液测定1 L某混合气体中SO2的含量,酸性KMnO4溶液恰好被完全消耗,设其他气体不参与反应且不含硫元素,忽略反应前后溶液的体积变化。下列说法正确的是( )A、该混合气体中SO2的体积分数为28% B、反应过程中转移的电子数为0.25NA C、氧化剂与还原剂的物质的量之比为5:2 D、完全反应后,溶液中含硫元素的离子的浓度为0.5 mol/L15. 某学习小组根据反应 , 设计实验探究硫代硫酸钠溶液的浓度和温度对反应速率的影响,实验数据如表(已知起始加入的稀硫酸的体积相等)。下列叙述错误的是( )
A、过程Ⅰ、Ⅱ均属于氮的固定 B、由图可知,过程Ⅰ发生的总反应为放热反应 C、过程Ⅱ中,在催化剂b表面被氧化的过程中没有能量变化 D、过程Ⅱ中,发生反应的化学方程式为14. 常温下,某同学用25 mL0.2 mol/L酸性KMnO4溶液测定1 L某混合气体中SO2的含量,酸性KMnO4溶液恰好被完全消耗,设其他气体不参与反应且不含硫元素,忽略反应前后溶液的体积变化。下列说法正确的是( )A、该混合气体中SO2的体积分数为28% B、反应过程中转移的电子数为0.25NA C、氧化剂与还原剂的物质的量之比为5:2 D、完全反应后,溶液中含硫元素的离子的浓度为0.5 mol/L15. 某学习小组根据反应 , 设计实验探究硫代硫酸钠溶液的浓度和温度对反应速率的影响,实验数据如表(已知起始加入的稀硫酸的体积相等)。下列叙述错误的是( )实验编号
反应温度/
稀硫酸的体积/
硫代硫酸钠溶液的体积/ mL
加入的水的体积/mL
产生等量的沉淀所需时间/s
①
20
2
1
V1
t1
②
30
V2
1
2
t2
③
30
V3
2
V4
t3
A、 B、 C、 D、16. 现有部分被氧化的Fe、Cu混合物(氧化物为Fe2O3、CuO)样品共5.60 g,经如下处理:
下列说法正确的是( )
A、V= 672 B、滤液A中的阳离子为Fe2+、Fe3+、H+ C、样品中氧元素的物质的量为0. 02 mol D、溶解样品的过程中消耗硫酸的总物质的量为0.05 mol二、填空题
-
17. 在微电子工业中,作为一种优良的蚀刻气体,在被蚀刻物表面不会留下任何残留物,在芯片制造方面具有重要的应用。已知:键能是指断裂或形成化学键时需要吸收或放出的能量。请回答下列问题:
化学键
F−F
N−F
键能/
941.7
154.8
283.0
(1)、几种化学键的键能如表,则、和三种气体中,稳定性最强的物质为(填化学式),判断的依据为;反应生成时,会(填“吸收”或“放出”)kJ能量(2)、根据上述数据,反应的能量变化与反应进程的关系如图,图中表示的能量是(填“a”、“b”或“c”);除选用合适的催化剂加快化学反应速率,还可以采取的措施为、(请任写两条) 18. 为了更好地利用化学反应中的物质变化和能量变化,在化学研究和工业生产中还需要关注化学反应的快慢和进行的程度等。(1)、Ⅰ.某同学设计如图1所示实验,根据所学知识回答下列问题:
18. 为了更好地利用化学反应中的物质变化和能量变化,在化学研究和工业生产中还需要关注化学反应的快慢和进行的程度等。(1)、Ⅰ.某同学设计如图1所示实验,根据所学知识回答下列问题:
将锌锰干电池与灵敏电流计相连接后,灵敏电流计的指针偏转方向如甲所示。乙中灵敏电流计的指针偏向(填“Cu电极”或“Zn电极”);丙中灵敏电流计的指针偏向(填“Al电极”或“Mg电极”),负极发生的电极反应式为 , 电子流动方向为
(2)、Ⅱ.时,向2L的恒容密闭容器中,充入和使之发生反应 , 测得各物质的物质的量浓度变化如图2所示:
由图2可知,的浓度随时间的变化为曲线(填“a”、“b”或“c”);内,的平均反应速率为。
(3)、已知:反应至时,改变了某一反应条件。由图2可知,内的生成速率(填“大于”、“小于”或“等于”)内的生成速率。(4)、时,的转化率(反应时消耗的物质的量占起始投入的物质的量的百分比)为 , 此时容器内气体总压强与反应前容器内气体总压强之比为。19. 硫酸铁常用作媒染剂以及工业废水的凝结剂,也用于颜料中。医学上用硫酸铁作收敛剂和止血剂。(1)、硫酸铁可用于电化浸出黄铜矿精矿工艺,其中有一主要反应:(中为+2价)。下列说法正确的是____(填标号)A、从物质分类的角度看,黄铜矿属于合金 B、和S是氧化产物 C、当转移电子时,有参加反应 D、反应中,既作氧化剂又作还原剂(2)、某小组按照如图步骤从含、、的废液中回收金属铜,并重新获得溶液:
操作Ⅰ的名称为 , 滤渣③的主要成分为(填化学式),试剂X常用而不用稀硝酸,其原因为。
(3)、实验室里保存溶液时,常在溶液中加入 , 其目的为。(4)、实验室配制溶液时,为了防止水解,需要将溶于稀硫酸中,再加水稀释。现需配制溶液,需要用托盘天平称量晶体,配制该溶液所需玻璃仪器除了烧杯、玻璃棒、量筒外,还需要;如果配制时,俯视定容,那么所配溶液的浓度(填“偏大”、“偏小”或“无影响”)。20. 人工固氮合成氨,并通过氨氧化法制取硝酸的流程如图所示。 (1)、“合成塔”内发生的化学反应中作氧化剂的是(填化学式),金属镁在该氧化剂中燃烧的化学方程式为 , 其产物遇水生成的有刺激性气味气体的电子式为;“氧化炉”中氨气发生反应的化学方程式为。(2)、常温下,工业上选择铁或铝作盛装浓硝酸的罐体材料的主要原因是。(3)、为了避免生成硝酸的过程中氮的氧化物污染环境,可用氨气处理尾气,将其转化为大气中含有的无害气体,以处理NO2为例,该反应中氧化剂与还原剂的物质的量之比为。(4)、取3.2 g铜与30 mL8 mol/L硝酸充分反应,硝酸的还原产物为NO2和NO,反应后溶液中含有a mol H+ , 则生成的NO2的物质的量为(用含a的代数式表示,下同)mol,NO的物质的量为mol。
(1)、“合成塔”内发生的化学反应中作氧化剂的是(填化学式),金属镁在该氧化剂中燃烧的化学方程式为 , 其产物遇水生成的有刺激性气味气体的电子式为;“氧化炉”中氨气发生反应的化学方程式为。(2)、常温下,工业上选择铁或铝作盛装浓硝酸的罐体材料的主要原因是。(3)、为了避免生成硝酸的过程中氮的氧化物污染环境,可用氨气处理尾气,将其转化为大气中含有的无害气体,以处理NO2为例,该反应中氧化剂与还原剂的物质的量之比为。(4)、取3.2 g铜与30 mL8 mol/L硝酸充分反应,硝酸的还原产物为NO2和NO,反应后溶液中含有a mol H+ , 则生成的NO2的物质的量为(用含a的代数式表示,下同)mol,NO的物质的量为mol。