四川省成都市东部新区2021-2022学年高二下学期期中考试化学试题
试卷更新日期:2022-05-24 类型:期中考试
一、单选题
-
1. 当光束通过下列分散系时,可观察到一条光亮“通路”的是( )A、NaOH溶液 B、Na2SO4溶液 C、HNO3溶液 D、稀豆浆2. 北京冬奥会火种灯的外形设计灵感来自于河北博物院的“长信宫灯”。

下列说法错误的是( )
A、青铜的硬度大于纯铜 B、镏金层破损后生成铜锈的主要成分为CuO C、铝合金表面氧化物薄膜可以保护内部金属不被腐蚀 D、两灯所用的燃料充分燃烧后的产物均为CO2和H2O3. NA表示阿伏加德罗常数的值,下列说法正确的是( )A、标准状况下,86g己烷的分子数为NA个 B、25℃时,1 L 0.1 mol·L-1的NH4NO3溶液中NH为0.1NA C、17.6g丙烷中所含的极性共价键为4NA个 D、64gCu分别与足量稀硝酸反应时,转移电子数为NA4. 下列说法错误的是( )A、和互为同位素 B、甲酸和蚁酸互为同分异构体 C、和互为同系物 D、金刚石和互为同素异形体5. 某原电池的总反应的离子方程式为2Fe3++Fe=3Fe2+ , 不能实现该反应的原电池是( )选项
正极
负极
电解质溶液
A
Cu
Fe
FeCl3溶液
B
C
Fe
Fe(NO3)3溶液
C
Fe
Zn
Fe2(SO4)3溶液
D
Ag
Fe
Fe2(SO4)3溶液
A、A B、B C、C D、D6. 利用下列实验装置进行实验,能达到实验目的的是( )



A.制取CO2
B.干燥NH3
C.收集NO
D.收集CH3COOC2H5
A、A B、B C、C D、D7. 下列有关说法正确的是( )A、等质量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多 B、已知C(石墨,s)=C(金刚石,s) ΔH>0,故金刚石比石墨稳定 C、放热且熵增加的反应不一定能正向自发进行 D、增大反应物的浓度能增大活化分子百分数,加快反应速率8. 有关单质钾的说法如下:①在中燃烧生成并能产生紫色火焰;②与溶液反应时能产生蓝色沉淀;③少量单质钾可保存在煤油中;④熔点、沸点均比钠的高。下列组合正确的是( )A、②③ B、①④ C、③④ D、①③9. 下列关于有机化合物的叙述正确的是( )A、乙烷可以发生取代反应和加成反应 B、用酸性高锰酸钾溶液可鉴别己烯和甲苯 C、邻二甲基环己烷(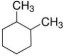 )的一氯代物有4种
D、乙酸和汽油均能和氢氧化钠溶液反应
10. 下列离子能大量共存的是( )A、Na+、K+、SO、 CO B、Mg2+、 NH、SO、OH- C、Ba2+、K+、CO、NO D、Ag+、K+、Cl-、NO11. 下列有关物质用途的叙述中,错误的是( )A、Cl2常用于自来水消毒 B、SO2常用于漂白食品 C、SiO2常用于制造光导纤维 D、Na2O2可用于呼吸面具中氧气的来源12. 文献报道:在45 ℃、0.1 MPa时,科学家以铁粉为催化剂,通过球磨法合成氨。部分反应历程如图所示(吸附在催化剂表面的物种用*标注),下列说法正确的是( )
)的一氯代物有4种
D、乙酸和汽油均能和氢氧化钠溶液反应
10. 下列离子能大量共存的是( )A、Na+、K+、SO、 CO B、Mg2+、 NH、SO、OH- C、Ba2+、K+、CO、NO D、Ag+、K+、Cl-、NO11. 下列有关物质用途的叙述中,错误的是( )A、Cl2常用于自来水消毒 B、SO2常用于漂白食品 C、SiO2常用于制造光导纤维 D、Na2O2可用于呼吸面具中氧气的来源12. 文献报道:在45 ℃、0.1 MPa时,科学家以铁粉为催化剂,通过球磨法合成氨。部分反应历程如图所示(吸附在催化剂表面的物种用*标注),下列说法正确的是( ) A、由此历程可知:N*+3H*=NH*+2H* ΔH>0 B、铁粉改变了合成氨的反应历程和反应热 C、图示过程中有极性共价键的生成 D、用不同催化剂合成氨,反应历程均与上图相同13. 如图所示的物质转化关系中,A是常见的气态氢化物,B是能使带火星的木条复燃的无色、无味气体,E的相对分子质量比D的大17,G是一种紫红色金属单质(反应条件和部分生成物未列出)。
A、由此历程可知:N*+3H*=NH*+2H* ΔH>0 B、铁粉改变了合成氨的反应历程和反应热 C、图示过程中有极性共价键的生成 D、用不同催化剂合成氨,反应历程均与上图相同13. 如图所示的物质转化关系中,A是常见的气态氢化物,B是能使带火星的木条复燃的无色、无味气体,E的相对分子质量比D的大17,G是一种紫红色金属单质(反应条件和部分生成物未列出)。
对图中有关物质及反应的叙述错误的是( )
A、气态氢化物A可用作制冷剂 B、反应②体现了E的氧化性和酸性 C、反应③中氧化剂与还原剂物质的量之比为4∶5 D、化合物D的密度比空气大,易液化,易溶于水14. X、Y、Z、M为四种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成分子;Y与M形成的气态化合物在标准状况下的密度为。下列说法正确的是( )A、原子半径比较:Z>Y>X>M B、元素的氧化物对应的水化物的酸性比较:Z>Y>X C、由Y、Z、M三种元素可形成一种常见的离子化合物 D、气态氢化物的稳定性:X>Y>Z15. 溴酸盐在国际上被定位为2B级潜在致癌物。已知KBrO3可发生下列反应:2KBrO3+I2=2KIO3+Br2 , 下列有关说法错误的是( )A、KBrO3是氧化剂 B、该反应说明I2的还原性强于Br2 C、当有1 mol KBrO3参与反应时转移5 mol电子 D、通过该反应相关物质的氧化性、还原性强弱比较可知:不能用KI与Br2反应来制取I216. 根据下列实验操作和现象所得的结论正确的是( )选项
实验操作和现象
结论
A
向AgCl 悬浊液中滴入KI溶液,悬浊液变为黄色
Ksp(AgCl) >Ksp(AgI)
B
将Fe(NO3)2 溶于稀H2SO4后,滴加KSCN溶液,溶液变成红色
原Fe(NO3)2中一定含有Fe3+
C
相同条件下,分别测量0.1 mol·L-1和0.01 mol·L-1的醋酸溶液的导电性,前者的导电性强
醋酸浓度越大,电离程度越大
D
常温下,分别测量浓度均为0.1 mol·L-1的Na2S溶液和NaClO溶液的pH,前者的pH 大
酸性:HClO>H2S
A、A B、B C、C D、D17. 如图是模拟工业电解饱和食盐水的装置图,下列叙述正确的是( ) A、Fe电极的电极反应是:4OH--4e-=2H2O+O2↑ B、通电一段时间后,石墨电极附近溶液先变红 C、电解饱和食盐水的总反应是:2NaCl+2H2O2NaOH+H2↑+Cl2↑ D、直流电源的a极是正极18. 二氧化硫是一种应用广泛的化工原料。在接触法制硫酸的工业中,二氧化硫制取三氧化硫的反应为2SO2(g)+O2(g) = 2SO3(g) ∆H= -196 kJ•mol-1.实验室用亚硫酸钠固体与70%的硫酸制取少量的二氧化硫。下列有关用二氧化硫制取三氧化硫的说法正确的是( )A、反应的∆S > 0 B、2 mol SO2与足量O2反应,放出的热量为196 kJ C、工业上用通入足量的空气来提高SO2的转化率 D、反应中每消耗1 mol SO2转移的电子数目约等于4×6.02×102319. 某无色溶液可能由Na+、Ba2+、Cu2+、CO、HCO、SO、Cl-中的一种或几种。为了确定该溶液的成分,进行如下实验:
A、Fe电极的电极反应是:4OH--4e-=2H2O+O2↑ B、通电一段时间后,石墨电极附近溶液先变红 C、电解饱和食盐水的总反应是:2NaCl+2H2O2NaOH+H2↑+Cl2↑ D、直流电源的a极是正极18. 二氧化硫是一种应用广泛的化工原料。在接触法制硫酸的工业中,二氧化硫制取三氧化硫的反应为2SO2(g)+O2(g) = 2SO3(g) ∆H= -196 kJ•mol-1.实验室用亚硫酸钠固体与70%的硫酸制取少量的二氧化硫。下列有关用二氧化硫制取三氧化硫的说法正确的是( )A、反应的∆S > 0 B、2 mol SO2与足量O2反应,放出的热量为196 kJ C、工业上用通入足量的空气来提高SO2的转化率 D、反应中每消耗1 mol SO2转移的电子数目约等于4×6.02×102319. 某无色溶液可能由Na+、Ba2+、Cu2+、CO、HCO、SO、Cl-中的一种或几种。为了确定该溶液的成分,进行如下实验:①取少量该溶液加入足量氯水,有气体产生,得到甲溶液;
②取少量甲溶液,向其中加入硝酸酸化的硝酸银溶液,产生白色沉淀甲;
③取少量原溶液,向其中加入Ba(OH)2溶液,产生白色沉淀乙,加足量稀盐酸,沉淀部分溶解。下列关于原溶液说法正确的是( )
A、肯定存在SO、Cl- B、肯定不存在Ba2+ , 可能存在Cu2+ C、CO、HCO至少存在一种 D、是否存在Na+需要通过焰色试验来确定20. 常温下,向溶液中逐滴加入0.1mol/L的NaOH溶液,溶液中水电离出的随加入NaOH溶液的体积变化如图所示。下列说法正确的是( ) A、c点对应的溶液的pH=7 B、b、d两点对应的溶液的pH相同 C、从a点到d点,水的电离程度一直增大 D、b点对应的溶液中,
A、c点对应的溶液的pH=7 B、b、d两点对应的溶液的pH相同 C、从a点到d点,水的电离程度一直增大 D、b点对应的溶液中,二、填空题
-
21. 已知反应过程的能量变化如图所示:
 (1)、由图可知为(填“吸热”或“放热”)反应。(2)、图中C点表示。E所代表的能量是;E的大小对该反应的反应热(填“有”或“无”)影响。(3)、请求出反应。(4)、又知 , 请根据题给条件求出反应的焓变。22. 已知有下列十种物质:①固体②过氧化钠③熔融态④⑤碘水⑥⑦小苏打⑧氨水⑨⑩硫酸亚铁。(1)、上述物质中,属于电解质的是(填序号,下同)属于非电解质的是。(2)、写出②与反应的化学方程式。当反应转移时,固体质量增加g。(3)、相同条件下,物质⑦的溶解度的溶解度(填“大于”或“小于”)。(4)、已知⑩可使酸性溶液褪色,完成并配平该反应的离子方程式:。
(1)、由图可知为(填“吸热”或“放热”)反应。(2)、图中C点表示。E所代表的能量是;E的大小对该反应的反应热(填“有”或“无”)影响。(3)、请求出反应。(4)、又知 , 请根据题给条件求出反应的焓变。22. 已知有下列十种物质:①固体②过氧化钠③熔融态④⑤碘水⑥⑦小苏打⑧氨水⑨⑩硫酸亚铁。(1)、上述物质中,属于电解质的是(填序号,下同)属于非电解质的是。(2)、写出②与反应的化学方程式。当反应转移时,固体质量增加g。(3)、相同条件下,物质⑦的溶解度的溶解度(填“大于”或“小于”)。(4)、已知⑩可使酸性溶液褪色,完成并配平该反应的离子方程式:。。
23. 研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:(1)、Co基态原子核外电子排布式为。元素Mn与O中,第一电离能较大的是 , 基态原子核外未成对电子数较多的是。(2)、CO2和CH3OH分子中C原子的杂化形式分别为和。(3)、在CO2和H2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为 , 原因是。(4)、硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在。三、综合题
-
24. 2020年突如其来的“新冠肺炎”使人们认识到日常杀菌消毒的重要性,其中含氯消毒剂在生产生活中有着广泛的用途。(1)、Ⅰ.某化学兴趣小组用如图装置制备家用消毒液。

写出装置B中反应的离子方程式。
(2)、装置A中的溶液是 , 长玻璃导管的作用是。图中装置的连接顺序是B、。(3)、用化学方程式表示装置D中“84消毒液的生成过程:。(4)、某温度下,将氯气通入溶液中,得到和的混合溶液,经测定与的物质的量之比为。则该反应中,被氧化的与被还原的的质量之比为。(5)、 Ⅱ.世卫组织将其定为A级高效安全灭菌消毒剂,它在食品保鲜、饮用水消毒等方面有广泛应用。消毒效率是用单位质量的消毒剂得电子数来表示的,作消毒剂时和一样,还原产物均为。的消毒效率是的倍(保留两位小数)。
25. 下表列出了前20号元素中某些元素性质的一些数据:性质元素
原子半径
最高价态
最低价态
性质元素
原子半径
最高价态
最低价态
①
1.02
⑥
1.10
②
2.27
-
⑦
0.99
③
0.74
-
⑧
1.86
-
④
1.43
-
⑨
0.75
⑤
0.77
⑩
1.17
试回答下列问题:
(1)、以上10种元素中,第一电离能最小的是(填编号)。(2)、上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每一个原子都满足稳定结构的物质是(写分子式)。元素⑤和⑩形成的化合物的化学式为物质类型为(填离子化合物、共价化合物):元素①的原子价电子排布式是。(3)、①、⑥、⑦三种元素的气态氢化物的稳定性,由强到弱的顺序是(填化学式)。(4)、③和⑨两元素比较,非金属性较弱的是(填名称),可以验证你的结论的是下列中的(填序号)。A.气态氢化物的挥发性
B.单质分子中的键能
C.两元素的电负性
D.含氧酸的酸性
E.氢化物中键的键长(X代表③和⑨两元素)
26. H是一种重要的化工原料,它可由石油和煤焦油通过下列路线合成: (1)、A的名称是;过程①是变化(填“物理”或“化学”)。(2)、B物质可以发生哪些类型反应。(3)、由A可以制备B,也可以由B制备A,由B制备A时温度控制为 , 若缓慢升温至时发生副反应。导致乙烯产量降低。(4)、反应③的化学方程式为。(5)、反应⑥的化学方程式为。(6)、H中六元环上的氢原子被两个氯原子取代后的有机物有种。(7)、参照上述合成路线,以F为原料,设计合成G的路线:(其他试剂任选)27. 对甲氧基肉桂酸异辛酯是目前最常用的防晒剂之一,广泛应用于日用化工领域。其合成路线如下:
(1)、A的名称是;过程①是变化(填“物理”或“化学”)。(2)、B物质可以发生哪些类型反应。(3)、由A可以制备B,也可以由B制备A,由B制备A时温度控制为 , 若缓慢升温至时发生副反应。导致乙烯产量降低。(4)、反应③的化学方程式为。(5)、反应⑥的化学方程式为。(6)、H中六元环上的氢原子被两个氯原子取代后的有机物有种。(7)、参照上述合成路线,以F为原料,设计合成G的路线:(其他试剂任选)27. 对甲氧基肉桂酸异辛酯是目前最常用的防晒剂之一,广泛应用于日用化工领域。其合成路线如下:
回答下列问题:
(1)、A→B的化学方程式是。反应类型为。(2)、A中最多个原子共平面。鉴别A与苯的方法为。(3)、B→C所需要的反应条件为。C→D的反应类型为。(4)、E中官能团的名称为。G的分子式是。请写出G同分异构的任意一种结构 , 其命名为。(5)、与C互为同分异构体共种(含C),其中一种结构满足下列条件,其结构简式为。①苯环上有1个取代基;②核磁共振氢谱有4组峰,且峰面积之比为