山东省淄博市2021-2022学年高二下学期期中考试化学试题
试卷更新日期:2022-05-24 类型:期中考试
一、单选题
-
1. 下列化学用语表示错误的是( )A、甲烷的电子式:
 B、氯乙烷的结构简式: CH3CH2Cl
C、2−甲基−1−丁醇的键线式:
B、氯乙烷的结构简式: CH3CH2Cl
C、2−甲基−1−丁醇的键线式: D、乙烯的空间填充模型:
D、乙烯的空间填充模型: 2. 下列说法正确的是( )A、
2. 下列说法正确的是( )A、 与
与 含有相同的官能团,互为同系物
B、
含有相同的官能团,互为同系物
B、 属于醛类,官能团为−CHO
C、
属于醛类,官能团为−CHO
C、 的名称为: 2−乙基−1−丁烯
D、乙醚与乙醇互为同分异构体
3. 下列各项中I、II两个反应不属于同一反应类型的是( )
的名称为: 2−乙基−1−丁烯
D、乙醚与乙醇互为同分异构体
3. 下列各项中I、II两个反应不属于同一反应类型的是( )选项
反应I
反应II
A
CH3CH2OH→CH3COOCH2CH3
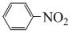
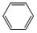 →
→
B
CH3CH2Cl→CH3CH2OH
CH3CH2OH→CH2=CH2
C
CH2=CH2→CH3CH2Cl
 →
→
D
CH3CH2OH→CH3CHO
CH3CHO→CH3COOH
A、A B、B C、C D、D4. 有机化合物分子中基团之间的相互影响会导致物质的化学性质不同。下列事实不可以用上述观点解释的是( )A、苯不能与溴水发生取代反应,而苯酚能与溴水发生取代反应 B、乙醇不能与碱发生中和反应,而乙酸能与碱发生中和反应 C、2-甲基-1-丙醇能发生消去反应,2,2-二甲基-1-丙醇不能发生消去反应 D、乙烷不能使高锰酸钾溶液褪色,而甲苯能使高锰酸钾溶液褪色5. 有关晶体的结构如图所示,下 列说法中错误的是 ( ) A、在NaCl晶体中,每个晶胞平均占有4个Cl- B、在CsCl晶体中,距Cl-最近的Cs+有6个 C、在金刚石晶体中,最小的环上有6个C原子 D、CO2 晶胞中一个分子周围有12个紧邻分子6. 为提纯下列物质(括号内为少量杂质),所选用的除杂试剂与主要分离方法都正确的是( )
A、在NaCl晶体中,每个晶胞平均占有4个Cl- B、在CsCl晶体中,距Cl-最近的Cs+有6个 C、在金刚石晶体中,最小的环上有6个C原子 D、CO2 晶胞中一个分子周围有12个紧邻分子6. 为提纯下列物质(括号内为少量杂质),所选用的除杂试剂与主要分离方法都正确的是( )选项
混合物
除杂试剂
分离方法
A
苯(苯酚)
浓溴水
过滤
B
溴苯(溴)
NaOH溶液
分液
C
甲烷(乙烯)
酸性KMnO4溶液
洗气
D
乙酸乙酯(乙酸)
氢氧化钠溶液
蒸馏
A、A B、B C、C D、D7. X、Y、Z是原子序数依次增大的短周期元素,可“组合”成一种具有高效催化性能的超分子,其结构如图(注:实线代表共价键,其他Y原子之间的重复单元中的W、X未展开标注),W、X、Z分别位于不同周期, Z是同周期中金属性最强的元素。下列说法错误的是 ( ) A、Y位于第二周期第ⅥA族 B、XW4形成的晶体堆积属于分子密堆积 C、X单质不存在能导电的晶体 D、Y与Z可组成阴阳离子数之比为1:2的离子晶体8. 下列关于2-环己基丙烯(
A、Y位于第二周期第ⅥA族 B、XW4形成的晶体堆积属于分子密堆积 C、X单质不存在能导电的晶体 D、Y与Z可组成阴阳离子数之比为1:2的离子晶体8. 下列关于2-环己基丙烯( )和2-苯基丙烯(
)和2-苯基丙烯(  )的说法中错误的是( ) A、碳原原子的杂化方式都只有sp2和sp3杂化 B、两种物质均有5种不同化学环境的氢 C、二者均可发生加聚反应和氧化反应 D、2-苯基丙烯分子中所有碳原子可能共平面9. 某物质的结构如图所示,对该物质的分析判断正确的是( )
)的说法中错误的是( ) A、碳原原子的杂化方式都只有sp2和sp3杂化 B、两种物质均有5种不同化学环境的氢 C、二者均可发生加聚反应和氧化反应 D、2-苯基丙烯分子中所有碳原子可能共平面9. 某物质的结构如图所示,对该物质的分析判断正确的是( ) A、该物质属于离子化合物 B、该物质的分子中只含有共价键、配位键两种作用力 C、该物质是一种配合物,其中Ni原子为中心原子,配位数是4 D、该物质中C,N,O原子均存在孤对电子10. 下列实验方案中,能达到相应实验目的的是( )
A、该物质属于离子化合物 B、该物质的分子中只含有共价键、配位键两种作用力 C、该物质是一种配合物,其中Ni原子为中心原子,配位数是4 D、该物质中C,N,O原子均存在孤对电子10. 下列实验方案中,能达到相应实验目的的是( )选项
A
B
C
D
目的
实验室制乙炔并检验乙炔
实验室制取少量的乙烯气体
证明酸性:碳酸>苯酚
实验室制备溴苯
实验方案



 A、A B、B C、C D、D11. 某有机物分子式为C5H10O3 , 与饱和NaHCO3溶液反应放出气体体积与同等状况下与Na反应放出气体体积相等,该有机物有(不含立体异构)( )A、9种 B、10种 C、11种 D、12种12. 异黄酮类化合物是药用植物的有效成分之一。一种异黄酮类化合物Z的部分合成路线如图:
A、A B、B C、C D、D11. 某有机物分子式为C5H10O3 , 与饱和NaHCO3溶液反应放出气体体积与同等状况下与Na反应放出气体体积相等,该有机物有(不含立体异构)( )A、9种 B、10种 C、11种 D、12种12. 异黄酮类化合物是药用植物的有效成分之一。一种异黄酮类化合物Z的部分合成路线如图:
下列有关化合物X、Y和Z的说法错误的是( )
A、1molZ 与过量碳酸钠溶液反应消耗2mol碳酸钠 B、1molY 最多能与3molNaOH反应 C、X与足量H2反应后,产物分子中有4个手性碳原子 D、等物质的量的X、Y分别与足量溴水反应,消耗单质溴的物质的量: Y=X二、多选题
-
13. 下列对有关事实的解释正确的是 ( )
选项
事实
解释
A
SiO2的熔点比干冰高
SiO2晶体是共价晶体,分子间作用力大
B
在CS2中的溶解度:CCl4 >H2O
CS2、CCl4为非极性分子,而H2O为极性分子
C
用质谱仪检测气态乙酸时,谱图中出现质荷比(相对分子质量)为120的峰
两个乙酸分子通过范德华力形成了二聚体
D
离子液体有难挥发性
离子液体的粒子全都是带电荷的离子
A、A B、B C、C D、D14. 有机物Z是一种重要的医药中间体,可由如下反应制得。下列说法正确的是( ) A、该反应另一种小分子产物是HCl B、Z分子中的官能团有氯原子、酮基和羟基 C、Y分子中所有原子位于同一平面内,则Y中碳原子的杂化方式有2种 D、X的同分异构体中能发生银镜反应,且属于芳香族化合物的共有6种15. 下列实验中,操作、现象及结论均正确的是( )
A、该反应另一种小分子产物是HCl B、Z分子中的官能团有氯原子、酮基和羟基 C、Y分子中所有原子位于同一平面内,则Y中碳原子的杂化方式有2种 D、X的同分异构体中能发生银镜反应,且属于芳香族化合物的共有6种15. 下列实验中,操作、现象及结论均正确的是( )选项
操作
现象
结论
A
将CH3CH2Br与NaOH溶液共热,冷却后,取出上层水溶液加入AgNO3溶液
产生淡黄色沉淀
CH3CH2Br中含有溴原子
B
向2 mL10%的NaOH溶液中滴入2%的CuSO4溶 液4至6滴,得到新制的Cu(OH)2悬浊液,然后加入乙醛溶液0.5 mL,振荡后加热
产生砖红色沉淀
醛基具有还原性
C
将乙醇与浓硫酸共热至170℃所得气体直接通入酸性KMnO4溶液中
KMnO4溶液褪色
乙醇发生消去反应的产物为乙烯
D
向苯酚钠溶液中通入一定量CO2
溶液变浑浊
碳酸的酸性比苯酚的酸性强
A、A B、B C、C D、D三、填空题
-
16. 完成下列问题(1)、参考表中物质的熔点,问答有关问题。
物质
NaF
NaCl
NaBr
NaI
熔点/℃
995
801
755
651
物质
SiF4
SiCl4
SiBr4
SiI4
熔点/℃
−90.2
−70.4
5.2
120.0
钠的卤化物熔点变化的原因是 , 影响硅的卤化物熔点的因素是 , 钠的卤化物的熔点比相应的硅的卤化物的熔点高得多的原因是。
(2)、向胆矾溶液中滴加氨水至过量,最终得到深蓝色的透明溶液,再加入乙醇后析出深蓝色晶体,写出生成深蓝色透明溶液的离子方程式:。该实验可知,与Cu2+结合生成配离子的稳定性: NH3 H2O(填 “>”或“<” )。(3)、含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。卟啉配合物叶绿素是一种,其结构如图所示。叶绿素的中心离子无论是Mg2+还是Zn2+ , 都能形成稳定结构,原因是 , 其中稳定性相对较高的是 (填“Mg2+”或“Zn2+”) , 1mol该配合物中通过螯合作用形成的配位键的数目为。
四、综合题
-
17. 完成下列问题(1)、As2Se3是一种非晶态半导体,也称玻璃半导体。区分晶体与非晶体的最可靠的科学方法是。(2)、钴的一种化合物的立方晶胞结构如图所示,已知A点的原子坐标参数为(0,0,0),B点为( , 0,),则C点的原子坐标参数为 , 钴周围等距离且最近的O2-数目为 , 该物质的化学式为。
 (3)、以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。CsSiB3O7属正交晶系(长方体形)。晶胞参数为a pm、b pm、c pm。如图为沿y轴投影的晶胞中所有Cs原子的分布图和原子分数坐标。据此推断该晶胞中Cs原子的数目为。CsSiB3O7的摩尔质量为M g∙mol−1 , 设NA为阿伏加德罗常数的值,则CsSiB3O7晶体的密度为g·cm−3(用代数式表示)。为点(0.5,0.8,0)与点(1.0,0.7,1.0)之间的距离为pm。
(3)、以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。CsSiB3O7属正交晶系(长方体形)。晶胞参数为a pm、b pm、c pm。如图为沿y轴投影的晶胞中所有Cs原子的分布图和原子分数坐标。据此推断该晶胞中Cs原子的数目为。CsSiB3O7的摩尔质量为M g∙mol−1 , 设NA为阿伏加德罗常数的值,则CsSiB3O7晶体的密度为g·cm−3(用代数式表示)。为点(0.5,0.8,0)与点(1.0,0.7,1.0)之间的距离为pm。 18. 苯甲酸乙酯(密度1.05g/cm3),稍有水果气味,用于配制香水香精和人造精油,也大量用于食品以及用作有机合成中间体等。制备苯甲酸乙酯的过程如下:
18. 苯甲酸乙酯(密度1.05g/cm3),稍有水果气味,用于配制香水香精和人造精油,也大量用于食品以及用作有机合成中间体等。制备苯甲酸乙酯的过程如下:制备粗产品:如图所示装置中,在装置A中加入8.0g苯甲酸、20mL 乙醇(密度0. 79g/cm3)、15mL 环己烷、3mL 浓硫酸,摇匀,加沸石。在分水器中加水,接通冷凝水,水浴回流约2h,反应基本完成。记录体积,继续蒸出多余环己烷和醇(从分水器中放出)。

粗产品纯化:加水30mL,分批加入饱和NaHCO3溶液。分液,然后水层用20mL石油醚分两次萃取。合并有机层,用无水硫酸镁干燥。回收石油醚,加热精馏,收集210~213℃馏分。相关数据如下:
物质
苯甲酸
苯甲酸乙酯
石油醚
水
乙醇
环己烷
共沸物(环己烷-水-乙醇)
沸点(℃)
249
212.6
40~80
100
78.3
80.75
62.6
根据以上信息和装置图回答下述实验室制备有关问题:
(1)、仪器B的名称是。(2)、写出制备苯甲酸乙酯反应的化学方程式。(3)、采用水浴加热的优点是。 通过分水器不断分离除去反应生成的水,目的是。(4)、如何利用实验现象判断反应已基本完成 。(5)、加入饱和NaHCO3溶液的作用除降低苯甲酸乙酯溶解度外,还有。(6)、经精馏得210~213℃馏分6.0 mL,则实验中苯甲酸乙酯的产率为。 (保留两位有效数字)19.(1)、Ⅰ.扑热息痛是最常用的非抗炎解热镇痛药,对胃无刺激,副作用小。对扑热息痛进行结构表征,测得的相关数据和谱图如下。回答下列问题:测定实验式。
将15.1 g样品在足量纯氧中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重8.1g和35.2 g,再将等量的样品通入二氧化碳气流中,在氧化铜/铜的作用下氧化有机物中氮元素,测定生成气体的体积为1.12 L(已换算成标准状况)。其实验式为。
(2)、确定分子式。测得目标化合物的质谱图如下:其分子式为。 (3)、推导结构式。
(3)、推导结构式。用化学方法推断样品分子中的官能团。
①加入NaHCO3溶液,无明显变化;
②加入FeCl3溶液,显紫色;
③水解可以得到一种两性化合物。
波谱分析:通过目标化合物的红外光谱图分析可知该有机化合物分子中存在:
 、-OH、
、-OH、 、
、
②测得目标化合物的核磁共振氢谱图如下:

该有机化合物分子含有五种不同化学环境的H原子,其峰面积之比为1:1:2:2:3,综上所述,扑热息痛的结构简式为。
(4)、Ⅱ.有机物M是药物合成的中间体,可用C和F在一定条件下合成。合成路线如图:
已知以下信息: i.

ii.RCOCH3+R' CHO RCOCH=CHR'
iii.F能发生银镜反应
回答下列问题:
A的化学名称为。M中含氧官能团的名称。
(5)、A生成B的化学方程式为。(6)、B生成C的反应类型为。E生成F的反应类型为。(7)、D的结构简式为。(8)、B的同分异构体中能与FeCl3溶液反应显紫色的共有种20. 某抗癌药物G的一种合成路线如下:
回答下列问题:
(1)、R名称是; G含官能团有碳氟键、硝基和。(2)、F→G的反应类型是。(3)、写出E→F的化学方程式:;吡啶的结构简式为 ,有弱碱性,吡啶在该反应中作用是。 (4)、Y→Z、F→G都是在苯环上引入硝基,−CF3是苯环的间位控制基(即使苯环间位氢变活泼,发生取代反应时主要取代间位),−NHCOCH(CH3)2是苯环的位控制基。(5)、R的二氯代物有 (填字母)。
,有弱碱性,吡啶在该反应中作用是。 (4)、Y→Z、F→G都是在苯环上引入硝基,−CF3是苯环的间位控制基(即使苯环间位氢变活泼,发生取代反应时主要取代间位),−NHCOCH(CH3)2是苯环的位控制基。(5)、R的二氯代物有 (填字母)。a.4种 b.6种 c.9种 d.10种
(6)、参照上述合成路线,设计一条以苯甲醚( )和CH3COCl为原料合成甲氧基乙酰苯胺(
)和CH3COCl为原料合成甲氧基乙酰苯胺( )的路线,其他试剂自选,合成路线示例见题目。
)的路线,其他试剂自选,合成路线示例见题目。
-