江苏省徐州市睢宁县2021-2022学年高一下学期期中考试(线上)化学试题
试卷更新日期:2022-05-24 类型:期中考试
一、单选题
-
1. 2022年4月22日是第53个世界地球日,其主旨是提高民众对现有环境问题的意识,通过绿色低碳生活,改善地球的整体环境。下列做法符合这一主旨的是( )A、垃圾分类处理,实现资源的再利用 B、城市街道中的落叶就地焚烧,以改善城市环境 C、废旧电池掩埋处理,可以节约处理费用 D、施用大量农药,提高农作物的产量2. 下列反应条件的调控与反应速率无关的是( )A、合成氨时使用铁触媒 B、进入公共场合需要佩戴口罩 C、用热的碱溶液去除油污 D、蔬菜需要放在冰箱来保持新鲜3. 化学反应限度的调控在工业生产和环保技术等方面得到了广泛的应用,如果设法提高化学反应的限度,下面的说法错误的是( )A、能够节约原料和能源 B、能够提高产品的产量 C、能够提高经济效益 D、能够提高化学反应速率4. “盐水动力”玩具车的电池以镁片、活性炭为电极,向极板上滴加食盐水后电池便可工作,电池反应为。下列关于该电池的说法中,错误的是( )A、镁片作为负极 B、食盐水作为电解质溶液,且向炭电极移动 C、电池工作时镁片逐渐被消耗 D、电池工作时实现了化学能向电能的转化5. 用下列装置制取NH3 , 并还原CuO,其原理和装置均正确的是( )A、
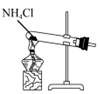 用装置制取NH3
B、
用装置制取NH3
B、 用装置干燥NH3
C、
用装置干燥NH3
C、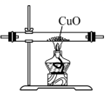 用装置还原CuO
D、
用装置还原CuO
D、 用装置处理尾气
6. 是合成氨工业的重要原料,不仅可制造化肥,还能通过催化氧化生产;大气中过量的和水体中过量的均是污染物。通过催化还原的方法,可将烟气和机动车尾气中的转化为。已知。下列有关说法正确的是( )A、在一个密闭定容容器中,和充分反应可以放出热量 B、具有的能量高于具有的能量 C、当2v(N2)正=v(NH3)正 , 表明该反应已经达到了化学平衡状态 D、使用催化剂,可以加快该反应的反应速率7. 是合成氨工业的重要原料,不仅可制造化肥,还能通过催化氧化生产;大气中过量的和水体中过量的均是污染物。通过催化还原的方法,可将烟气和机动车尾气中的转化为。在指定条件下,下列选项所示的物质间转化能实现的是( )A、 B、 C、 D、8. 是合成氨工业的重要原料,不仅可制造化肥,还能通过催化氧化生产;大气中过量的和水体中过量的均是污染物。通过催化还原的方法,可将烟气和机动车尾气中的转化为。下列有关和的说法正确的是( )A、浓硝酸见光易分解,应该用棕色试剂瓶盛装 B、相同条件下,与铜反应,浓硝酸产生的氢气比稀硝酸多 C、氨气液化,吸收大量热,所以液氨可以做制冷剂 D、可以使湿润pH试纸变红色9. 在25℃、101kPa下,1mol白磷(化学式为P4)完全燃烧放出的热量和4mol红磷(化学式为P)完全燃烧放出的热量关系如下图所示:由此判断,下列说法正确的是( )
用装置处理尾气
6. 是合成氨工业的重要原料,不仅可制造化肥,还能通过催化氧化生产;大气中过量的和水体中过量的均是污染物。通过催化还原的方法,可将烟气和机动车尾气中的转化为。已知。下列有关说法正确的是( )A、在一个密闭定容容器中,和充分反应可以放出热量 B、具有的能量高于具有的能量 C、当2v(N2)正=v(NH3)正 , 表明该反应已经达到了化学平衡状态 D、使用催化剂,可以加快该反应的反应速率7. 是合成氨工业的重要原料,不仅可制造化肥,还能通过催化氧化生产;大气中过量的和水体中过量的均是污染物。通过催化还原的方法,可将烟气和机动车尾气中的转化为。在指定条件下,下列选项所示的物质间转化能实现的是( )A、 B、 C、 D、8. 是合成氨工业的重要原料,不仅可制造化肥,还能通过催化氧化生产;大气中过量的和水体中过量的均是污染物。通过催化还原的方法,可将烟气和机动车尾气中的转化为。下列有关和的说法正确的是( )A、浓硝酸见光易分解,应该用棕色试剂瓶盛装 B、相同条件下,与铜反应,浓硝酸产生的氢气比稀硝酸多 C、氨气液化,吸收大量热,所以液氨可以做制冷剂 D、可以使湿润pH试纸变红色9. 在25℃、101kPa下,1mol白磷(化学式为P4)完全燃烧放出的热量和4mol红磷(化学式为P)完全燃烧放出的热量关系如下图所示:由此判断,下列说法正确的是( ) A、由红磷转化为五氧化二磷是吸热反应 B、由红磷转化为白磷是放热反应 C、由红磷转化为白磷是吸热反应,等质量时白磷比红磷稳定 D、由红磷转化为白磷是吸热反应,等质量时红磷比白磷稳定10. 下列关于铵盐和氨肥的说法正确的是( )
A、由红磷转化为五氧化二磷是吸热反应 B、由红磷转化为白磷是放热反应 C、由红磷转化为白磷是吸热反应,等质量时白磷比红磷稳定 D、由红磷转化为白磷是吸热反应,等质量时红磷比白磷稳定10. 下列关于铵盐和氨肥的说法正确的是( )①农业生产中常使用的氮肥都是易溶于水的;②生产中使用的尿素不属于有机物;③铵态氮肥可以与草木灰混合施用;④铵态氮肥在使用时宜深施盖土,避免受热;
A、①③ B、①④ C、②③ D、②④11. 是一种常见的化肥,某工厂用石膏、制备的工艺流程如下:
下列说法正确的是( )
A、步骤②中反应的离子方程式为 B、操作1是过滤、操作2是蒸馏 C、通入的和均应过量,且工业流程中可循环利用 D、通入和的顺序可以颠倒12. 如图是实验室进行氨溶于水的喷泉实验装置,下列叙述错误的是( ) A、该实验说明氨气是一种极易溶于水的气体 B、进入烧瓶中的液体颜色由无色变为红色,说明氨水呈碱性 C、形成喷泉的原因是氨气溶于水后,烧瓶内的气压小于大气压 D、用氧气代替氨气,利用此装置也可进行喷泉实验13. 在溶液中滴加5~6滴溶液充分反应后,再进行下列实验,其中可以证明溶液和溶液的反应有一定限度的是( )A、取反应后的溶液少许,再滴加溶液,观察是否有沉淀产生 B、加入振荡后静置,取出下层液体,观察下层液体颜色 C、加入振荡后静置,取出上层液体,滴加溶液观察是否变红 D、加入振荡后静置,取出上层液体,滴加溶液观察是否有白色沉淀14. 大气中氮氧化物和碳氢化合物受紫外线作用可产生二次污染物一光化学烟雾,其中部分物质的反应过程如图所示。下列说法正确的是( )
A、该实验说明氨气是一种极易溶于水的气体 B、进入烧瓶中的液体颜色由无色变为红色,说明氨水呈碱性 C、形成喷泉的原因是氨气溶于水后,烧瓶内的气压小于大气压 D、用氧气代替氨气,利用此装置也可进行喷泉实验13. 在溶液中滴加5~6滴溶液充分反应后,再进行下列实验,其中可以证明溶液和溶液的反应有一定限度的是( )A、取反应后的溶液少许,再滴加溶液,观察是否有沉淀产生 B、加入振荡后静置,取出下层液体,观察下层液体颜色 C、加入振荡后静置,取出上层液体,滴加溶液观察是否变红 D、加入振荡后静置,取出上层液体,滴加溶液观察是否有白色沉淀14. 大气中氮氧化物和碳氢化合物受紫外线作用可产生二次污染物一光化学烟雾,其中部分物质的反应过程如图所示。下列说法正确的是( ) A、该过程中O2作催化剂 B、反应过程中没有电子转移 C、反应过程中氮氧化物不断被消耗 D、丙烯转化为甲醛和乙醛
A、该过程中O2作催化剂 B、反应过程中没有电子转移 C、反应过程中氮氧化物不断被消耗 D、丙烯转化为甲醛和乙醛二、综合题
-
15. 某兴趣小组利用废旧电池的铜帽(铜锌总含量约)制备了晶体,制备流程如下:

完成下列问题:
(1)、“滤液Ⅰ”含有的溶质主要是(填化学式)。(2)、“溶解Ⅱ”发生反应的离子方程式是。(3)、“溶解Ⅱ”常要加热,但是加热温度不宜过高,原因是。(4)、锌与稀硫酸反应制取氢气,当加入少量溶液时,生成氢气的速率会大大提高,但当加入的溶液超过一定量时,生成氢气的速率反而会下降。请分析生成氢气速率下降的主要原因:。(5)、某晶体中常含有亚硝酸钠 , 现测定亚硝酸钠的含量,称取样品溶于水配成溶液,取溶液于锥形瓶中,再向锥形瓶中加入酸性溶液 , 两者恰好完全反应:。计算原晶体中亚硝酸钠的质量分数。(写出计算过程)16. 是一种廉价的碳资源,其综合利用具有重要意义。在容积为的恒容密闭容器中,充入和 , 一定条件下发生反应得到和 , 测得反应物X和的浓度随时间的变化如图所示。 (1)、内,甲醇反应速率。(小数点后保留三位有效数字)。(2)、该反应的化学方程式为。(3)、时,的转化率为。(4)、后,保持其他条件不变,向容器中再通入和 , 则该反应的速率将。(填“增大”、“减小”或“不变”)。(5)、下列可以作为该反应已达到平衡的判据是____(填标号)。A、气体的总压强不变 B、 C、与的浓度相同 D、容器内气体的密度不变17. 现代生活中,化学电源发挥越来越重要的作用。按要求回答下列问题:(1)、以和为电极,稀为电解质溶液形成的原电池中:
(1)、内,甲醇反应速率。(小数点后保留三位有效数字)。(2)、该反应的化学方程式为。(3)、时,的转化率为。(4)、后,保持其他条件不变,向容器中再通入和 , 则该反应的速率将。(填“增大”、“减小”或“不变”)。(5)、下列可以作为该反应已达到平衡的判据是____(填标号)。A、气体的总压强不变 B、 C、与的浓度相同 D、容器内气体的密度不变17. 现代生活中,化学电源发挥越来越重要的作用。按要求回答下列问题:(1)、以和为电极,稀为电解质溶液形成的原电池中:①向极移动(填“正”或“负”)。
②若有流过导线,则理论上可以生成标准状况下L。
③负极的电极反应方程式为:。
(2)、氢气、甲醇都是理想的能源,科学家最近研制使海水分解得到氢气的新技术。分解海水的反应属于(填“放热”或“吸热”)反应。液态甲醇完全燃烧生成液态水和二氧化碳气体时放出热量,则甲醇燃烧的热化学方程式为。(3)、有人以化学反应:为基础设计一种原电池,移入人体内作为心脏起搏器的能源,它靠人体内血液中溶有一定浓度的进行工作。则原电池的负极材料是 , 正极发生的电极反应为。18. 为探究溶液对氮氧化物的处理效果,进行如下实验:
已知:具有强氧化性,且氧化性随着溶液的酸性增强而增强。和反应的化学方程式为:。对氮氧化物具有强吸收效果。
(1)、“制气”阶段生成和。“制气”反应的化学方程式为。(2)、可以将氧化为 , 并进一步氧化为 , 则被还原为。吸收时,溶液从吸收器顶部喷淋,氮氧化物从吸收器底部通入(如图所示)。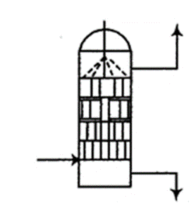
①和反应的离子方程式为。
②吸收器内装填碎瓷片填料的目的是(填字母)。
A.增大氮氧化物的吸收速率 B.防止氮氧化物气体外逸
(3)、通过加入盐酸或调节溶液的 , 测得不同的溶液对吸收率的影响如图所示。
①当小于7时,吸收率随增大而减小的原因是。
②当大于7时,吸收率随增大而增大的原因是。