福建省宁德市同心顺联盟2021-2022学年高一下学期期中联合考试化学试题
试卷更新日期:2022-05-24 类型:期中考试
一、单选题
-
1. 2020年2月24日,华为MateXs新款5G折叠屏手机开启线上预约销售。下列说法错误的是( )

 A、制造手机芯片的关键材料是硅 B、用铜制作手机线路板利用了铜优良的导电性 C、镁铝合金制成的手机外壳具有轻便抗压的特点 D、手机电池工作时,电池中化学能完全转化为电能2. 下列物质属于共价化合物的是( )A、 B、 C、 D、3. 下列有关化学用语的表示正确的是( )A、氯气的电子式:
A、制造手机芯片的关键材料是硅 B、用铜制作手机线路板利用了铜优良的导电性 C、镁铝合金制成的手机外壳具有轻便抗压的特点 D、手机电池工作时,电池中化学能完全转化为电能2. 下列物质属于共价化合物的是( )A、 B、 C、 D、3. 下列有关化学用语的表示正确的是( )A、氯气的电子式: B、、、互为同位素
C、中子数为18的氯原子:
D、二氧化碳分子的结构式:
4. 下列反应既属于氧化还原反应,又是吸热反应的是( )A、钠与冷水的反应 B、碳酸钙的分解反应 C、柠檬酸与碳酸氢钠的反应 D、灼热的木炭与反应5. 下列递变情况中,正确的是( )A、Na、Mg、Al原子的最外层电子数依次减少 B、Si、P、S元素的最高正价依次降低 C、HF、H2O、NH3的稳定性依次减弱 D、Li、Na、K的金属性依次减弱6. 下列说法正确的是( )A、需要加热才能发生的反应一定是吸热反应 B、由非金属元素组成的化合物一定是共价化合物 C、H2O2和H2O,红磷和白磷均属于同素异形体 D、和原子中质子数和中子数都不相等7. X、Y、Z、W、M均为短周期元素,M的一种核素不含中子,X、Y、Z、W在周期表中的位置如图所示,Y原子最外层电子数为内层电子数的3倍。下列说法错误的是( )
B、、、互为同位素
C、中子数为18的氯原子:
D、二氧化碳分子的结构式:
4. 下列反应既属于氧化还原反应,又是吸热反应的是( )A、钠与冷水的反应 B、碳酸钙的分解反应 C、柠檬酸与碳酸氢钠的反应 D、灼热的木炭与反应5. 下列递变情况中,正确的是( )A、Na、Mg、Al原子的最外层电子数依次减少 B、Si、P、S元素的最高正价依次降低 C、HF、H2O、NH3的稳定性依次减弱 D、Li、Na、K的金属性依次减弱6. 下列说法正确的是( )A、需要加热才能发生的反应一定是吸热反应 B、由非金属元素组成的化合物一定是共价化合物 C、H2O2和H2O,红磷和白磷均属于同素异形体 D、和原子中质子数和中子数都不相等7. X、Y、Z、W、M均为短周期元素,M的一种核素不含中子,X、Y、Z、W在周期表中的位置如图所示,Y原子最外层电子数为内层电子数的3倍。下列说法错误的是( )X
Y
Z
W
A、X、Y均能与M形成10电子分子 B、原子半径: C、由X、Y、M形成的化合物水溶液一定呈酸性 D、简单阴离子还原性:8. 某温度时,2NO(g)+O2(g)=2NO2(g)反应到2 s后,NO的浓度减少了0.06 mol·L-1 , 则以O2表示该时段的化学反应速率是( )A、0.03 mol·L-1·s-1 B、0.015 mol·L-1·s-1 C、0.12 mol·L-1·s-1 D、0.06 mol·L-1·s-19. 设为阿伏加德罗常数的值。下列说法正确的是( )A、所含的离子总数是 B、含有的中子数为 C、标准状况下,中含有的氯原子数目为 D、密闭容器中,和催化反应后分子总数为10. 根据元素周期表和元素周期律,判断下列叙述错误的是( )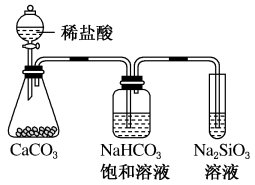 A、如图所示实验(左侧锥形瓶内有二氧化碳气体冒出,右侧试管中有硅酸产生)可证明元素的非金属性: B、氢元素与其他元素既可形成共价化合物也可形成离子化合物 C、用中文“
A、如图所示实验(左侧锥形瓶内有二氧化碳气体冒出,右侧试管中有硅酸产生)可证明元素的非金属性: B、氢元素与其他元素既可形成共价化合物也可形成离子化合物 C、用中文“ ”(ào)命名的第118号元素在周期表中位于第七周期0族
D、在元素周期表中金属和非金属的分界处可以找到半导体材料
11. 化学反应的能量变化如图所示,则下列说法错误的是( )
”(ào)命名的第118号元素在周期表中位于第七周期0族
D、在元素周期表中金属和非金属的分界处可以找到半导体材料
11. 化学反应的能量变化如图所示,则下列说法错误的是( ) A、该反应是放热反应 B、键和键断裂能放出的能量 C、键断裂需要吸收的能量 D、的总能量低于和的总能量12. 如图所示装置中观察到电流计指针偏转,M棒变粗,N棒变细,指针指向M,由此判断下表中所列M、N、P物质,其中可以成立的组合是( )
A、该反应是放热反应 B、键和键断裂能放出的能量 C、键断裂需要吸收的能量 D、的总能量低于和的总能量12. 如图所示装置中观察到电流计指针偏转,M棒变粗,N棒变细,指针指向M,由此判断下表中所列M、N、P物质,其中可以成立的组合是( )M
N
P
A
锌
铜
稀硫酸溶液
B
铜
铁
稀盐酸溶液
C
银
锌
硝酸银溶液
D
锌
铁
硝酸铁溶液
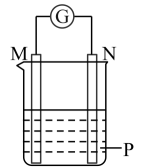 A、A B、B C、C D、D13. 常温下,可逆反应在恒容密闭容器中进行,下列叙述能够说明反应已达到平衡状态的是( )A、单位时间内生成的同时生成 B、单位时间内生成的同时生成 C、混合气体的密度不再改变 D、容器中、、的物质的量之比为2∶2∶114. 下列四个试管中,过氧化氢分解产生氧气的反应速率最慢的是( )
A、A B、B C、C D、D13. 常温下,可逆反应在恒容密闭容器中进行,下列叙述能够说明反应已达到平衡状态的是( )A、单位时间内生成的同时生成 B、单位时间内生成的同时生成 C、混合气体的密度不再改变 D、容器中、、的物质的量之比为2∶2∶114. 下列四个试管中,过氧化氢分解产生氧气的反应速率最慢的是( )试管
温度
过氧化氢溶液浓度
催化剂
A
常温
3%
——
B
水浴加热
3%
——
C
水浴加热
6%
D
常温
6%
——
A、A B、B C、C D、D15. 下列有关从海带中提取碘的实验原理和装置能达到实验目的的是( ) A、用装置甲灼烧碎海带 B、用装置乙过滤海带灰的浸泡液 C、用装置丙制备用于氧化浸泡液中的 D、用装置丁萃取浸泡液中的16. 海水综合利用部分流程如图所示,下列有关说法错误的是( )
A、用装置甲灼烧碎海带 B、用装置乙过滤海带灰的浸泡液 C、用装置丙制备用于氧化浸泡液中的 D、用装置丁萃取浸泡液中的16. 海水综合利用部分流程如图所示,下列有关说法错误的是( ) A、实验室进行①的操作需用到坩埚、玻璃棒、酒精灯 B、②③④⑤涉及的反应均为氧化还原反应 C、溶液蒸发结晶时,蒸发皿中有大量晶体析出时停止加热 D、⑤中离子方程式为
A、实验室进行①的操作需用到坩埚、玻璃棒、酒精灯 B、②③④⑤涉及的反应均为氧化还原反应 C、溶液蒸发结晶时,蒸发皿中有大量晶体析出时停止加热 D、⑤中离子方程式为二、综合题
-
17. 如图是元素周期表的一部分,表中①~⑩元素中,用元素符号或化学式填空
族
周期
ⅠA
0
1
①
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
2
②
⑩
3
③
④
⑤
⑥
⑦
⑧
4
⑨
(1)、在这些元素中,化学性质最不活泼的元素的原子结构示意图为。(2)、表中用于半导体材料的元素在周期表中的位置是。(3)、②、③、④三种元素形成的简单离子半径由大到小的顺序是(用离子符号表示)。(4)、写出①、②、③三种元素形成的化合物的电子式。(5)、写出⑨与水反应的化学方程式:。写出⑤的最高价氧化物对应水化物与⑧的最高价氧化物对应水化物反应的离子方程式:。18.(1)、Ⅰ.现有如下两个反应:A、 B、上述反应属于放热反应的是_______(填“A”或“B”)。
(2)、将纯锌片和纯铜片按图方式插入相同浓度的稀硫酸中一段时间,回答下列问题: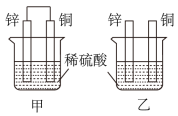
①在甲乙两个烧杯中,甲铜极上发生反应(填“氧化”或“还原”),乙在表面产生气泡(填“”或“”)。
②能构成原电池的是装置(填“甲”或“乙”),其中负极为电极(填“”或“”)。
③两个装置中均被腐蚀,若转移电子,理论上片质量减轻g。
(3)、在进行上述实验时发现甲放出气泡的速率较快,为了加快乙的反应速率,可采用的措施有(写出一种即可)。(4)、II.一定条件下,在密闭容器中充入一定量的和发生反应: , 各物质的浓度变化如图所示。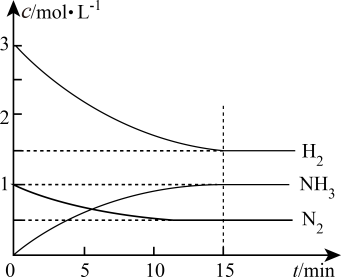
内,平均反应速率为。
(5)、下列叙述能说明该反应已达到平衡状态的是____。A、 B、密闭容器内气体总质量保持不变 C、各物质的浓度保持不变 D、消耗的同时生成19. 某化学课外活动小组为了验证元素化学性质递变规律,进行如下实验探究。(1)、Ⅰ.探究1:验证同周期X、Y、Z三种元素金属性递变规律实验内容
实验现象
①各取1.0g金属X和金属Z,分别加入到5mL水中
金属X与水反应比金属Z剧烈
②各取1.0g的金属Z和金属Y(形状相同),分别加入到5mL1.0mol/L盐酸中。
金属Z与盐酸反应比金属Y剧烈
通过实验验证三种元素金属性由强到弱是 , 则下列判断正确的是( )
A.原子序数:Y>Z>X B.原子的最外层电子数X>Y>Z
C.原子半径:Y>Z>X D.Y的最高价氧化物对应水化物的碱性最强
(2)、Ⅱ.探究2:验证氯元素的非金属性比硫元素的非金属性强,设计如下实验: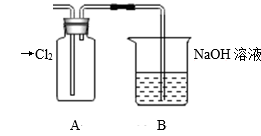
①装置A中盛放的试剂是(填选项),化学反应方程式是。
A.Na2SO3溶液 B.Na2S溶液 C.Na2SO4溶液
②下列不能用于验证氯元素比硫元素非金属性强的依据为(填选项)。
A.HCl比H2S稳定
B.HClO氧化性比H2SO4强
C.HClO4酸性比H2SO4强
D.铁与Cl2反应生成FeCl3 , 而硫与铁反应生成FeS
③若要验证非金属性:Cl>I,装置A中加入淀粉碘化钾混合溶液,观察到装置A中溶液的现象,即可证明。用原子结构理论解释非金属性Cl>I的原因:同主族元素从上到下,。
20. 某化学课外小组的同学通过实验探究认识化学反应速率和化学反应限度。(1)、实验一:探究固体的表面积和温度对反应速率的影响实验方案:用相同质量的锌和相同浓度的足量的稀盐酸反应得到实验数据如下表所示:
实验编号
锌的状态
反应温度/
收集氢气所需时间/s
Ⅰ
薄片
15
200
Ⅰ
薄片
25
90
Ⅲ
粉末
25
10
①实验Ⅰ和Ⅱ表明 , 化学反应速率越大;
②能表明固体的表面积对反应速率有影响的实验编号是和;
③请设计一个实验方案证明盐酸的浓度对该反应速率的影响:。
(2)、实验二:探究和混合时生成、和的反应存在一定的限度。实验步骤:i.向溶液中滴加5~6滴溶液,充分反应后,将所得溶液分成甲、乙、丙三等份;
ii.向甲中滴加 , 充分振荡;
iii.向乙中滴加试剂X。
①将和反应的离子方程式补充完整:。
②步骤ⅲ中,试剂X是。
③步骤ⅱ和ⅲ中的实验现象说明和混合时生成、和的反应存在一定的限度,该实验现象是。