新疆昌吉州2022届高三第二次诊断性测试理科综合化学试题
试卷更新日期:2022-05-23 类型:高考模拟
一、单选题
-
1. 北京冬奥会吉祥物“冰墩墩”深受人们的喜爱,一夜间晋级为顶流爆款。据设计团队透露:“冰墩墩”的最初创意灵感来自“冰糖葫芦”,“冰墩墩”的冰晶外壳以硅胶制成,然后再套入毛绒玩具。以下说法正确的是( )A、冬奥会上谷爱凌的滑板、高亭宇的冰刀所用材料的主体成分都是有机高分子材料 B、冰糖成分为蔗糖,其与浓硫酸混合搅拌会生成有毒气体 C、硅胶不与任何酸、碱反应,也不易燃烧 D、真熊猫与熊猫玩具的“毛”主体成分相同,都是纤维素2. 为实现“双碳”目标,某科研小组设计捕获二氧化碳生成甲酸的过程如图所示。下列说法正确的是(NA为阿伏加德罗常数的值)( )
 A、标准状况下,22.4 L CO2中所含的电子数目为16NA B、10.1 g N(C2H5)3中所含的非极性共价键数目为1.8NA C、22 g CO2与N2O混合物中所含氧原子的数目为NA D、100 g 46%的甲酸水溶液中所含的氧原子数目为5NA3. 利托那韦可用于新冠肺炎的治疗,如图所示物质为合成利托那韦的原料之一,下列有关该物质的说法正确的是( )
A、标准状况下,22.4 L CO2中所含的电子数目为16NA B、10.1 g N(C2H5)3中所含的非极性共价键数目为1.8NA C、22 g CO2与N2O混合物中所含氧原子的数目为NA D、100 g 46%的甲酸水溶液中所含的氧原子数目为5NA3. 利托那韦可用于新冠肺炎的治疗,如图所示物质为合成利托那韦的原料之一,下列有关该物质的说法正确的是( ) A、与苯甲酸甲酯(
A、与苯甲酸甲酯( )互为同系物
B、分子式为Cl12H12O5N2S
C、苯环上的一溴代物有2种(不含立体结构)
D、能发生加成反应,不能发生取代反应
4. 利用烟气中SO2可回收废水中的 ,实现碘单质的再生,其反应原理如下图所示
)互为同系物
B、分子式为Cl12H12O5N2S
C、苯环上的一溴代物有2种(不含立体结构)
D、能发生加成反应,不能发生取代反应
4. 利用烟气中SO2可回收废水中的 ,实现碘单质的再生,其反应原理如下图所示
下列说法错误的是( )
A、 中Co的化合价为+3价 B、总反应离子方程式为: C、反应①~⑤中均有电子的转移 D、反应③中,每消耗1molO2会转移2mol电子5. 根据实验目的,设计相关实验,下列实验操作、现象解释及结论都正确的是( )序号
操作
现象
解释或结论
A
在含0.1 mol的AgNO3溶液中依次加入NaCl溶液和KI溶液
溶液中先有白色沉淀生成,后来又变成黄色
Ksp(AgCl)>Ksp(AgI)
B
取FeSO4少许溶于水,加入几滴KSCN溶液
溶液变红色
FeSO4全部被氧化
C
将纯净的乙烯气体通入酸性KMnO4溶液
溶液紫色褪去
乙烯具有还原性
D
在Ca(ClO)2溶液中通入SO2气体
有沉淀生成
酸性: H2SO3> HClO
A、A B、B C、C D、D6. 我国科研团队设计了一种表面锂掺杂的锡纳米粒子催化剂s-SnLi可提高电催化制甲酸盐的产率,同时释放电能,实验原理如图所示。下列说法错误的是 ( ) A、放电时,每生成1 mol HCOO- , 转移NA个电子 B、充电时,Zn电极周围pH升高 C、使用催化剂Sn或者s-SnLi均能有效减少副产物CO的生成 D、与催化剂Sn相比,使用s-SnLi催化剂时,中间产物能量高,更不稳定7. 甲胺(CH3NH2)与盐酸反应生成甲胺盐酸盐(CH3NH3Cl)。25℃时,向一定体积0.01mol·L-1CH3NH2水溶液(对应图中M点)中缓慢通入HCl气体,溶液的pH与pOH[pOH=-lgc(OH-)的关系如图所示。下列叙述错误的是( )
A、放电时,每生成1 mol HCOO- , 转移NA个电子 B、充电时,Zn电极周围pH升高 C、使用催化剂Sn或者s-SnLi均能有效减少副产物CO的生成 D、与催化剂Sn相比,使用s-SnLi催化剂时,中间产物能量高,更不稳定7. 甲胺(CH3NH2)与盐酸反应生成甲胺盐酸盐(CH3NH3Cl)。25℃时,向一定体积0.01mol·L-1CH3NH2水溶液(对应图中M点)中缓慢通入HCl气体,溶液的pH与pOH[pOH=-lgc(OH-)的关系如图所示。下列叙述错误的是( ) A、图中a=2.7,b=7 B、该过程中, 增大 C、Q点溶液中溶质为CH3NH3Cl和CH3NH2 D、N点溶液中:c( )=c(Cl-)
A、图中a=2.7,b=7 B、该过程中, 增大 C、Q点溶液中溶质为CH3NH3Cl和CH3NH2 D、N点溶液中:c( )=c(Cl-)二、综合题
-
8. 碳酸镧[La2(CO3)3]是一种用于治疗高磷血症的新型药物,实验室模拟利用碳酸氢铵溶液和氯化镧溶液反应制备水合碳酸镧[La2(CO3)3·xH2O]。
已知:①La2(CO3)3·xH2O 为白色晶体,难溶于水,可溶于稀酸。
②若溶液碱性太强,易生成难溶 于水、受热易分解的碱式碳酸镧[La(OH)CO3]。
(1)、Ⅰ.模拟制备水合碳酸镧,实验装置如下图所示(夹持装置已省略)。
试剂X是 , 仪 器a的名称是。
(2)、制备过程中浓氨水滴速不能太快,原因是。。(3)、写出该实验制备La2(CO3)3·xH2O的化学方程式 。(4)、Ⅱ.产品成分探究甲小组认为产品中可能混有可溶性LaCl3、NH4Cl 等杂质,请设计实验方案检验Cl-是否存在。
(5)、乙小组认为产品中可能含有难溶性碱式碳酸镧[La(OH)CO3]。实验装置及步骤如图所示(夹持装置已省略)。
①检查装置气密性,将已除去可溶性杂质的产品装入质量为m1g的硬质石英玻璃管中。
②打开K1、K2和K3 , 缓缓通入N2数分钟后关闭K1、K3 , 打开K4 , 点燃酒精喷灯加热。
③一段时间后停止加热,打开K1 , 通入N2数分钟后关闭K1和K2 , 冷却到室温,称量硬质石英玻璃管。重复上述操作步骤直至恒重,记为m2g[此时硬质石英玻璃管中固体为La2O3(Mr=326)]。 称量装置C,质量增加m3g。实验中第二次通入N2的目的是。根据实验数据计算,n(La):n(C)=(用含m1、m2、m3的计算式表示)。若 ,说明产品不含La(OH)CO3。
9. As2O3在医药、电子等领域有重要应用。某含砷元素(As)的工业废水[砷主要以亚砷酸(H3AsO3)形式存在]通过如下流程转化为粗As2O3。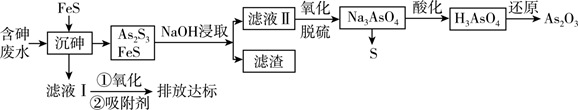
已知:Ⅰ. As2S3+ 6NaOH = Na3AsO3 + Na3AsS3+ 3H2O
Ⅱ. As2S3(s) + 3S2-(aq) 2 (aq)
Ⅲ.砷酸(H3AsO4)在酸性条件下有强氧化性,能被SO2、氢碘酸等还原。
(1)、As2S3中砷元素的化合价为价。(2)、“沉砷”过程中FeS是否可以用过量的Na2S替换(填“是”或“否”);请从平衡移动的角度解释原因:。(3)、向滤液Ⅱ中通入氧气进行“氧化脱硫”,写出脱硫的离子反应方程式。(4)、用SO2“还原”过程中,发生反应的化学方程式为。若需检验还原后溶液中是否仍存在砷酸。则还需要的实验试剂有。(5)、“还原”后加热溶液,H3AsO3分解为As2O3 , 同时结晶得到粗As2O3 , As2O3在不同温度和不同浓度硫酸中的溶解度(S)曲线如图所示。为了提高粗As2O3的沉淀率,“结晶”需要控制的具体条件是。 (6)、含砷废水也可采用另一种化学沉降法处理:向废水中先加入适量氧化剂,再加入生石灰调节pH,将砷元素转化为Ca3(AsO4)2沉淀。若沉降后上层清液中c(Ca2+)为2×10-3mol/L,则溶液中 的浓度为mol/L。(已知Ksp[Ca3(AsO4)2]=8×10-19)10. 含氮化合物在生活、生产、研究领域至关重要。回答下列问题。已知:
(6)、含砷废水也可采用另一种化学沉降法处理:向废水中先加入适量氧化剂,再加入生石灰调节pH,将砷元素转化为Ca3(AsO4)2沉淀。若沉降后上层清液中c(Ca2+)为2×10-3mol/L,则溶液中 的浓度为mol/L。(已知Ksp[Ca3(AsO4)2]=8×10-19)10. 含氮化合物在生活、生产、研究领域至关重要。回答下列问题。已知:Ⅰ. 2H2(g)+O2(g) 2H2O(g) ΔH1= -483.6 kJ·mol-1
Ⅱ.N2(g)+O2(g) 2NO(g) ΔH2 = +180.5 kJ·mol-1
Ⅲ.2H2(g)+ 2NO(g) N2(g)+ 2H2O(g) ΔH3
(1)、若已知反应III的正反应活化能为Ea kJ·mol-1 , 则逆反应活化能为kJ·mol -1(用含Ea的式子表示)。(2)、在刚性容器中按投料比 =1发生反应Ⅲ,不同催化剂条件下,反应相同时间时,测得NO转化率与温度的关系如图1。
图1
①下列能够说明该反应已达到化学平衡状态的是
A.2v逆 (NO)=v 正(N2)
B.混合气体的密度不再变化
C.容器内总压强不再变化
D.混合气体的平均相对分子质量不再变化
②使用催化剂乙、温度高于350℃时,NO 转化率降低的原因可能是。
③研究表明该反应v= kcm(H2)c2(NO),其中k为速率常数,与温度、活化能有关。T1℃的初始速率为v0 , 当H2转化率为50%时,反应速率为 ,由此可知m=。设此时反应的活化能为Ea',不同温度T1、T2条件下对应的速率常数分别为k1、k2 , 存在关系: (R为常数)。据此推测:活化能越大,升高温度,速率常数增大倍数。 (填“越大”“越小”或“不变”)
(3)、工业上常利用反应N2(g)+ 3H2(g) 2NH3(g) ΔH<0合成氨气,在30 MPa、不同物质的量分数(75%的H2和25%的N2; 67.5%的 H2、22.5%的 N2和10%的惰性气体)条件下进行实验,测得平衡时,NH3体积分数与温度的关系如图2。
图2
①物质的量分数为: 75%的H2和25%的N2所对应的曲线是。 (填“a”或“b”)
②M点时,N2的转化率为;该 反应的压强平衡常数Kp= (MPa)-2(用平衡分压代替平衡浓度,分压=总压×物质的量分数)。
11. 2022年2月我国科学家在《科学》杂志发表反型钙钛矿太阳能电池研究方面的最新科研成果论文,为钙钛矿电池研究开辟新方向。(1)、基态钛原子的py原子轨道上的电子数为个。 与钛同周期的第ⅡA族和ⅢA族两种元素中第一电离能较大的是 (写 元素符号)。(2)、Ti的配合物有多种。在Ti(CO)6、T(H2O) 和TiF 三种微粒的配体中,所含原子电负性由大到小排序后,排第3位的元素是(写元素符号), Ti(H2O) 中∠H-O-H(填大于、小于或等于)单个水分子中∠H-O-H,原因为 ; Ti(NO3)4的球棍结构如图,Ti 的配位数是 , N原子的杂化方式为 , 与NO 互为等电子体的分子为 (写分子式) (3)、钛白粉学名为二氧化钛,它是一种染料及颜料,其化学式为TiO2 , 如图为TiO2的晶胞结构图,回答:已知微粒1、2的坐标分别为(0,0, 0)和(0.31, 0.31, 0), 则微粒3的坐标为 ; 设阿伏加德罗常数的值为NA , TiO2的密度为g·cm-3(列出计算式)。
(3)、钛白粉学名为二氧化钛,它是一种染料及颜料,其化学式为TiO2 , 如图为TiO2的晶胞结构图,回答:已知微粒1、2的坐标分别为(0,0, 0)和(0.31, 0.31, 0), 则微粒3的坐标为 ; 设阿伏加德罗常数的值为NA , TiO2的密度为g·cm-3(列出计算式)。 12. 化合物M是一种医药中间体,实验室中M的一种合成路线如下:
12. 化合物M是一种医药中间体,实验室中M的一种合成路线如下:
已知:
①

②

③一个碳原子连接两个—OH不稳定,易自动脱水
回答下列问题:
(1)、A中官能团的名称为;B的化学名称为;由C生成D的反应类型为。(2)、F的结构简式为;由F生成G所需试剂和条件为。(3)、由G生成M的化学方程式为。(4)、Q为D的同分异构体,同时满足下列条件的Q的所有结构简式有种(不含立体异构)。①苯环上连有5个取代基;
②既含 ,又能与银氨溶液发生银镜反应。
(5)、参照上述合成路线和信息,以2-丙醇和苯为原料(无机试剂任选),设计制备 的合成路线。
的合成路线。