天津市河西区2021-2022学年高三下学期第一次模拟考试化学试题
试卷更新日期:2022-05-23 类型:高考模拟
一、单选题
-
1. 我国科学家研究制得一种用于骨科治疗的合金,其中含锌( )、铟( )、锡( )和铋( ),下列有关说法正确的是( )A、 是短周期元素 B、 晶体属于金属晶体 C、 是周期表中s区元素 D、该合金的熔点、硬度等与锌等各组分的相同2. 下列说法涉及物质的氧化性或还原性的是( )A、用葡萄糖制镜 B、用硫酸铝净水 C、用小苏打作食品膨松剂 D、用氟化物添加在牙膏中预防龋齿3. 我国在核酸的研究中取得了卓越成绩。下列有关核酸的叙述错误的是( )A、 中含磷酯键 B、 两条链上的碱基通过化学键作用相连接 C、可通过分析核酸水解的产物推测其组成与结构 D、根据组成中所含戊糖的不同分为 和4. 向 溶液中滴入几滴酚酞溶液后,匀速逐滴加入 溶液,过程中测得混合溶液的电导率变化如下图所示。下列有关说法正确的是( )
 A、 间溶液中仅 降低 B、该反应的离子方程式为 C、溶液颜色逐渐变浅说明 是难溶电解质 D、由 时溶液的导电率数值可推理知 不是强电解质5. 人工合成某信息素分子的结构简式如下图所示,它是昆虫之间传递信号的一种化学物质,能诱捕害虫等。下列有关说法正确的是( )
A、 间溶液中仅 降低 B、该反应的离子方程式为 C、溶液颜色逐渐变浅说明 是难溶电解质 D、由 时溶液的导电率数值可推理知 不是强电解质5. 人工合成某信息素分子的结构简式如下图所示,它是昆虫之间传递信号的一种化学物质,能诱捕害虫等。下列有关说法正确的是( ) A、含有醚键 B、所有碳原子可能共平面 C、 碳原子属于手性碳 D、 碳原子为 杂化6. 下列说法正确的是( )A、 能与 以配位键结合 B、 与 分子的空间结构均为四面体形 C、 的沸点比 的高,是因 分子间存在氢键 D、 比 更易溶于水,是因 是极性键而 是非极性键7. 已知纯苯甲酸为无色结晶,熔点 ,沸点 ,微溶于水、易溶于乙醇,它在水中的溶解度: 、 、 。现有含少量 和泥沙的某粗苯甲酸样品,提纯苯甲酸实验中涉及的装置或操作错误的是( )A、加热溶解
A、含有醚键 B、所有碳原子可能共平面 C、 碳原子属于手性碳 D、 碳原子为 杂化6. 下列说法正确的是( )A、 能与 以配位键结合 B、 与 分子的空间结构均为四面体形 C、 的沸点比 的高,是因 分子间存在氢键 D、 比 更易溶于水,是因 是极性键而 是非极性键7. 已知纯苯甲酸为无色结晶,熔点 ,沸点 ,微溶于水、易溶于乙醇,它在水中的溶解度: 、 、 。现有含少量 和泥沙的某粗苯甲酸样品,提纯苯甲酸实验中涉及的装置或操作错误的是( )A、加热溶解 B、50℃时过滤出泥沙
B、50℃时过滤出泥沙  C、冷却结晶
C、冷却结晶  D、过滤出晶体
D、过滤出晶体  8. NA代表阿伏加德罗常数的值。下列说法正确的是( )A、 含中子的数目为10NA B、 中含 键的数目为2NA C、同温同压下 与 所含原子数目均为4NA D、 酸性溶液中含 的数目为0.1NA9. 根据下表给出的信息
8. NA代表阿伏加德罗常数的值。下列说法正确的是( )A、 含中子的数目为10NA B、 中含 键的数目为2NA C、同温同压下 与 所含原子数目均为4NA D、 酸性溶液中含 的数目为0.1NA9. 根据下表给出的信息元素及其性质或结构特点
第m周期元素
第 周期元素
X
该元素最高价氧化物既溶于盐酸又溶于 溶液
Q
焰色反应为紫色
Y
原子最高能层上仅有1个电子
W
与Z属于同主族元素
Z
该周期中原子半径最小
推断下列说法错误的是( )
A、 品体中含有离子键 B、氧化性: C、第一电离能: D、元素的金属性:10. 常用于检测酒驾的酸性燃料电池酒精检测仪工作原理如下图所示。下列说法错误的是( ) A、电子从左侧 电极经导线转移到右侧 电极 B、该电池工作时质子从左池经交换膜向右池迁移 C、负极反应式: D、每消耗标准状况下 时理论上生成11. 室温下, ,现有浓度均为 的 溶液、 溶液,下列说法错误的是( )A、 溶液中 B、若将两溶液等体积混合,混合溶液的 C、两溶液中均存在 D、两溶液中由水电离产生的 较大的是 溶液12. 和 存在平衡: 。下列分析正确的是( )A、 平衡混合气体中含N原子大于 B、恒温时,缩小容积,气体颜色变深,是平衡正向移动导致的 C、恒容时,充入少量 ,平衡正向移动导致气体颜色变浅 D、断裂 中的共价健所需能量大于断裂 中的共价健所需能量
A、电子从左侧 电极经导线转移到右侧 电极 B、该电池工作时质子从左池经交换膜向右池迁移 C、负极反应式: D、每消耗标准状况下 时理论上生成11. 室温下, ,现有浓度均为 的 溶液、 溶液,下列说法错误的是( )A、 溶液中 B、若将两溶液等体积混合,混合溶液的 C、两溶液中均存在 D、两溶液中由水电离产生的 较大的是 溶液12. 和 存在平衡: 。下列分析正确的是( )A、 平衡混合气体中含N原子大于 B、恒温时,缩小容积,气体颜色变深,是平衡正向移动导致的 C、恒容时,充入少量 ,平衡正向移动导致气体颜色变浅 D、断裂 中的共价健所需能量大于断裂 中的共价健所需能量二、综合题
-
13. 锑钾 合金、镍钴锰酸锂[ 、 ]、磷酸铁钠[ ]分别作为钾离子电池、三元锂离子电池、钠离子电池的电极材料。这些电池成为目前实现碳中和研发的热点。请按要求回答下列问题。(1)、上述电池涉及的主族元素中,电负性最大的是。(2)、 是比P的周期数大2的同主族元素。基态 原子价电子排布式为。(3)、在回收电极材料中的 时,测得溶液中 ,通入 生成 沉淀,则 沉淀完全时溶液的 最小为 (已知沉淀完全时 。此温度下 ,溶液体积变化忽略不计)。(4)、钠离子电池电极材料制备:向含 的溶液中加入过量 溶液,过滤后进一步处理得 沉淀。然后将 与 混合,在 气氛中加热,制得 。
已知常温下 , ; , 。
①钠离子电池工作时, 转化为 ,则 在电池(填“正”或“负”)极放电。
② 在制 的反应中的作用:。
③ 溶液中含P元素离子的浓度由大到小的顺序为。
(5)、立方晶系锑钾合金的晶胞结构如图1所示,其中品胞的一部分如图2所示。
①该晶胞中, 和K的原子数之比为。
②该晶体的密度为 (设阿伏加德罗常数的值为 ,用含a、 的代数式表示)。
14. 人们不断探索将燃油汽车尾气中的 与 有害气体无毒转化,并将 进行甲烷化实现碳中和,请结合相关信息按要求回答下列问题。(1)、已知常温常压下 。①燃油汽车尾气仍含有较多 、 的可能原因是。
②写出一项有效提升尾气达到排放标准的措施:。
(2)、在 负载型金属催化作用下,可实现 低温下甲烷化。反应分如下三步进行:反应Ⅰ:
反应Ⅱ:…………
反应Ⅲ:
①出反应Ⅱ 和 生成 和 的热化学方程式:。
②在不同温度下, 负载型金属催化作用下,反应Ⅲ进行结果如下图所示,其中 选择性= 。

i.反应Ⅲ的平衡常数的表达式为。
ii.在测定温度内,该催化剂对 甲烷化反应的最适宜温度为 , 理由:。
iii. 时,在上述实验条件下向某装有该催化剂的密闭容器中通入 和 ,充分反应后生成 的物质的量为。
15. 某医药合成中间体F的合成路线如下图所示: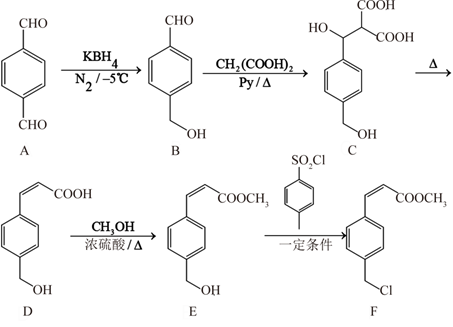
请按要求回答下列问题:
(1)、A的分子式为;B分子含有的官能团有(填名称)。(2)、A B的反应类型为。(3)、在D E反应过程中, 可能自身反应生成有机副产物G,G的结构简式:。(4)、写出E F反应的化学方程式:。(5)、M是B的同分异构体,其中满足下列所有条件的结构简式有(不含B)种:①含碳氧双键(
 )②含苯环且苯环上仅对位有取代基
)②含苯环且苯环上仅对位有取代基写出其中能与 溶液反应的结构简式:。
(6)、快递用生鲜冰袋中含有的聚丙烯酸钠,可以甲醛、丙二酸( )和必要的无机试剂为原料制得。请参考题干合成路线及反应条件,在如下方框中写出其合成路线的流程图。 16. 某小组为探究 和 的化学性质特点及其参与反应的限度,设计并进行如下四个实验,得到部分现象和数据。请围绕实验目的,按要求回答下列问题。
16. 某小组为探究 和 的化学性质特点及其参与反应的限度,设计并进行如下四个实验,得到部分现象和数据。请围绕实验目的,按要求回答下列问题。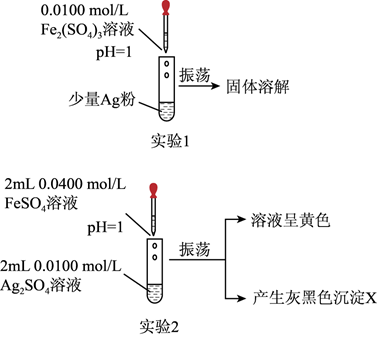 (1)、实验1:如图所示,可得出的实验结论是。该实验不选用 的原因是。(2)、实验2:取出如图中沉淀X于烧杯中,滴入少量浓硝酸,立刻观察到有红棕色气体产生。
(1)、实验1:如图所示,可得出的实验结论是。该实验不选用 的原因是。(2)、实验2:取出如图中沉淀X于烧杯中,滴入少量浓硝酸,立刻观察到有红棕色气体产生。①写出实验2试管中发生反应的离子方程式:。
②请用离子方程式解释产生红棕色气体的原因:。
(3)、实验3:为进一步证明实验1反应是可逆的,用如图装置进行验证。闭合开关K,电流计指针向右偏转,一段时间后指针归零。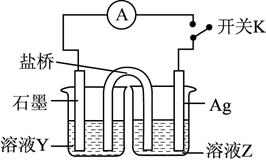
①溶液Y为。
②为实现该实验目的,接下来的操作及现象为。
(4)、实验4:为定量认识实验2中反应限度情况,查阅资料知, 下, (白色) (红色),取实验2试管中充分反应静置后的上层清液 ,用 标准溶液滴定,至终点时消耗 标准溶液。
①判断滴定终点现象为;
②实验2试管中反应的平衡常数 。
③不取用实验1反应后所得清液测定反应的平衡常数的原因: 。