上海市徐汇区2022届高三二模化学试题
试卷更新日期:2022-05-23 类型:高考模拟
一、单选题
-
1. 白铜(铜镍合金)常用于制作仿银饰品。下列关于白铜的说法错误的是( )A、银白色 B、硬度比镍的大 C、具有金属光泽 D、熔点比铜的高2. 新制氯水中没有的微粒是( )A、 B、 C、 D、3. 北京冬奥会使用了更节能环保的CO2跨临界直冷制冰技术。下列关于CO2的说法正确的是( )A、结构式:O-C-O B、电子式:
 C、分子构型:直线形
D、球棍模型:
C、分子构型:直线形
D、球棍模型:  4. 高纯度的锗是一种半导体材料,下图是锗在元素周期表中的信息,下列说法正确的是( )
4. 高纯度的锗是一种半导体材料,下图是锗在元素周期表中的信息,下列说法正确的是( ) A、位于VIA族,处于金属元素与非金属元素分界处 B、原子序数为32 C、最外层电子数为2 D、原子的相对原子质量为72.615. 向下列溶液中通入SO2气体,溶液不会褪色的是( )A、品红 B、溴水 C、红色石蕊溶液 D、酸性高锰酸钾6. 煤是重要的化石能源,下列说法错误的是( )A、煤属于芳香烃 B、煤干馏可以得到粗氨水 C、煤是不可再生资源 D、将煤气化能提高燃料的燃烧效率7. 下列过程属于人工固氮的是( )A、工业合成 B、 被催化氧化为 C、用 和 合成尿素 D、浓 与 反应生成8. 喷泉实验装置如图所示。应用下列各组气体—溶液,能出现喷泉现象的是( )
A、位于VIA族,处于金属元素与非金属元素分界处 B、原子序数为32 C、最外层电子数为2 D、原子的相对原子质量为72.615. 向下列溶液中通入SO2气体,溶液不会褪色的是( )A、品红 B、溴水 C、红色石蕊溶液 D、酸性高锰酸钾6. 煤是重要的化石能源,下列说法错误的是( )A、煤属于芳香烃 B、煤干馏可以得到粗氨水 C、煤是不可再生资源 D、将煤气化能提高燃料的燃烧效率7. 下列过程属于人工固氮的是( )A、工业合成 B、 被催化氧化为 C、用 和 合成尿素 D、浓 与 反应生成8. 喷泉实验装置如图所示。应用下列各组气体—溶液,能出现喷泉现象的是( )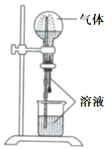
气体
溶液
A.
H2S
稀盐酸
B.
HCl
稀氨水
C.
NO
稀H2SO4
D.
CO2
饱和NaHCO3溶液
A、A B、B C、C D、D9. 草酸(HOOC-COOH)是一种有机二元弱酸,在人体中容易与 形成 导致肾结石。下列说法正确的是( )A、草酸属于非电解质 B、 溶液显中性 C、 能溶于水 D、草酸溶液中10. 下图装置适用于实验室制备( ) A、乙烯 B、溴苯 C、硝基苯 D、乙酸丁酯11. 1,3-异丙烯基苯(
A、乙烯 B、溴苯 C、硝基苯 D、乙酸丁酯11. 1,3-异丙烯基苯( )是工业上常用的交联剂,可用于制备高性能分子聚合物,下列关于1,3-异丙烯基苯的说法正确的是( ) A、在空气中燃烧火焰呈淡蓝色 B、分子中所有碳原子可能处于同一平面 C、与异丙烯基苯(
)是工业上常用的交联剂,可用于制备高性能分子聚合物,下列关于1,3-异丙烯基苯的说法正确的是( ) A、在空气中燃烧火焰呈淡蓝色 B、分子中所有碳原子可能处于同一平面 C、与异丙烯基苯( )互为同系物
D、可作为萃取剂将溴水中的溴分离出来
12. 下列化合物中同分异构体数目最少的是( )A、 B、 C、 D、13. 热交换器是用来使热量从热流体传递到冷流体,以满足规定的工艺要求的装置,是对流传热及热传导的一种工业应用。下列化工生产在接触室中使用热交换器的是( )A、氯碱工业 B、石油分馏 C、硫酸工业 D、索尔维制碱法14. 在硫酸盐还原细菌的作用下,深埋地下的铁管道与土壤中的硫酸根离子会发生电化学腐蚀,其原理如图所示。下列说法正确的是( )
)互为同系物
D、可作为萃取剂将溴水中的溴分离出来
12. 下列化合物中同分异构体数目最少的是( )A、 B、 C、 D、13. 热交换器是用来使热量从热流体传递到冷流体,以满足规定的工艺要求的装置,是对流传热及热传导的一种工业应用。下列化工生产在接触室中使用热交换器的是( )A、氯碱工业 B、石油分馏 C、硫酸工业 D、索尔维制碱法14. 在硫酸盐还原细菌的作用下,深埋地下的铁管道与土壤中的硫酸根离子会发生电化学腐蚀,其原理如图所示。下列说法正确的是( ) A、铁管道发生的是吸氧腐蚀 B、铁管道附近土壤的pH会减小 C、铁管道上镀锌可以延缓管道的腐蚀 D、输送高温水蒸汽的铁管道也会发生该类型腐蚀15. 下列推断合理的是( )A、O的非金属性比S大,可推断 比 稳定 B、电子云重叠程度 比 的大,可推断 比 稳定 C、 的相对分子质量比 小,可推断 的沸点比 的低 D、 具有氧化性,可推断过硫化氢( )也具有氧化性16. 一定温度下,在 的恒容密闭容器中发生反应 ,反应过程中的部分数据如下表所示。下列说法正确的是( )
A、铁管道发生的是吸氧腐蚀 B、铁管道附近土壤的pH会减小 C、铁管道上镀锌可以延缓管道的腐蚀 D、输送高温水蒸汽的铁管道也会发生该类型腐蚀15. 下列推断合理的是( )A、O的非金属性比S大,可推断 比 稳定 B、电子云重叠程度 比 的大,可推断 比 稳定 C、 的相对分子质量比 小,可推断 的沸点比 的低 D、 具有氧化性,可推断过硫化氢( )也具有氧化性16. 一定温度下,在 的恒容密闭容器中发生反应 ,反应过程中的部分数据如下表所示。下列说法正确的是( )n/mol
t/min
n(A)
n(B)
n(C)
0
2.0
2.4
0
5
0.9
10
1.6
15
1.6
A、物质B的平衡转化率为 B、该反应在 后才达到平衡 C、平衡状态时, D、 用A表示的平均反应速率为17. 对固体直接加热可除去杂质是(括号内为杂质)( )A、铁粉(硫粉) B、 C、 D、18. 向 溶液中通入一定量的 ,发生反应 ,下列关于该反应说法错误的是( )A、氧化性: B、还原性: C、参加反应的 与 的物质的量之比为1:1 D、被氧化的 占 总量的一半19. 氢气是一种清洁能源,下图是 和 反应生成 的能量变化示意图,由图可知( ) A、 B、生成 需要吸收 的能量 C、 和 具有的总能量比 所具有的总能量高 D、 ,断键吸收的能量小于成键释放的能量20. 室温时,将浓度和体积分别为 的 溶液和 的 溶液混合,下列关于混合溶液的叙述正确的是( )A、若 ,则一定是 B、若 ,则 C、当 时,若 ,则一定是 D、当 时,
A、 B、生成 需要吸收 的能量 C、 和 具有的总能量比 所具有的总能量高 D、 ,断键吸收的能量小于成键释放的能量20. 室温时,将浓度和体积分别为 的 溶液和 的 溶液混合,下列关于混合溶液的叙述正确的是( )A、若 ,则一定是 B、若 ,则 C、当 时,若 ,则一定是 D、当 时,二、综合题
-
21. 卤族元素在自然界中主要以卤化物形式存在,完成下列填空:(1)、工业电解铝以铝土矿(Al2O3)为原料,冰晶石(Na3AlF4)为助熔剂。
①铝土矿中 的晶体类型;
②比较 的简单离子半径大小;
③ 最外层电子的电子云形状为。
(2)、从海水中获取的 主要用于氯碱工业,写出阳极的电极反应。(3)、采用“空气吹出法”从浓海水中吹出 ,并用纯碱吸收。纯碱吸收 的主要反应为: ,吸收 时,转移电子为mol。(4)、工业生产纯碱的方法是:向饱和食盐水中通入 和 ,即有 晶体析出。结合速率与平衡理论解释 析出的原因。(5)、向碘水溶液中通入过量的 ,发生反应: ,配平上述方程式。22. 不锈钢具有良好的耐腐蚀性和耐磨性,铬(Cr)是不锈钢的重要成分。完成下列填空:(1)、I.通过 可以得到较纯的铬, 的熔点比 。(选填“高”或“低”),某工厂用 含 的铬铁矿粉 制备 ,最终得到产品bkg,产率为。(用含a和b的代数式表示)(2)、II.元素 在溶液中主要以(蓝紫色)、 (绿色)、 (橙红色)、 (黄色)等形式存在, 为难溶于水的灰蓝色固体。与 的化学性质相似,在 溶液中逐滴加入 溶液直至过量,可观察到的现象是。
(3)、III. 和 在溶液中可以相互转化。室温下,初始浓度为 溶液中 随 的变化如图所示。
用离子方程式表示 溶液中的转化平衡。
(4)、写出该反应平衡常数的表达式K=。(5)、由图可知,溶液酸性增强, 的平衡转化率。(选填“增大”、“减小”或“不变”)(6)、升高温度,溶液中 的平衡转化率减小,则该反应是反应。(选填“吸热”或“放热”)23. G是一种药物中间体,可用于制备抗病毒药物,以下是G的一种合成路线。
已知:
 ,完成下列填空:(1)、A→B反应所需的试剂和条件。(2)、B→C的反应类型。(3)、C中含氧的官能团有醚键和。(4)、检验B物质中-Br的实验操作。(5)、F→G反应的化学方程式。(6)、写出满足下列条件,C的同分异构体的结构简式。
,完成下列填空:(1)、A→B反应所需的试剂和条件。(2)、B→C的反应类型。(3)、C中含氧的官能团有醚键和。(4)、检验B物质中-Br的实验操作。(5)、F→G反应的化学方程式。(6)、写出满足下列条件,C的同分异构体的结构简式。①属于芳香醇 ②有5种不同化学环境的H原子
(7)、参考以上合成路线及反应条件,以苯甲醇( )和丙二酸二乙酯(
)和丙二酸二乙酯(  )为原料,设计制备
)为原料,设计制备  的合成路线。
的合成路线。 (合成路线常用的表达方式为: )
24. 硫代硫酸钠晶体( )俗称大苏打,可用作定影剂、还原剂。实验室制备 溶液的装置如下(部分装置省略,C中 过量)。完成下列填空: (1)、装置A中的反应,体现浓硫酸的性。(2)、装置B的作用。(3)、装置C中的反应有多步,其中最后一步反应的化学方程式为: 。当观察到装置C中出现现象,说明反应已完全。(4)、市售 中常含有 杂质,为检验 ,需先向样品中加入过量稀盐酸,再滴加 溶液。加入稀盐酸后观察到有和刺激性气味气体生成。(5)、利用 标准溶液定量测定 的纯度。测定步骤如下:
(1)、装置A中的反应,体现浓硫酸的性。(2)、装置B的作用。(3)、装置C中的反应有多步,其中最后一步反应的化学方程式为: 。当观察到装置C中出现现象,说明反应已完全。(4)、市售 中常含有 杂质,为检验 ,需先向样品中加入过量稀盐酸,再滴加 溶液。加入稀盐酸后观察到有和刺激性气味气体生成。(5)、利用 标准溶液定量测定 的纯度。测定步骤如下:①溶液配制:称 样品,用(填仪器名称)配制成 溶液。
②滴定:取 标准溶液 ,硫酸酸化后加入过量 溶液,发生反应: 。然后用 溶液滴定至淡黄绿色,发生反应: 。加入少量淀粉作为指示剂,继续滴定,当溶液即为终点。平行滴定3次,样品溶液的平均用量为 ,则样品的纯度为(保留两位小数)。
(6)、相片显影液中的 ,可以洗掉胶卷上多余的 ,生成稳定的 ,该反应的离子方程式为。(7)、临床上, 可用于氰化物解毒,解毒原理为: 。检验该转化生成了 的操作为。