山东省德州市2022届高三第二次模拟考试化学试题
试卷更新日期:2022-05-23 类型:高考模拟
一、单选题
-
1. 2021年10月16日,搭载神舟十三号载人飞船的长征二号F遥十三运载火箭,在酒泉卫星发射中心按照预定时间精准点火发射,这是中国空间站关键技术验证阶段第六次飞行。下列叙述错误的是( )A、火箭箭体采用的高强度新型钛合金结构属于金属材料 B、航天员航天服上的橡胶属于有机高分子材料 C、二氧化硅是飞船搭载的太阳能电池板的核心材料 D、航天员手臂“延长器”——操纵棒中的碳纤维材料属于新型材料2. 下列有关物质性质及其应用叙述正确的是( )A、利用FeS的还原性,处理废水中的Hg2+ B、利用MgCl2溶液的导电性,电解MgCl2溶液制Mg C、利用非金属性C>Si,工业上用C与SiO2反应制备粗Si D、利用H2O2的氧化性处理古画中变黑的颜料( PbS)恢复白色(PbSO4)3. 关于下列实验装置的说法正确的是( )
 A、图甲可用来制备小苏打 B、图乙能保证较长时间观察到白色沉淀 C、图丙可实现蒸发Na2CO3溶液得到Na2CO3固体 D、图丁可以实现石油分馏4. 短周期主族元素W、X、Y、Z的原子序数依次增大,且总和为24,四种元素组成的化合物(如图所示),具有良好的储氢性能。下列有关叙述正确的是( )
A、图甲可用来制备小苏打 B、图乙能保证较长时间观察到白色沉淀 C、图丙可实现蒸发Na2CO3溶液得到Na2CO3固体 D、图丁可以实现石油分馏4. 短周期主族元素W、X、Y、Z的原子序数依次增大,且总和为24,四种元素组成的化合物(如图所示),具有良好的储氢性能。下列有关叙述正确的是( ) A、该化合物中X、Y和W原子间均存在配位键 B、Y的最高价氧化物的水化物一定为强酸 C、离子半径:Z>Y>W D、电负性顺序:X>Y>W5. 下列由实验现象所得结论正确的是( )A、向苯酚钠溶液中通入二氧化碳,溶液变浑浊,证明碳酸的pH比苯酚小 B、检验FeCl3溶液中是否混有Fe2+时,滴入酸性高锰酸钾溶液,紫红色褪去,证明含有Fe2+ C、向两支盛KI溶液的试管中分别滴加淀粉和硝酸银溶液,前者变蓝,后者生成黄色沉淀,证明存在: I2+I- D、向0.1mol/L ZnSO4溶液中滴加Na2S溶液至不再有白色沉淀生成,再滴加少量0.1mol/L CuSO4溶液,产生黑色沉淀,证明Ksp(ZnS)<Ksp(CuS)6. 下列有关计算正确的是( )A、Na2O2作供氧剂时,每生成5.6 L O2 (标况),转移电子数为0. 25NA B、1.92 g Cu与足量稀硝酸反应,被还原硝酸的物质的量为0.02 mol C、利用铝热反应制备金属时,每得到1 mol Fe,一定消耗0.5 mol氧化剂 D、已知NH3的燃烧热为316.25 kJ/mol,则NH3燃烧的热化学方程式为:4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-1265 kJ/mol7. 实验室制备苯胺的流程
A、该化合物中X、Y和W原子间均存在配位键 B、Y的最高价氧化物的水化物一定为强酸 C、离子半径:Z>Y>W D、电负性顺序:X>Y>W5. 下列由实验现象所得结论正确的是( )A、向苯酚钠溶液中通入二氧化碳,溶液变浑浊,证明碳酸的pH比苯酚小 B、检验FeCl3溶液中是否混有Fe2+时,滴入酸性高锰酸钾溶液,紫红色褪去,证明含有Fe2+ C、向两支盛KI溶液的试管中分别滴加淀粉和硝酸银溶液,前者变蓝,后者生成黄色沉淀,证明存在: I2+I- D、向0.1mol/L ZnSO4溶液中滴加Na2S溶液至不再有白色沉淀生成,再滴加少量0.1mol/L CuSO4溶液,产生黑色沉淀,证明Ksp(ZnS)<Ksp(CuS)6. 下列有关计算正确的是( )A、Na2O2作供氧剂时,每生成5.6 L O2 (标况),转移电子数为0. 25NA B、1.92 g Cu与足量稀硝酸反应,被还原硝酸的物质的量为0.02 mol C、利用铝热反应制备金属时,每得到1 mol Fe,一定消耗0.5 mol氧化剂 D、已知NH3的燃烧热为316.25 kJ/mol,则NH3燃烧的热化学方程式为:4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-1265 kJ/mol7. 实验室制备苯胺的流程 ,②的实验装置(无及苯胺加热装置略)如图所示。已知点:苯胺为有色油状液体,沸腾184℃易生成。以下正确的是( )
,②的实验装置(无及苯胺加热装置略)如图所示。已知点:苯胺为有色油状液体,沸腾184℃易生成。以下正确的是( )  A、反应①后的混合液经水洗、碱洗、结晶,得到硝基苯 B、①反应和反应②均需水浴取暖 C、装置中为取消反应的水,放映前需关闭制片方加入KP三颈烧瓶中2 O 5 D、为生成的苯胺被氧化,加热前应先通阻的H28. 以镀镍行业产生的含铁、铜、锌等杂质的酸性硫酸镍废液为原料获得NiSO4·6H2O,其工艺流程如下:(已知:Ksp[Ni(OH)2]=2.0×10-15、Ksp[Cu(OH)2]=4.8×10-20 , Ksp[Zn(OH)2]=2. 09×10-20)。下列说法错误的是( )
A、反应①后的混合液经水洗、碱洗、结晶,得到硝基苯 B、①反应和反应②均需水浴取暖 C、装置中为取消反应的水,放映前需关闭制片方加入KP三颈烧瓶中2 O 5 D、为生成的苯胺被氧化,加热前应先通阻的H28. 以镀镍行业产生的含铁、铜、锌等杂质的酸性硫酸镍废液为原料获得NiSO4·6H2O,其工艺流程如下:(已知:Ksp[Ni(OH)2]=2.0×10-15、Ksp[Cu(OH)2]=4.8×10-20 , Ksp[Zn(OH)2]=2. 09×10-20)。下列说法错误的是( ) A、用KSCN溶液可以检验滤液中Fe3+是否除干净 B、萃取的目的是除去Cu2+和Zn2+ , 反萃取获得的有机物可循环使用 C、萃取振荡时分液漏斗的下口应倾斜向上 D、操作II的名称为蒸发结晶、过滤、洗涤干燥9. 咪唑是分子结构中含有两个间位氮原子的五元芳杂环化合物,该类化合物在医学上有着重要的用途。如:咪唑(
A、用KSCN溶液可以检验滤液中Fe3+是否除干净 B、萃取的目的是除去Cu2+和Zn2+ , 反萃取获得的有机物可循环使用 C、萃取振荡时分液漏斗的下口应倾斜向上 D、操作II的名称为蒸发结晶、过滤、洗涤干燥9. 咪唑是分子结构中含有两个间位氮原子的五元芳杂环化合物,该类化合物在医学上有着重要的用途。如:咪唑(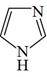 )和N-甲基咪唑(
)和N-甲基咪唑(  )都是合成医药中间体的重要原料,下列有关说法错误的是( ) A、基态N原子的价电子轨道表示式
)都是合成医药中间体的重要原料,下列有关说法错误的是( ) A、基态N原子的价电子轨道表示式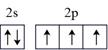 B、
B、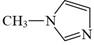 与
与 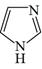 中C、N原子均在同一平面上
C、
中C、N原子均在同一平面上
C、
D、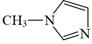 与
与 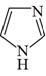 中含σ键个数比为3:2
中含σ键个数比为3:2 与
与 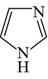 中的N原子均采取sp2杂化
10. 捕集利用二氧化碳是我国能源领域的一个重要战略方向,科学者利用电解法将CO2转化为甲醇的原理如图所示,下列说法错误的是( )
中的N原子均采取sp2杂化
10. 捕集利用二氧化碳是我国能源领域的一个重要战略方向,科学者利用电解法将CO2转化为甲醇的原理如图所示,下列说法错误的是( ) A、a电极为阳极 B、阴极上发生电极反应式为CO2 +6 +6e-=CH3OH+6 +H2O C、产生1 mol O2时,通过质子交换膜的质子的物质的量为4 mol D、电解过程中左侧需补充H2O,右侧需补充KHCO3溶液11. 下列实验所选择的仪器和试剂准确完整的是( )
A、a电极为阳极 B、阴极上发生电极反应式为CO2 +6 +6e-=CH3OH+6 +H2O C、产生1 mol O2时,通过质子交换膜的质子的物质的量为4 mol D、电解过程中左侧需补充H2O,右侧需补充KHCO3溶液11. 下列实验所选择的仪器和试剂准确完整的是( )实验目的
玻璃仪器
试剂
A
测定NaHCO3的浓度
酸式滴定管、锥形瓶、烧杯
待测NaHCO3溶液、标准盐酸溶液、甲基橙指示剂
B
检测稀硫酸作用后的淀粉是否水解
试管、胶头滴管、酒精灯
氢氧化钠溶液、硫酸铜溶液
C
对比Fe3+、Cu2+对H2O2分解的催化效果
试管、胶头滴管
5%H2O2溶液、0. 1 mol/L Fe2(SO4)3溶液、0.1 mol/L CuSO4溶液
D
除去粗盐中的 、Ca2+、Mg2+杂质
试管、普通漏斗、胶头滴管
稀盐酸、BaCl2、Na2CO3溶液
A、A B、B C、C D、D12. 双环戊二烯解聚成环戊二烯反应如下,下列说法错误的是( ) A、可用红外光谱或质谱鉴别双环戊二烯与环戊二烯 B、环戊二烯的二氯代物有10 种(不考虑立体异构) C、双环戊二烯中有4个手性碳原子 D、环戊二烯和双环戊二烯分别与Br2进行1:1加成的产物均有两种13. 在恒温恒容密闭容器中发生反应2H2(g)+2NO(g) 2H2O(g) +N2(g),N2的瞬时生成速率v=k·cm(H2)c2 (NO)。控制NO起始浓度为0.5 mol/L,N2的瞬时生成速率和H2起始浓度的关系如图所示,下列说法正确的是( )
A、可用红外光谱或质谱鉴别双环戊二烯与环戊二烯 B、环戊二烯的二氯代物有10 种(不考虑立体异构) C、双环戊二烯中有4个手性碳原子 D、环戊二烯和双环戊二烯分别与Br2进行1:1加成的产物均有两种13. 在恒温恒容密闭容器中发生反应2H2(g)+2NO(g) 2H2O(g) +N2(g),N2的瞬时生成速率v=k·cm(H2)c2 (NO)。控制NO起始浓度为0.5 mol/L,N2的瞬时生成速率和H2起始浓度的关系如图所示,下列说法正确的是( ) A、由题可知,该反应的速率常数k为15 B、随着H2起始浓度增大,该反应平衡常数增大 C、达平衡后,H2和NO的浓度均增加一倍,则NO转化率减小 D、H2起始浓度0.2 mol/L,某时刻NO的浓度为0.4 mol/L,则N2的瞬时生成速率为0.24 mol/L14. 常温下,用0.1 mol/LNaOH溶液滴定20 mL等浓度的H3A,得到pH与lgX[X= 或 或 ]的关系如图所示。下列说法错误的是( )
A、由题可知,该反应的速率常数k为15 B、随着H2起始浓度增大,该反应平衡常数增大 C、达平衡后,H2和NO的浓度均增加一倍,则NO转化率减小 D、H2起始浓度0.2 mol/L,某时刻NO的浓度为0.4 mol/L,则N2的瞬时生成速率为0.24 mol/L14. 常温下,用0.1 mol/LNaOH溶液滴定20 mL等浓度的H3A,得到pH与lgX[X= 或 或 ]的关系如图所示。下列说法错误的是( ) A、Na3A溶液中Kh1的数量级为10-2 B、当体系中溶液的pH=8时, =0.8 C、滴定过程中,既存在pH=7的点也存在水电离的c(H+ )=10-7的点 D、滴入20 mL NaOH溶液时:c(Na+ )>c(H2A- )>c(H+)>c(HA2- )>c(OH-)
A、Na3A溶液中Kh1的数量级为10-2 B、当体系中溶液的pH=8时, =0.8 C、滴定过程中,既存在pH=7的点也存在水电离的c(H+ )=10-7的点 D、滴入20 mL NaOH溶液时:c(Na+ )>c(H2A- )>c(H+)>c(HA2- )>c(OH-)二、多选题
-
15. 反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)是我国科学家2021年发布的由CO2人工合成淀粉中的重要反应之一。CO2与H2制备甲醇在有、无催化剂条件下的反应机理和相对能量的变化如图所示(吸附在催化剂表面上的物种用*标注,TS为过渡态),下列说法正确的是( )
 A、升高温度,CO2与H2制备甲醇的反应v(正)比v(逆)增大的更快 B、催化剂可使反应历程中决速步骤活化能降低0.20eV C、加压、降温对制备甲醇有利,因此应该在高压、低温下进行上述反应 D、CO2与H2制备甲醇反应往往伴随副反应,选择合适的催化剂可提高甲醇反应的选择性
A、升高温度,CO2与H2制备甲醇的反应v(正)比v(逆)增大的更快 B、催化剂可使反应历程中决速步骤活化能降低0.20eV C、加压、降温对制备甲醇有利,因此应该在高压、低温下进行上述反应 D、CO2与H2制备甲醇反应往往伴随副反应,选择合适的催化剂可提高甲醇反应的选择性三、综合题
-
16. 锌及其化合物在工业、农业方面用途广泛。(1)、基态Zn原子的价电子排布式为。(2)、Zn原子能形成多种配位化合物。一种锌的配合物结构如图:

①其中C、N、O、Zn元素的第一电离能大小关系是 , 结构中参与sp3杂化原子有个。
②配位键①和②相比。较稳定的是;键角③键角④(填“>”、“<”、“=”)。
(3)、(CH3COO)2Zn和ZnC2O4中阴离子对应的酸中沸点较高的是(写结构简式),原因是。(4)、ZnO存在多种晶体结构,其中纤锌矿型和闪锌矿型是最常见的晶体结构,下图为这两种晶体的局部结构。
①图a纤锌矿型ZnO晶体中O2-的配位数为。
②闪锌矿型中Zn2+填入O2-所形成的“正四面体”空隙中,闪锌矿晶胞中含有个“正四面体”空隙。
③图b闪锌矿型晶胞密度为ρg/cm3.则Zn2+与O2-的距离为nm。(设NA为阿伏加德罗常数的值)
17. 工业上从铬铁矿废渣(主要含Cr2O3、SiO2、Al2O3、Fe2O3)中回收提取铬的工艺流程如下:
注:焙烧可将Al、Si氧化物转化为可溶性钠盐。
(1)、为加快“水浸”速率,可采取的措施为(写出一种即可)。(2)、已知“浸出液”的主要成分为Na2CrO4 , 则Cr2O3焙烧时反应的化学方式为。(3)、滤渣1的主要成分是。 实验室中进行操作2用到的玻璃仪器有。(4)、常温下,溶液中部分离子的物质的量浓度的对数lgc与pH的关系如图所示。已知溶液中离子浓度≤10-5 mol/L时认为沉淀完全。
浸出液用H2SO4调节pH的最佳范围是。
调pH时 转化的离子方程式为。
(5)、一定温度下,利用K2Cr2O7可实现含苯酚废水的有效处理,工作原理如图所示,负极电极反应式为 , 一段时间后,N极附近溶液pH(填“增大”、“减小”或“不变”)。 18. 3D打印对钛粉末的要求很高。熔盐电解精炼是制取钛粉的有效途径。精炼时一般采用等摩尔比的KCl-NaCl熔盐,其中含有一定浓度的低价氯化钛(TiClx , x=2、3)。(已知:①熔盐中Ti3+少,Ti2+多熔盐电解精炼制得的钛粉颗粒相对粗大;②钛的熔点为1668℃,TiCl4熔点-24. 1℃、沸点136. 4℃)。(1)、精炼时,粗品质的海绵钛、废钛材等做电解池的极。(2)、采用海绵钛与TiCl4制取低价钛离子的电解质熔盐时,熔盐中存下如下4个反应:
18. 3D打印对钛粉末的要求很高。熔盐电解精炼是制取钛粉的有效途径。精炼时一般采用等摩尔比的KCl-NaCl熔盐,其中含有一定浓度的低价氯化钛(TiClx , x=2、3)。(已知:①熔盐中Ti3+少,Ti2+多熔盐电解精炼制得的钛粉颗粒相对粗大;②钛的熔点为1668℃,TiCl4熔点-24. 1℃、沸点136. 4℃)。(1)、精炼时,粗品质的海绵钛、废钛材等做电解池的极。(2)、采用海绵钛与TiCl4制取低价钛离子的电解质熔盐时,熔盐中存下如下4个反应:ⅰ.3Ti4++Ti0→4Ti3+△H1
ⅱ.Ti4++Ti0→2Ti2+△H2
ⅲ.Ti4++Ti2+→2Ti3+△H3
ⅳ.……… △H4
①反应ⅳ的化学方程式为。
②上述4个反应的平衡常数与温度的关系如下图。由此可知△H13△H2(填“>”、“<”或“=”)。

③有助于制取低价钛离子的电解质熔盐的措施为。
(3)、向下图装置中加入海绵钛,从石英管中缓慢加入a mol TiCl4 , 恒温条件下进行反应。
①平衡时,测得消耗海绵钛及TiCl4的物质的量分别为b mol、c mol。熔盐中低价钛离子的平均价态为。
②用各离子的物质的量分数表示平衡浓度,则反应ⅲ的平衡常数K3=。
③若向此平衡体系中继续注入TiCl4 , 则再次平衡后 (填“增大”、“减小”或“不变”)
(4)、电解精炼制钛粉,偶尔会得到一些相对粗大的钛粉颗粒而影响产品质量,请分析产生的原因(写出1条原因,合理即可。)19. 某课题小组利用硫渣与氯气反应制备四氯化锡,其过程如图所示(夹持、加热及控温装置略)。已知:四氯化锡(SnCl4)常温下为无色液体、易水解。
硫渣的化学组成
物质
Sn
Cu2S
Pb
As
其他杂质
质量分数%
64.43
25.82
7.34
1.23
1.18
氯气与硫渣反应相关产物的熔沸点
物质
性质
SnCl4
CuCl
PbCl2
AsCl3
S
熔点/℃
-33
426
501
-18
112
沸点/℃
114
1490
951
130
444
(1)、仪器a的名称 , A中发生反应的化学方程式。(2)、e中所加物质为 , 作用为。(3)、装置中存在一处缺陷会导致SnCl4产率降低,改进的方法是。(4)、三颈烧瓶中得到的粗产品进行提纯的方法;提纯后剩余的固体渣经过处理,可回收的主要金属有。(5)、已知SnCl4产品中含有少量AsCl3杂质,碘量法可用于测量产品的纯度:取10. 00 g产品溶于水,加入0.100 mol/L标准I2溶液20. 00 mL,并加入少量的淀粉溶液;用0.100×10-2 mol/L的硫代硫酸钠标准溶液滴定过量的碘。滴定终点时消耗20. 00 mL硫代硫酸钠标准溶液。测定过程中发生的相关反应:①AsCl3+3H2O= H3AsO3+ 3HCl
②H3AsO3+I2+H2O= H3AsO4+2HI
③2 +I2=2I-+
则产品中SnCl4的质量分数(保留小数点后1位);若滴定后发现滴管尖嘴处产生了气泡,则测量结果(填“偏高”或“偏低”)。
20. 有机物G是某药物的中间体,合成路线如图所示:
已知:R-CN R-CH2NH2
R1-NH2+R2-COOC2H5
 (1)、A的化学名称 , A→B的反应类型 , G中官能团名称。(2)、写出C→D的化学方程式。(3)、写出F的结构简式。(4)、L是D的一种同分异构体,写出满足下列条件的L的结构简式:。
(1)、A的化学名称 , A→B的反应类型 , G中官能团名称。(2)、写出C→D的化学方程式。(3)、写出F的结构简式。(4)、L是D的一种同分异构体,写出满足下列条件的L的结构简式:。a能与FeCl3溶液显紫色
b.核磁共振氢谱有4组峰,且峰面积比为9: 3: 2: 2
(5)、设计以 为原料合成
为原料合成  的路线(无机试剂任选) 。
的路线(无机试剂任选) 。
-