河北省衡水市2022届高考二模化学试题
试卷更新日期:2022-05-23 类型:高考模拟
一、单选题
-
1. 明代宋应星所著《天工开物》中有记载:“黄矾,乃即炼皂矾(FeSO4·7H2O)炉侧土墙……刮取下来,名日黄矾,染家用之。金色浅者涂炙,立成紫赤色也。”下列有关黄矾说法错误的是( )A、黄矾的主要成分中含有Fe3+ B、黄矾在医药上可以作补铁剂 C、黄矾可以应用于印染工业 D、黄矾经火烤,立刻生成Fe2O32. “油”在生活生产中应用广泛,下列有关“油”的说法正确的是( )A、食用油的主要成分是不饱和高级脂肪酸甘油酯,属于天然有机高分子化合物 B、汽油、煤油、生物柴油等均来源于石油,主要成分都是烃类 C、甘油是丙三醇的俗称,既可以做护肤品,又可以制作炸药 D、天然奶油、黄油等是从牛奶或羊奶中提取出的半固态物质,属于蛋白质3. 抗帕金森症的药物M,其结构简式如图,下列有关M的说法正确的是( )
 A、属于芳香烃 B、分子中所有的碳原子不可能共平面 C、苯环上的二氯代物有7种(不考虑立体异构) D、分子中有三个碳碳双键4. 推理是化学学科核心素养的重要内容,下列推理合理的是( )A、AgBr具有感光性,AgCl也具有感光性 B、Si和Ge的单质是半导体材料,同族Pb的单质也是半导体材料 C、Fe3O4可以写成FeO·Fe2O3 , Fe3I8也可以写成FeI2∙2FeI3 D、CO2是极性键构成的分子,SiO2也是极性键构成的分子5. 实验是化学的基础,利用如图装置能达到相应实验目的的是( )
A、属于芳香烃 B、分子中所有的碳原子不可能共平面 C、苯环上的二氯代物有7种(不考虑立体异构) D、分子中有三个碳碳双键4. 推理是化学学科核心素养的重要内容,下列推理合理的是( )A、AgBr具有感光性,AgCl也具有感光性 B、Si和Ge的单质是半导体材料,同族Pb的单质也是半导体材料 C、Fe3O4可以写成FeO·Fe2O3 , Fe3I8也可以写成FeI2∙2FeI3 D、CO2是极性键构成的分子,SiO2也是极性键构成的分子5. 实验是化学的基础,利用如图装置能达到相应实验目的的是( ) A、图1用于合成氨并检验氨的存在 B、图2用于石灰石和稀H2SO4反应制取CO2气体 C、图3用于制备Fe(OH)2 D、图4用于除去胆矾晶体的结晶水6. 下列有关白磷的说法正确的是( )A、白磷与红磷互为同素异形体 B、1molP4结构中含有P—P键的数目为4NA C、白磷的着火点低,需保存在煤油中 D、白磷在空气中加热到240℃可以转化为红磷7. 溴化钾(KBr)可作为分析试剂、感光剂、神经镇静剂等,工业上制取溴化钾的方法之一为:先将尿素(H2NCONH2)加到K2CO3溶液中,然后在不断搅拌下缓慢注入液溴,随即发生反应:3K2CO3+H2NCONH2+3Br2=6KBr+4CO2↑+N2↑+2H2O。下列有关此反应的说法正确的是( )A、尿素作还原剂,CO2、N2是氧化产物 B、若制取1mol KBr,转移电子数目为2NA C、此方法成本低,且制得的KBr纯净 D、实验室中KBr密封保存在无色广口瓶中8. 最近科学家在发展非金属催化剂实现CO2电催化还原制备甲醇(CH3OH)方向取得重要进展,反应历程如图所示,其中吸附在催化剂表面上的物质用“*”标注。下列说法错误的是( )
A、图1用于合成氨并检验氨的存在 B、图2用于石灰石和稀H2SO4反应制取CO2气体 C、图3用于制备Fe(OH)2 D、图4用于除去胆矾晶体的结晶水6. 下列有关白磷的说法正确的是( )A、白磷与红磷互为同素异形体 B、1molP4结构中含有P—P键的数目为4NA C、白磷的着火点低,需保存在煤油中 D、白磷在空气中加热到240℃可以转化为红磷7. 溴化钾(KBr)可作为分析试剂、感光剂、神经镇静剂等,工业上制取溴化钾的方法之一为:先将尿素(H2NCONH2)加到K2CO3溶液中,然后在不断搅拌下缓慢注入液溴,随即发生反应:3K2CO3+H2NCONH2+3Br2=6KBr+4CO2↑+N2↑+2H2O。下列有关此反应的说法正确的是( )A、尿素作还原剂,CO2、N2是氧化产物 B、若制取1mol KBr,转移电子数目为2NA C、此方法成本低,且制得的KBr纯净 D、实验室中KBr密封保存在无色广口瓶中8. 最近科学家在发展非金属催化剂实现CO2电催化还原制备甲醇(CH3OH)方向取得重要进展,反应历程如图所示,其中吸附在催化剂表面上的物质用“*”标注。下列说法错误的是( ) A、得到的副产物有CO和CH2O(甲醛),其中相对较多的副产物为CO B、生成副产物CH2O时,反应的活化能较大 C、制备甲醇的主反应速率主要由过程*CO+*OH→*CO+*H2O决定 D、电催化还原制备甲醇过程中,阳极的电势比阴极电势低9. 工业氢氧化锂在重结晶提纯时,采取了下述办法,巧妙地分离出杂质( 、 、 、 等)。工艺流程如下:
A、得到的副产物有CO和CH2O(甲醛),其中相对较多的副产物为CO B、生成副产物CH2O时,反应的活化能较大 C、制备甲醇的主反应速率主要由过程*CO+*OH→*CO+*H2O决定 D、电催化还原制备甲醇过程中,阳极的电势比阴极电势低9. 工业氢氧化锂在重结晶提纯时,采取了下述办法,巧妙地分离出杂质( 、 、 、 等)。工艺流程如下:
已知:LiOH的溶解度随温度变化
t/℃
0
20
40
60
80
100
S(LiOH)/(g/100g水)
12.7
12.8
13
13.8
15.3
17.5
下列说法错误的是( )
A、LiOH的溶解度随温度升高变化不大 B、操作I为过滤,除去 、 等形成的难溶物 C、操作II得到LiOH晶体应采用降温结晶 D、操作III为趁热过滤,分离 、 等可溶性杂质10. 难溶盐BaCO3的饱和溶液中c2(Ba2+)随c(H+)而变化。实验发现,298K时c2(Ba2+)—c(H+)为线性关系,如图中实线所示。下列说法错误的是( ) A、饱和BaCO3溶液中c(Ba2+)随pH增大而增大 B、BaCO3的溶度积Ksp=2.6×10-9 C、若忽略CO 的第二步水解,Ka2(H2CO3)=5×10-11 D、N点溶液中:c(Ba2+)>c(HCO )>c(CO )
A、饱和BaCO3溶液中c(Ba2+)随pH增大而增大 B、BaCO3的溶度积Ksp=2.6×10-9 C、若忽略CO 的第二步水解,Ka2(H2CO3)=5×10-11 D、N点溶液中:c(Ba2+)>c(HCO )>c(CO )二、多选题
-
11. 可的松(M)属于肾上腺皮质激素类药物,具有抗炎、抗过敏、抗风湿、免疫抑制作用,其结构简式如图所示。下列有关说法正确的是( )
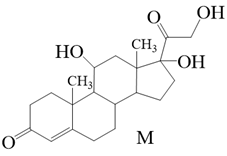 A、M的分子式为C21H30O5 B、M分子的结构中有6个手性碳原子 C、1molM与足量H2反应最多可消耗3molH2 D、1molM分别与足量Na与NaHCO3反应时,消耗二者物质的量之比为3:112. 短周期主族元素X、Y、Z、M的原子序数依次递增,Z、M的单质均能与水发生剧烈的化学反应,Z的最外层电子数是X、Y的最外层电子数之和,且X、Y相邻。下列有关说法正确的是( )A、离子半径:M>Z B、Z、M可以形成离子化合物 C、X、Y最高价含氧酸的酸性:X<Y D、X、Y分别与Z形成的二元化合物中,各原子最外层均满足8e-结构13. 微生物电解池(MEC)产甲烷技术是一种有望成为缓解能源危机与温室效应的重要新型途径。它以外界输入的较小电能为能量来源,以微生物为催化剂,MEC耦合厌氧消化系统产甲烷的工作原理如下。下列有关说法错误的是( )
A、M的分子式为C21H30O5 B、M分子的结构中有6个手性碳原子 C、1molM与足量H2反应最多可消耗3molH2 D、1molM分别与足量Na与NaHCO3反应时,消耗二者物质的量之比为3:112. 短周期主族元素X、Y、Z、M的原子序数依次递增,Z、M的单质均能与水发生剧烈的化学反应,Z的最外层电子数是X、Y的最外层电子数之和,且X、Y相邻。下列有关说法正确的是( )A、离子半径:M>Z B、Z、M可以形成离子化合物 C、X、Y最高价含氧酸的酸性:X<Y D、X、Y分别与Z形成的二元化合物中,各原子最外层均满足8e-结构13. 微生物电解池(MEC)产甲烷技术是一种有望成为缓解能源危机与温室效应的重要新型途径。它以外界输入的较小电能为能量来源,以微生物为催化剂,MEC耦合厌氧消化系统产甲烷的工作原理如下。下列有关说法错误的是( ) A、a为电源的负极,b为电源的正极 B、电子的移动方向:从b→导线→Y电极,再经X→导线→a C、Y电极发生的反应:CO2+8H++8e-=CH4+2H2O、8H++8e-=4H2、CO2+4H2=CH4+2H2O D、若用铅酸电池为电源,理论上消耗98gH2SO4时,此装置中有2molH+发生迁移
A、a为电源的负极,b为电源的正极 B、电子的移动方向:从b→导线→Y电极,再经X→导线→a C、Y电极发生的反应:CO2+8H++8e-=CH4+2H2O、8H++8e-=4H2、CO2+4H2=CH4+2H2O D、若用铅酸电池为电源,理论上消耗98gH2SO4时,此装置中有2molH+发生迁移三、综合题
-
14. 高锰酸钾是常见的强氧化剂,其制备流程如下:
 (1)、i.制取锰酸钾(K2MnO4)
(1)、i.制取锰酸钾(K2MnO4)碱熔:用托盘天平称取5.0gKOH固体、1.5gKClO3固体于坩埚中,混匀、小心加热,不断搅拌,待混合物完全熔融后,加入MnO2粉末3.5g,加热到颜色变为深绿色,用力搅拌到固体干涸、固化,再加热5min,并用铁棒将其尽量捣碎。
浸取:待物料冷却后,置于200mL烧杯中,用50mL蒸馏水浸取、过滤,得到绿色的溶液。
碱熔过程中发生反应的化学方程式为;加热中若不小心将液体溅到皮肤上,应处理;加热时应选择(填字母)。
a.瓷坩埚 b.铁坩埚 c.石英坩埚 d.氧化铝坩埚
(2)、ii.制取高锰酸钾(KMnO4)在浸取液中通入CO2气体,至K2MnO4完全反应,用pH试纸测定溶液pH达到10~11时,停止通入CO2.然后把溶液加热,趁热用铺有尼龙布的布氏漏斗进行减压过滤,除去残渣……
已知:常温常压下,饱和碳酸钾溶液的pH为11.6;碳酸氢钾溶液的pH为8.3。
①通入CO2发生反应的离子方程式为;判断此反应进行是否完全,也可以用玻璃棒蘸取溶液于滤纸上,若呈现现象,停止通入CO2;过滤时不用滤纸而用尼龙布的原因:;(填“能”或“不能”)用加盐酸的方法代替通入CO2 , 其理由:。
②已知:几种物质在不同温度下的溶解度

0
10
20
30
40
50
60
KCl
27.6
31.0
34.0
37.0
40.0
42.6
45.5
K2CO3·2H2O
51.3
52
52.5
53.2
53.9
54.8
55.9
KMnO4
2.83
4.4
6.4
9.0
12.7
16.9
22.2
“操作X”为。
iii.重结晶提纯
(3)、利用重结晶的方法对产品提纯,所得产品质量2.8g,则高锰酸钾的产率为(精确到0.1%)。15. 氨基甲酸铵(NH2COONH4)用于生产制药原料、医药试剂、发酵促进剂、电子元件等,是一种重要的氨化剂。常温常压下稳定,在59℃时升华并完全分解,易溶于水,溶于醇,在潮湿空气或水溶液中放置时转化成碳酸铵。将NH3和CO2以2:1的速率经过纯化、干燥后制取氨基甲酸铵,反应装置如图:
回答下列问题:
(1)、请写出上述装置(可以重复使用)正确的连接顺序a→(填接口字母)→b。(2)、D装置的名称为 , 用A装置制取气体的优点是;B装置中制备气体所用试剂名称是。(3)、反应合成器用了三口圆底烧瓶,并装入适量的CCl4 , 其作用除了充当介质之外,另一作用为 , 上口插入一个电动搅拌器,并采用玻璃套管、乳胶管使之密封,在两个侧口分别通入NH3和CO2 , 在不断搅拌下生成氨基甲酸铵。写出氨基甲酸铵的电子式:;生成氨基甲酸铵的化学方程式为。生成物白色固体悬浮于介质中,经操作后,在40℃的恒温箱中干燥后密封保存。(4)、本实验尾气处理,需要在C装置出气口接一个盛装(填试剂名称)的洗气瓶,防止污染空气,同时避免空气中的水进入C装置。16. 1,6−己二醇是一种重要的化工原料,与乙二醇相比,用1,6−己二醇为原料制备的聚酯具有更为优异的柔韧性和抗腐蚀性。工业上利用己二酸二甲酯加氢制备1,6−己二醇,该反应的化学方程式如图: (g)+4H2(g)→
(g)+4H2(g)→  (g)+2CH3OH(g) ΔH。(1)、已知:
(g)+2CH3OH(g) ΔH。(1)、已知:化学键
C=O
C−O
C−H
C−C
O−H
H−H
键能/ kJ∙mol−1
745
358
413
347
467
436
计算上述反应的△H=;此反应自发进行的条件是(填“高温易自发”“低温易自发”或“任何温度都能自发”)。
(2)、将组成(物质的量分数)为4n%H2(g)、n% (g)的气体通入刚性密闭反应器中,在温度一定、压强为pMPa条件下只进行上述反应。平衡时,若压强为qMPa,平衡时
(g)的气体通入刚性密闭反应器中,在温度一定、压强为pMPa条件下只进行上述反应。平衡时,若压强为qMPa,平衡时  (g)的转化率为= (用p、q的代数式表示,下同),平衡常数Kp=(以分压表示,分压=总压×物质的量分数)。 (3)、科研小组在高压反应釜中进行催化加氢反应,对己二酸二甲酯制备1,6−己二醇的工艺条件进行了研究。图甲和图乙为此反应在相同时间时,反应压力、反应温度与反应物的转化率和1,6−己二醇选择性的变化关系。
(g)的转化率为= (用p、q的代数式表示,下同),平衡常数Kp=(以分压表示,分压=总压×物质的量分数)。 (3)、科研小组在高压反应釜中进行催化加氢反应,对己二酸二甲酯制备1,6−己二醇的工艺条件进行了研究。图甲和图乙为此反应在相同时间时,反应压力、反应温度与反应物的转化率和1,6−己二醇选择性的变化关系。
已知,选择性= ×100%。
①由图可知,在压强为27MPa时,己二酸二甲酯制备1,6−己二醇应选择的合适温度为;选择此温度的理由是;当260℃时,转化率随着压强增大而不断增大的原因是。
②图丙为反应时间与加氢反应时反应物的转化率和选择性的关系。

综合考虑,反应时间控制在5h左右较为合适。此时1,6−己二醇的产率为。
17. 近日,以色列魏茨曼科学研究所提出了一种新颖的模块化催化剂框架,将过渡金属Fe(III)、Ni(II)和Cu(II)放在三缺位多金属氧酸盐骨架的最近邻位置,通过精确调节金属组成来指导催化活性和选择性。研究人员通过简单的合成发现,三铜取代的化合物[SiCu3W9]在CO2还原为CO过程中具有最佳活性,FeNi2取代的化合物(SiFeNi2W9)在CO氧化为CO2过程中具有最佳活性。回答下列问题:(1)、基态Fe3+的价层电子排布图为;Ni、Cu原子的第一电离能更大的是。(2)、与CO2互为等电子体的分子为;CO的结构式为(并标出配位键的方向);O原子能量最高的原子轨道形状为。(3)、Cu元素可以形成配合物Cu(NH3)4(NO3)2。①1mol该配合物含有molσ键。
②已知分子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。则 中的大π键可表示为。
(4)、硅的化合物SiC晶胞结构与ZnS相似,如图所示,则Si原子的配位数是。设C与Si的最近距离为apm,SiC晶体的密度为dg/cm3 , 则阿伏加德罗常数的值为(用含a和d的式子表示)。 18. 三氟哌啶醇是一种神经系统用药,用于精神分裂症的治疗。其合成路线如下所示:
18. 三氟哌啶醇是一种神经系统用药,用于精神分裂症的治疗。其合成路线如下所示: (1)、A的名称为;B的含氧官能团名称为。(2)、写出D→E反应的化学方程式。F→G的反应类型分别为。(3)、三氟哌啶醇的分子式为。(4)、芳香族化合物J与C互为同分异构体,符合以下条件的J的结构简式为。
(1)、A的名称为;B的含氧官能团名称为。(2)、写出D→E反应的化学方程式。F→G的反应类型分别为。(3)、三氟哌啶醇的分子式为。(4)、芳香族化合物J与C互为同分异构体,符合以下条件的J的结构简式为。①1molJ与银氨溶液反应最多生成4molAg;
②核磁共振氢谱有三组峰,且峰面积之比为2:1:1。
(5)、根据以上信息,请写出以溴乙烷和丙酮为原料制取2-甲基-2-丁醇合成路线(其他试剂自选)。