广东省汕头市2022届普通高中毕业班第二次模拟试化学试题
试卷更新日期:2022-05-23 类型:高考模拟
一、单选题
-
1. 第三届亚青会即将在汕头举办,潮汕传统文化与建筑特色将呈现在亚洲人民面前。下列汕头代表建筑物主要由天然高分子材料建造的是( )
选项
A
B
C
D
特色建筑




汕头特区标志雕塑“升腾”
全木榫卯结构“中山纪念亭”
潮博馆主雕塑《潮汕赋》
南澳岛“自然之门”
A、A B、B C、C D、D2. 物质结构决定性质。下列有关化学用语表示正确的是( )A、乙醇的结构简式:CH3-O-CH3 B、BF3的电子式: C、氯离子的结构示意图:
C、氯离子的结构示意图:  D、2-甲基-1,3-丁二烯的键线式:
D、2-甲基-1,3-丁二烯的键线式:  3. 化学与人类生活有着密切联系。下列过程涉及氧化还原反应的是( )A、漂白粉久置于空气中失效 B、明矾净水 C、SO2漂白的纸张易变黄 D、烹饪紫薯时滴加白醋防止变色4. 化学与生产、生活密切相关。下列有关说法正确的是( )A、燃煤脱硫有利于实现“碳达峰、碳中和” B、核酸检测是确认病毒类型的有效手段,核酸不属于天然高分子化合物 C、野外被蚊虫叮咬,可在伤口处涂抹肥皂水来减轻痛痒 D、天然气、水煤气、沼气等不可再生能源,均可设计成燃料电池实现能量转化5. 北京冬奥会吉祥物“冰墩墩”“雪容融”成为新宠,其制作原料包含如苯乙烯(
3. 化学与人类生活有着密切联系。下列过程涉及氧化还原反应的是( )A、漂白粉久置于空气中失效 B、明矾净水 C、SO2漂白的纸张易变黄 D、烹饪紫薯时滴加白醋防止变色4. 化学与生产、生活密切相关。下列有关说法正确的是( )A、燃煤脱硫有利于实现“碳达峰、碳中和” B、核酸检测是确认病毒类型的有效手段,核酸不属于天然高分子化合物 C、野外被蚊虫叮咬,可在伤口处涂抹肥皂水来减轻痛痒 D、天然气、水煤气、沼气等不可再生能源,均可设计成燃料电池实现能量转化5. 北京冬奥会吉祥物“冰墩墩”“雪容融”成为新宠,其制作原料包含如苯乙烯(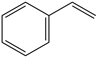 )氯乙烯(CH2=CH-Cl)等,下列有关说法错误的是( )
)氯乙烯(CH2=CH-Cl)等,下列有关说法错误的是( )  A、氯乙烯能使溴水褪色 B、氯乙烯与
A、氯乙烯能使溴水褪色 B、氯乙烯与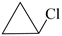 互为同系物
C、1 mol苯乙烯最多可消耗4 mol H2
D、苯乙烯能发生加成、氧化、加聚反应
6. 化学创造更美好的生活。下列物质的应用与原理解释错误的是( )
互为同系物
C、1 mol苯乙烯最多可消耗4 mol H2
D、苯乙烯能发生加成、氧化、加聚反应
6. 化学创造更美好的生活。下列物质的应用与原理解释错误的是( )选项
应用
化学原理
A
NH3用作制冷剂
氨气极易液化
B
干冰用于人工降雨
干冰升华吸热使水蒸气凝结
C
金属镁在军事上用作信号弹
镁燃烧发出大量的热
D
免洗手消毒液(含乙醇)杀菌消毒
乙醇能使新冠病毒中的蛋白质变性
A、A B、B C、C D、D7. 理解与辨析是化学学科的关键能力,下列离子在溶液中能共存的是( )A、S2-、Na+、H+、 B、Fe2+、 、H+、 C、 、 、OH-、Mg2+ D、 、Al3+、Cl-、Ca2+8. 实验探究是培养化学兴趣的有效途径。下列实验药品、仪器选择正确且能达到实验目的的是( )A
B
C
D
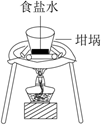



蒸发浓缩制NaCl
制备SO2气体
用KMnO4滴定Na2C2O4
观察铁的析氢腐蚀
A、A B、B C、C D、D9. 中药材铁华粉的主要成分是(CH3COO)2Fe,其检测流程如图所示。下列说法正确的是( ) A、刺激性气体X为SO2 B、铁华粉中可能含有铁单质 C、向滤液中滴加酸性KMnO4溶液,一定能证明Fe2+具有还原性 D、滤液中加入K3[Fe(CN)6]试液,产生蓝色沉淀说明溶液中含有Fe3+10. 宏观辨识与微观探析是化学核心素养之一,下列有关方程式与所述事实相符合的是( )A、电解熔融MgCl2制取Mg:MgCl2(熔融) Mg+Cl2↑ B、实验室制氨气:N2+3H2 2NH3 C、工业制漂白粉:Cl2+2OH-=Cl-+ClO-+H2O D、泡沫灭火器工作原理:2Al3++3 +3H2O=2Al(OH)3↓+3CO2↑11. 常温下,利用手持装置(图甲)进行实验;向蒸馏水中加入Mg(OH)2粉末,一段时间后再加入稀硫酸。测得溶液pH随时间变化曲线如图乙所示。
A、刺激性气体X为SO2 B、铁华粉中可能含有铁单质 C、向滤液中滴加酸性KMnO4溶液,一定能证明Fe2+具有还原性 D、滤液中加入K3[Fe(CN)6]试液,产生蓝色沉淀说明溶液中含有Fe3+10. 宏观辨识与微观探析是化学核心素养之一,下列有关方程式与所述事实相符合的是( )A、电解熔融MgCl2制取Mg:MgCl2(熔融) Mg+Cl2↑ B、实验室制氨气:N2+3H2 2NH3 C、工业制漂白粉:Cl2+2OH-=Cl-+ClO-+H2O D、泡沫灭火器工作原理:2Al3++3 +3H2O=2Al(OH)3↓+3CO2↑11. 常温下,利用手持装置(图甲)进行实验;向蒸馏水中加入Mg(OH)2粉末,一段时间后再加入稀硫酸。测得溶液pH随时间变化曲线如图乙所示。
下列对曲线的分析错误的是( )
A、ab段pH不断增大的原因是Mg(OH)2不断溶解导致的 B、bc段存在平衡Mg(OH)2(s) Mg2+(sq)+2OH-(aq) C、cd段中 D、通过实验数据对比可知,加入的稀硫酸的物质的量小于Mg(OH)212. 白磷易自燃,国际上明令禁止使用白磷弹,工业上可用来生产磷酸。白磷制备反应为:2Ca3(PO4)2+6SiO2+10C 6CaSiO3+P4+10CO↑。设NA为阿伏加德罗常数。下列有关说法正确的是( )A、62 gP4(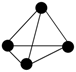 )中含P-P键数目为2NA
B、30 gSiO2中分子数目为0.5NA
C、1 mol/L Ca3(PO4)2溶液中含有 数目为2NA
D、上述反应每生成1 mol CO时转移电子数目为2NA
13. 实验探究是化学学科的魅力所在。下列有关实验操作、现象和结论均正确的是( )
)中含P-P键数目为2NA
B、30 gSiO2中分子数目为0.5NA
C、1 mol/L Ca3(PO4)2溶液中含有 数目为2NA
D、上述反应每生成1 mol CO时转移电子数目为2NA
13. 实验探究是化学学科的魅力所在。下列有关实验操作、现象和结论均正确的是( )选项
实验操作
实验现象
结论
A
向平衡体系2NO2 N2O4中加压
红棕色变浅
平衡正向移动
B
向淀粉溶液中加入稀硫酸,加热几分钟,冷却后再加入新制Cu(OH)2悬浊液,加热
溶液中未观察到砖红色沉淀产生
淀粉没有水解
C
将大小相同的Al和Mg分别投入到相同浓度的NaOH溶液中
Al溶解有气泡产生,Mg无现象
Al的金属性强于Mg
D
向海带灰的浸取液中滴加适量氯水,再加入CCl4萃取
分层,下层出现紫红色
海带中含有碘元素
A、A B、B C、C D、D14. 研究微生物燃料电池不仅可以获得高效能源,还能对工业污水等进行处理。利用微生物燃料电池处理含硫废水并电解制备KIO3的原理如图所示,下列说法正确的是( )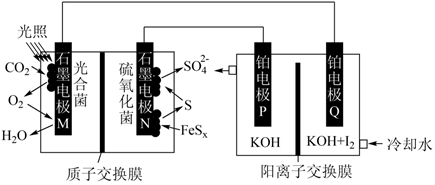 A、光照强度大小不影响KIO3的制备速率 B、右侧电池中K+通过阳离子交换膜从P极移向Q极 C、电极N处发生电极反应:S-6e-+4H2O= +8H+ D、不考虑损耗,电路中每消耗1 mol SO2 , 理论上Q极可制得342.4 g KIO315. 甲酸铵常用于电解、电容器行业。25℃时,用HCl或NaOH固体改变0.1 mol/L的HCOONH4溶液的pH,1gc(HCOOH)、1gc(NH3·H2O)、1gc(H+)和1gc(OH-)随pH变化的关系如图所示。下列说法错误的是( )
A、光照强度大小不影响KIO3的制备速率 B、右侧电池中K+通过阳离子交换膜从P极移向Q极 C、电极N处发生电极反应:S-6e-+4H2O= +8H+ D、不考虑损耗,电路中每消耗1 mol SO2 , 理论上Q极可制得342.4 g KIO315. 甲酸铵常用于电解、电容器行业。25℃时,用HCl或NaOH固体改变0.1 mol/L的HCOONH4溶液的pH,1gc(HCOOH)、1gc(NH3·H2O)、1gc(H+)和1gc(OH-)随pH变化的关系如图所示。下列说法错误的是( )[已知:Ka(HCOOH)=1.8×10-4 , Kb(NH3·H2O)=1.8×10-5]
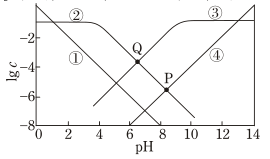 A、Q点对应溶液pH=7 B、曲线①代表lgc(H+),曲线③代表1gc(NH3·H2O) C、0.1 mol/LHCOONH4溶液中,c(H+)+c(HCOOH)=c(OH-)+c(NH3·H2O) D、P点存在c(NH3·H2O)>c(OH-)=c(HCOOH)>c(H+)16. 短周期主族元素W、X、Y、Z的原子半径依次增大。M、N、P是由这些元素组成的二元化合物,r、s、q是其中三种元素对应的单质,M与r均为淡黄色固体,W、X、Y位于不同周期。上述物质转化关系如图所示(部分生成物省略),下列说法错误的是( )
A、Q点对应溶液pH=7 B、曲线①代表lgc(H+),曲线③代表1gc(NH3·H2O) C、0.1 mol/LHCOONH4溶液中,c(H+)+c(HCOOH)=c(OH-)+c(NH3·H2O) D、P点存在c(NH3·H2O)>c(OH-)=c(HCOOH)>c(H+)16. 短周期主族元素W、X、Y、Z的原子半径依次增大。M、N、P是由这些元素组成的二元化合物,r、s、q是其中三种元素对应的单质,M与r均为淡黄色固体,W、X、Y位于不同周期。上述物质转化关系如图所示(部分生成物省略),下列说法错误的是( ) A、物质熔沸点:N>P B、X、Y可形成离子化合物 C、单质氧化性:X>W D、X、Y、Z三种元素组成的盐溶液可能呈中性或碱性
A、物质熔沸点:N>P B、X、Y可形成离子化合物 C、单质氧化性:X>W D、X、Y、Z三种元素组成的盐溶液可能呈中性或碱性二、综合题
-
17. 二氧化铈(CeO2)是一种重要的稀土氧化物,具有吸收强紫外光线的能力,可以用于光催化降解有机污染物,利用氟碳铈矿(主要成分为CeCO3F)制CeO2的工艺流程如下
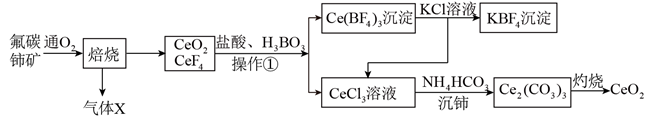 (1)、CeCO3F其中Ce元素的化合价为。(2)、“焙烧”过程中可以加快反应速率,提高焙烧效率的方法是(写出一种即可)。(3)、操作①所需的玻璃实验仪器有烧杯、。(4)、上述流程中盐酸可用硫酸和H2O2替换,避免产生污染性气体Cl2 , 由此可知氧化性;CeO2 H2O2 (填“>”,“<”)(5)、写出“沉铈”过程中的离子反应方程式。若“沉铈”中,Ce3+恰好沉淀完全[c(Ce3+)为1.0×10-5 mol/L,此时溶液的pH为5,则溶液中c( )=mol/L(保留2位有效数字)。(已知常温下Ka1(H2CO3)=4.3×10-7 , Ka2(H2CO3)=5.6×10-11 , Ksp[Ce2(CO3)3]=1.0×10-28)。(6)、Ce4+溶液可以吸收大气中的污染物NOx减少空气污染,其转化过程如图所示(以NO2为例)
(1)、CeCO3F其中Ce元素的化合价为。(2)、“焙烧”过程中可以加快反应速率,提高焙烧效率的方法是(写出一种即可)。(3)、操作①所需的玻璃实验仪器有烧杯、。(4)、上述流程中盐酸可用硫酸和H2O2替换,避免产生污染性气体Cl2 , 由此可知氧化性;CeO2 H2O2 (填“>”,“<”)(5)、写出“沉铈”过程中的离子反应方程式。若“沉铈”中,Ce3+恰好沉淀完全[c(Ce3+)为1.0×10-5 mol/L,此时溶液的pH为5,则溶液中c( )=mol/L(保留2位有效数字)。(已知常温下Ka1(H2CO3)=4.3×10-7 , Ka2(H2CO3)=5.6×10-11 , Ksp[Ce2(CO3)3]=1.0×10-28)。(6)、Ce4+溶液可以吸收大气中的污染物NOx减少空气污染,其转化过程如图所示(以NO2为例)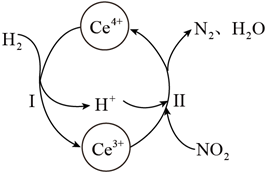
①该反应中的催化剂为(写离子符号)
②该转化过程中氧化剂与还原剂物质的量之比为。
18. 为证明AgCl溶于水存在溶解平衡,取1 mo/LKCl溶液10 mL,向其中加入0.2 mol/LAgNO3溶液1 mL,充分反应后将浊液过滤进行如下实验:序号
实验装置
实验操作
实验现象
A

向滤液中放入Mg条
ⅰ.滤液澄清透明,用激光照射有丁达尔现象。
ⅱ.放入Mg条后,立即有无色气泡产生,气体可燃,滤液中出现白色浑浊,ⅲ.一段时间后开始出现棕褐色浑浊物。Mg条表面也逐渐变为棕褐色。产生气泡的速率变缓慢
已知:①AgOH不稳定,立即分解为Ag2O (棕褐色或棕黑色),Ag粉为黑色;
②AgCl、Ag2O可溶于浓氨水生成 [Ag(NH3)2]+(银氨溶液),Mg、Ag不溶于浓氨水。
(1)、实验A中的滤液所属分散系为。现象ii中无色气泡是(填化学式)。(2)、现象iii中,导致产生气泡的速率下降的主要原因是。(3)、判断Mg条表面的棕揭色物质中含有Ag和Ag2O。①设计实验检验Ag:取实验A中表面变为棕褐色的Mg条于试管中,向其中加入足量稀盐酸,反应结束后,继续加入浓硝酸,产生棕色气体和白色不溶物。用离子方程式表示棕褐色固体中产生Ag的原因:。实验中加入稀盐酸的目的:。
②设计检验棕褐色物质中有Ag2O,实验方案是:取实验A中表面变为棕褐色的Mg条用蒸馏水洗净后,加入(填化学式)中浸泡,取上层清液于葡萄糖溶液中,水浴加热,若有(填实验现象),则证明Ag2O存在。
(4)、探究AgI转化为AgCl,设计实验如下:装置
步骤
电压表读数

ⅰ.如图连接装置并加入试剂,闭合K
a
ⅱ.向B中滴入AgNO3(aq),至沉淀完全
b
ⅲ.再向B中投入一定量NaCl(s)
c
ⅳ.重复ⅰ,再向B中加入与iii等量NaCl(s)
d
已知:其他条件不变时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大;离子的氧化性(或还原性)强弱与其浓度有关。
①电压表读数a>b,其原因是。
②综合实验现象能说明AgI转化为AgCl,则a、b、c三者的大小关系为。
19. CO2是一种温室气体,对人类的生存环境产生巨大的影响,将CO2作为原料转化为有用化学品,对实现碳中和及生态环境保护有着重要意义。(1)、Ⅰ.工业上以CO2和NH3为原料合成尿素,在合成塔中存在如下转化:
液相中,合成尿素的热化学方程式为:2NH3(l)+CO2(l)=H2O(l)+NH2CONH2(l) △H=kJ/mol。
(2)、在恒容密闭容器中发生反应:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g) △H<0。下列说法正确的是A、增大CO2的浓度,有利于NH3的转化率增大 B、反应在任何温度下都能自发进行 C、当混合气体的密度不再发生改变时反应达平衡状态 D、充入He,压强增大,平衡向正反应移动(3)、Ⅱ.可利用CO2和CH4催化制备合成气(CO、H2),在一定温度下容积为1 L密闭容器中,充入等物质的量CH4和CO2 , 加入Ni/Al2O3使其发生反应:CH4(g)+CO2(g) 2CO(g)+2H2(g)反应达平衡后,平衡常数K=81,此时测得c(CO)为3 mol/L,则CH4的转化率为(保留2位有效数字)。
(4)、制备“合成气”反应历程分两步:步骤
反应
正反应速率方程
逆反应速率方程
反应①
CH4(g) C(ads)+2H2(g)
v正=k1·c(CH4)
v逆=k2·c2(H2)
反应②
C(ads)+CO2(g) CO(g)
v正=k3·c(CO2)
v逆=k4·c2(CO)
上述反应中C(ads)为吸附性活性炭,反应历程的能量图变化如下图所示:
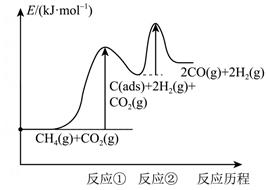
①反应速率快慢比较:反应①反应②(填“>”“<”或“=”),请依据有效碰撞理论微观探析其原因。
②一定温度下,反应CH4(g)+CO2(g) 2CO(g)+2H2(g)的平衡常数K=(用k1、k2、k3、k4表示)。
(5)、制备合成气(CO、H2)过程中发生副反应:CO2(g)+H2(g) CO(g)+H2O(g) △H2=+41.0 kJ/mol,在刚性密闭容器中,进料比 分别等于1.0、1.5、2.0,且反应达到平衡状态。反应体系中, 随温度变化的关系如图所示:
随着进料比 的增加, 的值(填“增大”、“不变”或“减小”),其原因是。
20. 镍钴锰三元材料LiNixCoyMnzO2是一类新型锂离子电池正极材料,具有容量高、循环稳定性好等优点。(1)、锰元素基态原子的电子排布式为 , 镍钴锰三种基态原子中未成对电子数最多的是。(2)、镍可以形成多种配合物,如Ni(CO)4、[Ni(NH3)6]SO4等。①上述两种配合物都存在的化学键的是
a. 离子键 b. 配位键 c. 极性键 d. 非极性键。
②Ni(CO)4常温下难溶于水,易溶于CCl4中,可推知其为。(填“极性分子”或“非极性分子”)
③[Ni(NH3)6]SO4中阴离子的空间构型为。
(3)、MnO和CoO具有相同的晶体构型,其熔点大小顺序为(4)、锂离子电池目前广泛采用溶有LiPF6的碳酸酯作为电解液。①LiPF6各元素的第一电离能从大到小的顺序为。
②常见溶剂碳酸乙烯酯(
 )中碳原子的杂化方式是。(5)、LiCoO2的晶胞是六棱柱,其结构如图所示,镍钴锰三元材料中Ni和Mn取代了部分Co的位置:
)中碳原子的杂化方式是。(5)、LiCoO2的晶胞是六棱柱,其结构如图所示,镍钴锰三元材料中Ni和Mn取代了部分Co的位置: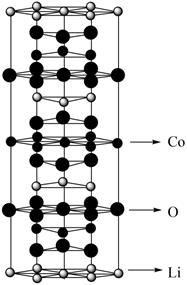
晶胞中含Li原子数为 , 若晶胞的底边边长为a nm,高为c nm,x:y:z=1:1:1,则LiNixCoyMnzO2晶胞的密度为g/cm3(列出计算式)。
21. 某研究小组以物质A和乙烯为原料,按如图路线合成用于治疗冠心病及高血压药物尼群地平。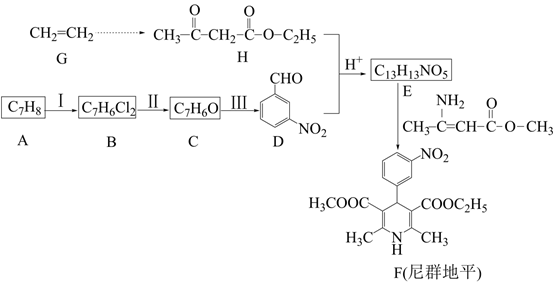
已知:①
 →R-CHO+H2O
→R-CHO+H2O②R1CHO+
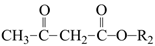
 +无机小分子
+无机小分子③2
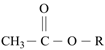
 +ROH
+ROH请回答:
(1)、物质H中官能团的名称是。(2)、反应Ⅲ的反应类型为。(3)、下列说正确的是___________。A、反应Ⅰ需要用FeCl3做催化剂 B、化合物C能发生银镜反应 C、D分子中所有碳原子共平面 D、尼群地平的分子式是C18H19N2O6(4)、写出D+H→E的化学方程式。(5)、化合物X是式量比化合物D大14的同系物,同时符合下列条件的化合物X所有同分异构体共种,写出其中一种能直接氧化得到醛的结构简式为。①能与FeCl3溶液发生显色反应;
②HNMR谱显示分子中有4种氢原子;
③IR谱表明分子中含-C≡N键,无-O-O-、C-O-C-键
(6)、设计以乙醇为原料合成H的路线(用流程图表示,无机试剂任选) 。