福建省莆田市2022届高三下学期第三次质量检测化学试题
试卷更新日期:2022-05-23 类型:高考模拟
一、单选题
-
1. 为实现2030年碳达峰的目标,必须大力开发新型能源。下列四组选项中,全部符合图中阴影部分的能源是( )
 A、煤炭、石油、沼气 B、水能、生物能、天然气 C、太阳能、风能、生物质能 D、地热能、海洋能、火电能2. 我国科学家研发的催化剂 @ ,实现了含炔化合物与二氧化碳的酯化。
A、煤炭、石油、沼气 B、水能、生物能、天然气 C、太阳能、风能、生物质能 D、地热能、海洋能、火电能2. 我国科学家研发的催化剂 @ ,实现了含炔化合物与二氧化碳的酯化。(a)HC C-CH2OH+CO2

(b) HC C-CH2NH2+CO2

下列说法错误的是( )
A、M环上的一氯代物有3种 B、M、N都能使溴水褪色 C、 M最多消耗40 g D、N的分子式为3. 下列各组离子在指定溶液中能大量共存的是( )A、无色透明溶液中: B、使甲基橙变红的溶液中: C、中性溶液中: D、 溶液中:4. 温度计是中学化学实验常用仪器。已知:实验室制备乙烯的原理是 。下列实验操作中,温度计使用错误的是( )



A.分离碘的四氯化碳
B.制备乙烯
C.测定中和反应热
D.测定CCl4的沸点
A、A B、B C、C D、D5. 设 为阿伏加德罗常数的值。下列说法正确的是( ) A、工业上电解 制备 时,产生气体的分子数为3 B、 三硫化四磷( ,如图所示)中含有的极性键的数目为6 C、标准状况下,22.4L氯气与足量烧碱溶液反应,转移的电子数为2 D、 与足量乙醇在一定条件下反应,生成的酯基的数目为26. 为白色粉末,微溶于水,溶于浓盐酸或 浓溶液,不溶于乙醇。往硫酸铜溶液中加入 , ,进行“还原,氯化”时, 和 的用量对 产率的形响如图1、图2所示。下列说法中正确的是( )
A、工业上电解 制备 时,产生气体的分子数为3 B、 三硫化四磷( ,如图所示)中含有的极性键的数目为6 C、标准状况下,22.4L氯气与足量烧碱溶液反应,转移的电子数为2 D、 与足量乙醇在一定条件下反应,生成的酯基的数目为26. 为白色粉末,微溶于水,溶于浓盐酸或 浓溶液,不溶于乙醇。往硫酸铜溶液中加入 , ,进行“还原,氯化”时, 和 的用量对 产率的形响如图1、图2所示。下列说法中正确的是( ) A、反应的离子方程式为 B、为减少 的溶解损耗,可用乙醇洗涤沉淀 C、 的用量越多, 越大, 的产率越大 D、 易被空气氧化为 ,该反应中氧化剂和还原剂的物质的量之比为7. X、Y、Z、W、M是五种常见的短周期主族元素,其原子半径随原子序数的变化如图所示,已知Y的原子核外电子总数是W的4倍,M、X的最外层电子数之和与W的最外层电子数相等。下列说法错误的是( )
A、反应的离子方程式为 B、为减少 的溶解损耗,可用乙醇洗涤沉淀 C、 的用量越多, 越大, 的产率越大 D、 易被空气氧化为 ,该反应中氧化剂和还原剂的物质的量之比为7. X、Y、Z、W、M是五种常见的短周期主族元素,其原子半径随原子序数的变化如图所示,已知Y的原子核外电子总数是W的4倍,M、X的最外层电子数之和与W的最外层电子数相等。下列说法错误的是( ) A、M与X形成的化合物能与水剧烈反应 B、X和W的最高价氧化物对应水化物的碱性强弱: C、W与Z形成的气态分子中各原子最外层均达到 稳定结构 D、X与Y形成的化合物 中含有共价键8. 工业上用接触法制备浓硫酸的原理如下:
A、M与X形成的化合物能与水剧烈反应 B、X和W的最高价氧化物对应水化物的碱性强弱: C、W与Z形成的气态分子中各原子最外层均达到 稳定结构 D、X与Y形成的化合物 中含有共价键8. 工业上用接触法制备浓硫酸的原理如下:
已知:
下列说法错误的是( )
A、增大反应容器的体积可以提高煅烧速率 B、步骤④中产生的尾气经净化后循环利用可以提高原料利用率 C、温度过高不利于 的催化氧化反应 D、步骤③中充入适当过量的空气能提高 的转化率9. 一种电化学技术中固定 的反应途径如图所示,它实现了 的固定和储能灵活应用。储能器件使用的 电池的组成为钌基正极、饱和 和 电解液以及锂片负极, 固定策略中总反应为 。下列说法错误的是( ) A、 的固定中,负极每生成 气体,可转移 B、 通过储能系统和 固定策略可转化为固体产物 C、该装置不仅减少了 的排放,还可将 作为可再生能源载体 D、储能系统中, 电池放电时总反应为10. 电位滴定法是根据滴定过程中指示电极电位的变化来确定滴定终点的一种滴定分析方法。在化学计量点附近,被测离子浓度发生突跃,指示电极电位也发生了突跃,进而确定滴定终点。常温下,利用盐酸滴定某溶液中亚磷酸钠 的含量,其电位滴定曲线与 曲线如图所示。下列说法正确的是( )
A、 的固定中,负极每生成 气体,可转移 B、 通过储能系统和 固定策略可转化为固体产物 C、该装置不仅减少了 的排放,还可将 作为可再生能源载体 D、储能系统中, 电池放电时总反应为10. 电位滴定法是根据滴定过程中指示电极电位的变化来确定滴定终点的一种滴定分析方法。在化学计量点附近,被测离子浓度发生突跃,指示电极电位也发生了突跃,进而确定滴定终点。常温下,利用盐酸滴定某溶液中亚磷酸钠 的含量,其电位滴定曲线与 曲线如图所示。下列说法正确的是( )
已知:亚磷酸 是二元弱酸,电离常数 , 。
A、a点对应的溶液呈弱碱性 B、水的电离程度:a点小于b点 C、a点对应的溶液中存在: D、b点对应的溶液中存在:二、综合题
-
11. 铂钌催化剂是甲醇燃料电池的阳极催化剂。一种以钌矿石[主要含 ,还含少量的 ]为原料制备钉 的流程如图。回答下列问题:
 (1)、 中 的化合价为。(2)、“酸浸”时, 的作用是。“滤渣”的主要成分有 和(填化学式)。“酸浸”中钌的浸出率与浸出温度、 的关系如图所示,“酸浸”的最佳条件是。
(1)、 中 的化合价为。(2)、“酸浸”时, 的作用是。“滤渣”的主要成分有 和(填化学式)。“酸浸”中钌的浸出率与浸出温度、 的关系如图所示,“酸浸”的最佳条件是。 (3)、“除铁”的离子方程式为。(提示: 参与反应,转移 电子)(4)、从“滤液2”中可提取一种化肥,其电子式为。(5)、“灼烧”时通入 的作用是。12. 苯硫酚 是一种局部麻醉剂。某小组拟制备苯硫酚并探究其性质,已知相关物质的部分信息如下表所示:
(3)、“除铁”的离子方程式为。(提示: 参与反应,转移 电子)(4)、从“滤液2”中可提取一种化肥,其电子式为。(5)、“灼烧”时通入 的作用是。12. 苯硫酚 是一种局部麻醉剂。某小组拟制备苯硫酚并探究其性质,已知相关物质的部分信息如下表所示:物质
化学式
相对分子质量
熔点/
沸点/
相对密度
溶解性
苯硫酚
110
169.5
1.07
难溶于水
苯磺酰氯
176.5
14.5
251
1.38
难溶于水
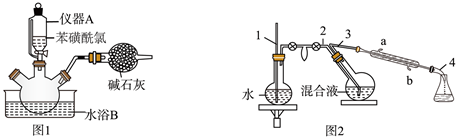
操作步骤:
①向三口烧瓶中加入 冰和 浓硫酸。
②再向三口烧瓶中慢慢加入 苯磺酰氯,尽快地分次加入 锌粉,继续反应 ,温度保持在 左右,如图1。
③撤去水浴B,微热三口烧瓶,并保持一定的回流。反应平稳后,再加热 。
④将反应后的混合液进行水蒸气蒸馏,分出苯硫酚,如图2。
⑤加入氯化钙,经操作X得粗品 。再进行蒸馏,收集馏分,得纯品 。
回答下列问题:
(1)、仪器A的名称是。(2)、已知:在水中加入盐,水的沸点会升高,凝固点会降低。水浴B应选择(填标号)。a.冰盐水浴 b.冷水浴 c.热水浴
(3)、在水蒸气蒸馏中(如图2),导管1的作用是 , 冷凝管中冷却水从(填“a”或“b”,下同)口进、口出。(4)、步骤⑤中操作X是。蒸馏时,收集馏分时温度计的读数为 。(5)、本实验中,苯硫酚的产率约为(保留整数) 。(6)、取少量苯硫酚产品于酸性 溶液中,振荡,溶液褪色,说明苯硫酚具有(填“氧化”或“还原”)性。13. 化学链燃烧是利用载氧体将空气中的氧传输至燃料的新技术。基于 载氧体的丙烷化学链燃烧技术原理如图所示。
空气反应器与燃料反应器中发生的反应分别如下:
反应1:
反应2:
反应3:
请回答下列问题:
(1)、反应1在(填“高温”、“低温”或“任意温度”)下能自发。(2)、反应2的平衡常数表达式 , 。(3)、一定温度下,在容积可变的密闭容器中加入足量 和适量的 发生反应1,达到平衡时测得气体压强为 。①温度不变,将容器体积扩大至原来的2倍且不再改变,达到新的平衡时,气体压强 。
②当 的质量不变时,(填“能”或“不能”)说明该反应达到平衡状态。
③若达到平衡之后,保持恒温恒容条件下再充入少量 ,平衡(填“向正反应方向”、“向逆反应方向”或“不”)移动,达到新平衡之后, 的平衡转化率(填“增大”、“减小”或“不变”)。
(4)、在一定温度下,总压强恒定为 ,在密闭容器中加入丙烷和氨气的混合气体以及足量 ,只发生上述反应2(氨气不参与反应),测得丙烷的平衡转化率与投料比 的关系如图所示。随着投料比 增大, 的平衡转化率减小的原因是。 14. 三草酸合铁酸钾 是制备铁触媒上的主要原料。在光照下分解:
14. 三草酸合铁酸钾 是制备铁触媒上的主要原料。在光照下分解:。回答下列问题:
(1)、基态 原子的电子排布式为 , 基态 与 中未成对电子的数目之比为。(2)、三草酸合铁酸钾所含元素中,第一电离能最大的是(填元素符号,下同),电负性最大的是。(3)、1个 与1个 分子中 键数目之比为 , 分子的立体构型为。(4)、金刚石的晶胞结构如图所示,碳原子分别位于顶点、面心和体内。
若图中原子1的坐标为 ,则原子2的坐标为。
15. 《自然材料》报道,华人科学家采用“一锅法”合成超高强度的离子液体凝胶材料 ,其结构简式如图所示( 为 或 )。
一种合成 的路线如下:

请回答下列问题:
(1)、 属于(填“纯净物”或“混合物”)。(2)、D中官能团的名称为。(3)、 的反应类型是; (尿不湿)具有强吸水性,其原因是。(4)、在一定条件下,制备高分子材料 的化学方程式为。(5)、G是D的同系物,G的相对分子质量比D大14,其核磁共振氢谱上有3组峰且峰的面积比为 的结构简式为。