福建省龙岩市2022届高中毕业班第三次教学质量检测化学试题
试卷更新日期:2022-05-23 类型:高考模拟
一、单选题
-
1. 《本草纲目》中有“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”记载。有关说法错误的是( )A、薪柴之灰可做钾肥 B、取碱浇衣存在水解反应 C、碱浣衣与肥皂浣衣原理不同 D、上述过程涉及溶解、过滤、蒸馏操作2. 异黄酮类化合物是药用植物的有效成分之一,一种异黄酮类化合物Z的部分合成路线如图:

下列说法错误的是( )
A、X能被 溶液氧化 B、1molY最多能与4molNaOH反应 C、Z中环上的氧原子的杂化方式为 D、X、Y、Z均能发生加成、取代反应3. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、20gD216O含中子数目为8NA B、44gCO2和足量 反应,转移电子数为NA C、常温下,1LpH=1的 溶液中氧原子数为2NA D、标况下,22.4L 溶于水所得溶液中, 、Cl-、HClO和ClO-微粒总数为2NA4. 磷化氢(PH3)是一种在空气中能自燃的剧毒气体,可通过以下流程制取:
下列说法错误的是( )
A、 既能与酸反应又能与碱反应 B、流程中有两处涉及氧化还原反应 C、该过程需要在无氧条件下进行 D、分解反应生成 和 的物质的量之比为1∶15. 下列有关离子方程式的书写正确的是( )A、向FeI2溶液滴入少量Br2:2Fe2++Br2=2Fe3++2Br- B、泡沫灭火器的反应原理: C、Zn溶于过量的浓硝酸: D、同浓度同体积的 溶液与NaOH溶液混合:6. 用下列装置进行相应实验,能达到实验目的的是( )A
B
C
D




验证非金属性:S>C>Si
实验室制乙烯
蒸发结晶获得晶体FeSO4·7H2O
用于除去气体中的杂质
A、A B、B C、C D、D7. 某种锂盐的结构如图所示,其阴离子由W、X、Y、Z四种同周期主族元素构成,X原子的最外层电子数是W原子的次外层电子数的3倍,化合物中除Li+外其它原子均满足8电子稳定结构。下列说法正确的是( )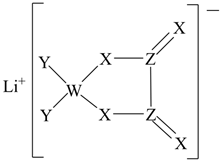 A、W位于第2周期IVA族 B、原子半径:Z>X>Y C、元素电负性:Y>Z>X D、最高化合价:Y>Z>W8. 如图是某科研团队设计的光电催化反应器,可由CO2制得异丙醇。其中A、B均是惰性电极,下列说法正确的是( )
A、W位于第2周期IVA族 B、原子半径:Z>X>Y C、元素电负性:Y>Z>X D、最高化合价:Y>Z>W8. 如图是某科研团队设计的光电催化反应器,可由CO2制得异丙醇。其中A、B均是惰性电极,下列说法正确的是( )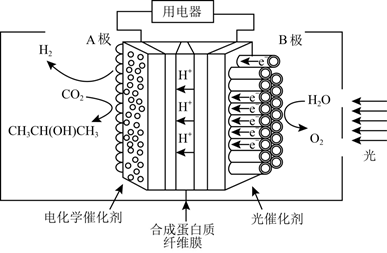 A、B为正极 B、若A极产生2gH2 , 则B极产生16gO2 C、电子从B极通过合成蛋白质纤维膜到A极 D、A极上 参与的反应为:3CO2+18H++18e-=CH3CH(OH)CH3+5H2O9. 在Fe+催化下乙烷氧化的反应机理如图所示(图中……为副反应)。下列说法正确的是( )
A、B为正极 B、若A极产生2gH2 , 则B极产生16gO2 C、电子从B极通过合成蛋白质纤维膜到A极 D、A极上 参与的反应为:3CO2+18H++18e-=CH3CH(OH)CH3+5H2O9. 在Fe+催化下乙烷氧化的反应机理如图所示(图中……为副反应)。下列说法正确的是( ) A、FeO+、N2均为反应中间体 B、X既含极性共价键也含非极性共价键 C、该机理涉及的反应均为氧化还原反应 D、每生成1molCH3CHO,消耗的 大于2mol10. 常温下,向某浓度的 溶液中逐滴加入NaOH溶液,溶液中-lgc(x)(x为H2A、HA-或A2-)与溶液pH的变化关系如图所示。则下列说法正确的是( )
A、FeO+、N2均为反应中间体 B、X既含极性共价键也含非极性共价键 C、该机理涉及的反应均为氧化还原反应 D、每生成1molCH3CHO,消耗的 大于2mol10. 常温下,向某浓度的 溶液中逐滴加入NaOH溶液,溶液中-lgc(x)(x为H2A、HA-或A2-)与溶液pH的变化关系如图所示。则下列说法正确的是( )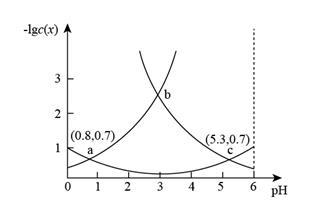 A、c点溶液中c(Na+)>3c(A2-) B、整个过程中[c(H2A)+c(HA-)+c(A2-)]保持不变 C、将等物质的量浓度的NaHA与H2A溶液等体积混合,所得溶液pH=0.8 D、b点对应溶液的pH为3.05
A、c点溶液中c(Na+)>3c(A2-) B、整个过程中[c(H2A)+c(HA-)+c(A2-)]保持不变 C、将等物质的量浓度的NaHA与H2A溶液等体积混合,所得溶液pH=0.8 D、b点对应溶液的pH为3.05二、综合题
-
11. 下图是一种处理废锌锰干电池的流程,电池内除铜帽、锌皮(含少量铁)、石墨棒外,还含有MnOOH、ZnCl2、NH4Cl、C及有机物等糊状填充物。

回答下列问题:
(1)、“溶解”过程中为了提高浸出效率,可以采取的措施有;(写一条即可)(2)、将“滤渣1”灼烧有 生成,产生 的化学方程式为;(3)、“氧化”过程中,还原产物是;(4)、“滤渣2”的主要成分是;(5)、“调pH”时,应控制溶液pH的范围是;(已知:“溶解”后的溶液中c(Zn2+)=0.10mol/L,忽略滴加 、氨水后溶液的体积变化;Ksp[Zn(OH)2]=10-17 , Ksp[Fe(OH)2]=10-17 , Ksp[Fe(OH)3]=10-38.3)(6)、写出“沉锌”的离子方程式;(7)、测定NH4Cl晶体中的氮元素含量:准确称取样品0.100g放至锥形瓶中,加适量的水完全溶解,再加5mL中性甲醛溶液(足量),摇匀,静置,用0.100mol/L的NaOH标准溶液平行滴定三次,消耗标准溶液的平均体积为18.50mL,则样品中氮元素的质量分数为。[已知:4 +6HCHO=(CH2)6N4H++3H++6H2O;(CH2)6N4H++3H++4OH-=(CH2)6N4+4H2O]
12. 某化学实验小组探究 与 溶液的反应。(1)、实验一:用如图所示实验装置制备 ,并将足量 通入 溶液中,溶液迅速变为血红色;停止通入气体,将血红色溶液密闭放置5小时后,溶液变为浅绿色。
制备 的化学反应方程式为;
(2)、仪器a的名称为 , 按图示装好药品后,打开K之前的操作是。(3)、某同学取适量酸性 于试管中,滴入几滴血红色溶液,溶液的紫色褪去,据此推断血红色溶液中含有Fe2+。此结论(填“正确”、“不正确”),理由是。(4)、实验二:探究血红色溶液产生的原因实验过程如下表:
实验序号
假设
实验内容
结论
①
与溶液中c(H+)有关
取适量上述血红色溶液,滴入Y溶液,溶液又变为黄色
假设不成立
②
与c(H2SO3)或c(SO2)有关
1溶液中,滴入1mol/LNaHSO3溶液,溶液呈血红色,再逐滴滴入HCl溶液,出现×××现象
假设不成立
③
与c( )或c( )有关
在FeCl3溶液中加入Na2SO3溶液,立即变为血红色。
实验①中,Y是(填化学式);实验②中现象是;实验③的结论是。
(5)、为了进—步探究血红色物质产生主要原因,又进行了以下实验:在0.5mL1mol/L的FeCl3溶液中,加入浓度相同的Na2SO3溶液V1mL,NaHSO3溶液V2mL并混合均匀,改变V1、V2的值并维持V1+V2=4.0进行多组实验,测得混合溶液的吸光度与 的关系如图所示。(已知吸光度越大,溶液颜色越深)。

①维持V1+V2=4.0的目的是。
②该实验得出的结论是。
13. CO2—CH4催化重整是减缓温室效应、实现碳中和的重要方式,其主反应为:CO2(g)+CH4(g)⇌ 2CO(g)+2H2(g) △H,反应体系还涉及以下副反应:i.CH4(g)⇌C(s)+2H2(g) △H1=+75.0kJ/mol
ii.CO2(g)+H2(g)⇌CO(g)+H2O(g) △H2=+41.0kJ/mol
iii.CO(g)+H2(g)⇌C(s)+H2O(g) △H3=-131.0kJ/mol
(1)、主反应的△H=kJ/mol。(2)、我国学者对催化重整的主反应进行理论研究,提出在Pt—Ni或Sn—Ni合金催化下,先发生甲烷逐级脱氢反应,其反应历程如图所示(*表示吸附在催化剂表面)。
①该历程中最大能垒E(正)=eV/mol;
②其它条件相同时,催化重整的主反应在不同催化剂下反应相同时间,CO的产率随反应温度的变化如图所示:

B是合金催化下CO的产率随温度的变化曲线,A、B曲线到达W点后重合,请解释原因。
(3)、在恒容密闭容器中通入1molH2及一定量CO,反应ⅲ中CO的平衡转化率随n(CO)及温度变化如图。
①A、B两点对应的CO正反应速率v正(A)v正(B)(填“<”“=”或“>”,下同),B和C两点对应的反应温度TBTC。
②已知反应速率v正=k正x(CO)x(H2),v逆=k逆x(H2O),k为反应速率常数,x为气体的体积分数,在达到平衡状态为D点的反应过程(此过程为恒温)中,当某时刻CO的转化率刚好达到60%时, =。(用含k正和k逆的式子表示)
14. 最近,妖“镍”横行,价格飙涨。镍是一种硬而有延展性并具有铁磁性的金属,在许多领域应用广泛。回答下列问题:(1)、基态Ni原子核外电子的运动状态有种;Ni的熔点明显高于Ca,其原因是。(2)、Ni—NTA—Nangold可用于检测或定位6x组氨酸(His)或Poly—His标记的重组蛋白。Ni(Ⅱ)—NTA的结构简式如图所示。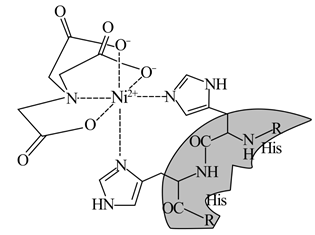
①与Ni2+配位的原子形成的空间构型为。
②配体N(CH2COO-)3中4种元素的I1从大到小的顺序为(用元素符号表示)。
③已知N……Ni存在大π键,其结构中氮原子的杂化方式为。
(3)、Ni可以形成多种氧化物,其中一种NixO晶体晶胞结构为NaCl型,由于晶体缺陷,部分Ni2+被Ni3+取代,如图所示,其结果晶体仍呈电中性。则x1(填“>”“<”或“=”)。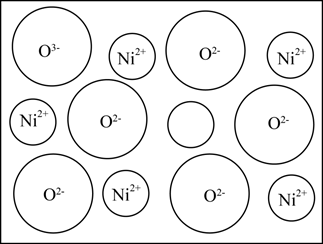 (4)、镍掺杂的稀磁半导体DMS的立方晶胞结构如图所示。已知晶体密度为dg/cm3 , 设NA为阿伏加德罗常数的值,则Ni原子与Mg原子间的距离为cm(列出计算表达式)。
(4)、镍掺杂的稀磁半导体DMS的立方晶胞结构如图所示。已知晶体密度为dg/cm3 , 设NA为阿伏加德罗常数的值,则Ni原子与Mg原子间的距离为cm(列出计算表达式)。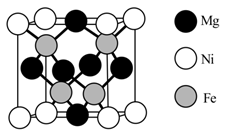 15. 以下是合成有机化合物X的一种路线(部分反应条件或试剂略去)。
15. 以下是合成有机化合物X的一种路线(部分反应条件或试剂略去)。
已知:R1-CHO+


请回答下列问题:
(1)、B的名称是。(2)、由A制备B所用试剂为。(3)、若D→E是在碱性水溶液中进行,则B→D反应类型为。(4)、E中的官能团名称为。(5)、J在一定条件下自身分子间发生反应,生成化合物X、乙酸和水,生成物中乙酸和X的物质的量比是。(6)、G→J的化学方程式是。(7)、写出同时符合下列条件的E同分异构体的结构简式(写2种)。①能使FeCl3溶液显紫色
②能发生水解
③苯环上有三个取代基且只有两种不同化学环境的氢