北京市西城区2022届高三第二次模拟测试化学试题
试卷更新日期:2022-05-23 类型:高考模拟
一、单选题
-
1. 将氧化还原反应拆解为氧化反应和还原反应的分析过程,蕴含的化学学科的思想方法是( )A、分与合相结合 B、量变与质变相结合 C、化学与社会和谐发展 D、物质变化是有条件的2. 下列图示正确的是( )A、3p电子的电子云轮廓图:
 B、SO3的VSEPR模型:
B、SO3的VSEPR模型:  C、As的原子结构示意图:
C、As的原子结构示意图:  D、HCl的形成过程:
D、HCl的形成过程:  3. 下列事实不能直接从原子结构角度解释的是( )A、化合物ICl中I为+1价 B、第一电离能:B>Al C、沸点:CS2>CO2 D、热稳定性:NH3>PH34. 我国拥有独立知识产权的抗高血压药物左旋氨氯地平的分子具有手性,其结构简式如图。下列关于左旋氨氯地平的说法错误的是( )
3. 下列事实不能直接从原子结构角度解释的是( )A、化合物ICl中I为+1价 B、第一电离能:B>Al C、沸点:CS2>CO2 D、热稳定性:NH3>PH34. 我国拥有独立知识产权的抗高血压药物左旋氨氯地平的分子具有手性,其结构简式如图。下列关于左旋氨氯地平的说法错误的是( ) A、分子中含有酯基 B、酸性条件下的所有水解产物均能与NaHCO3溶液反应 C、能与H2发生加成反应 D、有手性异构体5. 向含HCN的废水中加入铁粉和K2CO3可制备K4[Fe(CN)6],反应如下:6HCN+Fe+2K2CO3=K4[Fe(CN)6]+H2↑+2CO2↑+2H2O。下列说法错误的是( )A、依据反应可知:Ka(HCN)>Ka1(H2CO3) B、HCN的结构式是H—C≡N C、反应中每1molFe转移2mol电子 D、[Fe(CN)6]4-中Fe2+的配位数是66. 下列实验方案能达到相应实验目的的是( )
A、分子中含有酯基 B、酸性条件下的所有水解产物均能与NaHCO3溶液反应 C、能与H2发生加成反应 D、有手性异构体5. 向含HCN的废水中加入铁粉和K2CO3可制备K4[Fe(CN)6],反应如下:6HCN+Fe+2K2CO3=K4[Fe(CN)6]+H2↑+2CO2↑+2H2O。下列说法错误的是( )A、依据反应可知:Ka(HCN)>Ka1(H2CO3) B、HCN的结构式是H—C≡N C、反应中每1molFe转移2mol电子 D、[Fe(CN)6]4-中Fe2+的配位数是66. 下列实验方案能达到相应实验目的的是( )选项
实验目的
实验方案
A
制备无水FeCl3固体
将FeCl3溶液加热蒸干
B
检验浓H2SO4催化纤维素水解的产物含有还原糖
向水解后的溶液中加入新制的Cu(OH)2 , 加热
C
配制1L1.0mol/LNaCl溶液
将58.5gNaCl固体直接溶于1L水中
D
证明醋酸是弱电解质
测0.1mol/LCH3COOH溶液的pH
A、A B、B C、C D、D7. 工业合成乙醇的反应:C2H4(g)+H2O(g) C2H5OH(g) ΔH<0,在催化剂、260-290℃。和约7MPa的条件下进行。下列说法错误的是( )A、循环使用乙烯是为了提高乙烯的利用率 B、原理分析表明合成时压强越大越好,但实际生产中还要考虑安全、成本等因素 C、其他条件不变时,投料比n(H2O)∶n(C2H4)越小,乙烯的平衡转化率越大 D、寻找高活性的催化剂是研究该反应的重要方向8. 在卤水精制中,纳滤膜对Ca2+、Mg2+有很高的脱除率。一种网状结构的纳滤膜J的合成路线如图(图中 表示链延长)。
表示链延长)。 已知:
 +—NH2
+—NH2  +HCl
+HCl 下列说法错误的是( )A、合成J的反应为缩聚反应 B、MPD的核磁共振氢谱有3组峰 C、J具有网状结构与单体TMC的结构有关 D、J有亲水性可能与其存在正负离子对有关9. 在常温下,向30mL0.1mol/LNH4Cl溶液中加入0.1mol/LCH3COONH4溶液,溶液的pH随加入CH3COONH4溶液的体积的变化如图。已知:CH3COONH4溶液的pH约为7。
下列说法错误的是( )A、合成J的反应为缩聚反应 B、MPD的核磁共振氢谱有3组峰 C、J具有网状结构与单体TMC的结构有关 D、J有亲水性可能与其存在正负离子对有关9. 在常温下,向30mL0.1mol/LNH4Cl溶液中加入0.1mol/LCH3COONH4溶液,溶液的pH随加入CH3COONH4溶液的体积的变化如图。已知:CH3COONH4溶液的pH约为7。
下列说法正确的是( )
A、NH4Cl溶液中存在:c(NH )>c(Cl-)>c(H+)>c(OH-) B、0.1mol/LCH3COONH4溶液中的c(NH )比0.1mol/LNH4Cl溶液中的大 C、如图说明NH4Cl溶液中存在水解平衡 D、溶液的pH变化是NH 浓度改变造成的10. 某小组探究NH3的催化氧化,实验装置图如图。③中气体颜色无明显变化,④中收集到红棕色气体,一段时间后产生白烟。
下列分析错误的是( )
A、若②中只有NH4Cl不能制备NH3 B、③、④中现象说明③中的反应是4NH3+5O2 4NO+6H2O C、④中白烟的主要成分是NH4Cl D、一段时间后,⑤中溶液可能变蓝11. 实验I和实验II中,均有气体产生。
下列分析错误的是( )
A、NaHSO3溶液中:c(SO )>c(H2SO3) B、I中有CO2生成 C、II中产生白色沉淀 D、I和II中溶液的pH均增大12. 我国科学家采用单原子Ni和纳米Cu作串联催化剂,通过电解法将CO2转化为乙烯。装置示意图如图。已知:电解效率η(B)= ×100%。

下列说法错误的是( )
A、电极a连接电源的负极 B、电极b上有O2产生 C、纳米Cu催化剂上发生反应:2CO+6H2O+8e-=C2H4+8OH- D、若乙烯的电解效率为60%,电路中通过1mol电子时,产生0.075mol乙烯13. 某小组探究Cu与H2O2在不同条件下的反应,实验结果如表:装置
实验
试剂a
现象与结果

I
10h后,液体变为浅蓝色,将铜片取出、干燥,铜表面附着蓝色固体,成分是Cu(OH)2
II
8mL5mol/L氨水
立即产生大量气泡,溶液变为深蓝色,将铜片取出、干燥,铜表面附着蓝色固体,成分是Cu(OH)2
III
8mL5mol/L氨水和1gNH4Cl固体
立即产生大量气泡,溶液变为深蓝色,将铜片取出、干燥,铜片依然保持光亮
下列说法错误的是( )
A、I中生成Cu(OH)2的反应是Cu+H2O2=Cu(OH)2 B、由实验可知,增大c(OH-),H2O2的氧化性增强 C、增大c(NH4+)有利于[Cu(NH3)4]2+的生成 D、[Cu(NH3)4]2+可能是H2O2分解的催化剂14. 异丁醇催化脱水制备异丁烯主要涉及以下2个反应。研究一定压强下不同含水量的异丁醇在恒压反应器中的脱水反应,得到了异丁烯的平衡产率随温度的变化结果如图。
①
 (g)
(g)  (g)+H2O(g) ΔH1=+28kJ/mol K1(190℃)=104
(g)+H2O(g) ΔH1=+28kJ/mol K1(190℃)=104②2
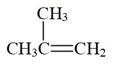 (g)
(g)  (g)(二聚异丁烯) ΔH2=-72kJ/mol K2(190℃)=0.1
(g)(二聚异丁烯) ΔH2=-72kJ/mol K2(190℃)=0.1下列说法错误的是( )
A、其他条件不变时,在催化剂的活性温度内,升高温度有利于异丁烯的制备 B、高于190℃时,温度对异丁烯的平衡产率影响不大的原因是K1>104、K2<0.1 C、190℃时,增大n(H2O):n(异丁醇),不利于反应②的进行 D、若只有异丁烯、水和二聚异丁烯生成,则初始物质浓度c0与流出物质浓度c之间存在:c0(异丁醇)=c(异丁烯)+2c(二聚异丁烯)二、综合题
-
15. MnO2可作氨选择性催化还原法脱除NOx的催化剂。(1)、基态Mn的价层电子排布的轨道表示式是。(2)、MnO2可由(NH4)2S2O8与MnSO4反应制得。S2O 的结构如图。

①S2O 中S-O-O(填“是”或“不是”)在一条直线上。
②S2O 中的O-O比H2O2中的更(填“难”或“易”)断裂。
(3)、一种MnO2晶体的晶胞示意图如图,该长方体晶胞的长和宽均为anm,高为bnm。
①图中“●”代表的是(填“Mn”或“O”)。
②NA为阿伏加德罗常数,该晶体的密度为g·cm-3。
③MnO2作催化剂,氨催化还原脱除NO的一种催化机理示意图如图。

从化学键的角度解释MnO2能结合NH3的原因:。该催化过程的总反应的化学方程式是。
16. 处理再利用H2S有多种方法。(1)、碱法脱硫用K2CO3溶液吸收H2S。
已知:氢硫酸和碳酸的电离常数如表。
Ka1
Ka2
H2S
1.1×10-7
1.3×10-13
H2CO3
4.5×10-7
4.7×10-11
①用化学用语表示K2CO3溶液显碱性的原因:。
②用过量的K2CO3溶液吸收H2S的离子方程式是。
(2)、热分解法脱硫在密闭容器中发生反应2H2S(g) S2(?)+2H2(g)。其他条件不变时,H2S的平衡转化率随温度和压强的变化如图。

①P3>P2>P1 , 反应中S2(填‘“是”或“不是”)气态,理由是。
②实际反应在高温下进行的原因是。
(3)、间接电解法脱硫间接电解法脱硫过程的示意图如图。

①溶液X的主要溶质是。
②简述在电解反应器中FeCl3溶液再生的原理:。
③不考虑其他副反应,理论上5molH2S反应能生成gH2。
17. 香豆素类化合物在药物中应用广泛。香豆素类化合物W的合成路线如图。
已知:i.
 →
→  +H2O
+H2Oii.—CHO+

 +H2O
+H2Oiii.R1—CH=CH—R2 +R1COOH+R2COOH
(1)、A→B的化学方程式是。(2)、D的分子式是。(3)、条件①是。(4)、F的结构简式是。(5)、1molJ可以生成2molK,J的结构简式是。(6)、下列说法错误的是(填序号)。a.可以用酸性KMnO4溶液鉴别E和G
b.G可以发生加聚反应、还原反应和取代反应
c.1molP最多可以和5molH2反应
(7)、M为线型不稳定分子,M→P经过两步反应,R苯环上的一氯代物有3种。
①R的结构简式是。
②R→P的化学反应类型是。
18. 向含有NaOH的NaClO溶液中逐滴滴入FeSO4溶液,滴加过程中溶液的pH随FeSO4溶液的体积的变化曲线及实验现象见表。变化曲线
实验现象

i.A→B产生红褐色沉淀
ii.B→C红褐色沉淀的量增多
iii.C→D红褐色沉淀的量增多
iv.D点附近产生有刺激性气味的气体
v.D→E红褐色沉淀的量略有增多
资料:i.饱和NaClO溶液的pH约为11
ii.Ksp[Fe(OH)3]=2.8×10-39
(1)、Cl2和NaOH溶液制取NaClO的离子方程式是。(2)、A点溶液的pH约为13,主要原因是。(3)、结合离子方程式解释A→B溶液的pH显著下降的主要原因:。(4)、NaClO溶液中含氯各微粒的物质的量分数与pH的关系如图。
①M点溶液含氯的微粒有。
②C点附近生成红褐色沉淀的主要反应的离子方程式是。
(5)、检验iv中气体的方法是。(6)、A→D的过程中,溶液的pH一直下降,原因是。(7)、整个滴加过程中发生的反应与、微粒的浓度等有关。19. 在处理NO废气的过程中,催化剂[Co(NH3)6]2+会逐渐失活变为[Co(NH3)6]3+。某小组为解决这一问题,实验研究 和 之间的相互转化。资料:i.Ksp[Co(OH)2]=5.9×10-15 , Ksp[Co(OH)3]=1.6×10-44
ii.Co2++6NH3 [Co(NH3)6]2+K1=1.3×105
Co3++6NH3 [Co(NH3)6]3+K2=2×1035
iii.[Co(NH3)6]2+和[Co(NH3)6]3+在酸性条件下均能生成NH
(1)、探究 的还原性实验I.粉红色的CoCl2溶液或CoSO4溶液在空气中久置,无明显变化。
实验II.向0.1mol/LCoCl2溶液中滴入2滴酸性KMnO4溶液,无明显变化。
实验III.按如图装置进行实验,观察到电压表指针偏转。

①甲同学根据实验III得出结论:Co2+可以被酸性KMnO4溶液氧化。
乙同学补充实验IV,(补全实验操作及现象),否定了该观点。
②探究碱性条件下 的还原性,进行实验。

ii中反应的化学方程式是。
③根据氧化还原反应规律解释:还原性Co(OH)2>Co2+:Co2+-e-=Co3+在碱性条件下,OH-与Co2+、Co3+反应,使c(Co2+)和c(Co3+)均降低,但降低的程度更大,还原剂的还原性增强。
(2)、探究 的氧化性①根据实验III和IV推测氧化性:Co3+>Cl2 , 设计实验证明:向V中得到的棕褐色沉淀中,(补全实验操作及现象),反应的离子方程式是。
②向V中得到的棕褐色沉淀中滴加H2SO4溶液,加入催化剂,产生无色气泡,该气体是。
(3)、催化剂[Co(NH3)6]2+的失活与再生①结合数据解释[Co(NH3)6]2+能被氧化为[Co(NH3)6]3+而失活的原因:。
②根据以上实验,设计物质转化流程图实现[Co(NH3)6]2+的再生:。
示例:Co CoCl2 Co(OH)2