北京市东城区2022届高三综合练习(二模)化学试题
试卷更新日期:2022-05-23 类型:高考模拟
一、单选题
-
1. 下列说法错误的是( )A、原子光谱可用于鉴定氢元素 B、电解法可用于冶炼铝等活泼金属 C、分馏法可用于提高石油中乙烯的产量 D、焰色试验可用于区分NaCl和KCl2. 下列事实一定能说明CH3COOH是弱电解质的是( )A、CH3COOH属于有机化合物 B、CH3COOH能与乙醇发生酯化反应 C、用CH3COOH溶液做导电实验,灯泡较暗 D、常温下,0.1mol·L-1CH3COOH溶液的pH约为33. 木犀草素有镇咳化痰的作用,其结构简式如图。下列说法错误的是( )
 A、分子中有3种含氧官能团 B、分子中碳原子均为sp2杂化 C、能与NaHCO3溶液反应,产生气泡 D、能与Br2发生取代反应和加成反应4. NH4Cl的晶胞为立方体,其结构如下。下列说法错误的是( )
A、分子中有3种含氧官能团 B、分子中碳原子均为sp2杂化 C、能与NaHCO3溶液反应,产生气泡 D、能与Br2发生取代反应和加成反应4. NH4Cl的晶胞为立方体,其结构如下。下列说法错误的是( ) A、NH4Cl晶体属于离子晶体 B、NH4Cl晶胞中H-N-H键角为90° C、NH4Cl晶体中既有离子键又有共价键 D、每个Cl-周围与它最近且等距离的 的数目为85. 下列离子检验利用了氧化还原反应的是( )
A、NH4Cl晶体属于离子晶体 B、NH4Cl晶胞中H-N-H键角为90° C、NH4Cl晶体中既有离子键又有共价键 D、每个Cl-周围与它最近且等距离的 的数目为85. 下列离子检验利用了氧化还原反应的是( )选项
待检验离子
检验试剂
A
Fe3+
KSCN溶液
B
I-
Cl2、淀粉溶液
C
稀盐酸、氯化钡溶液
D
浓NaOH溶液、湿润的红色石蕊试纸
A、A B、B C、C D、D6. 下列解释事实的方程式错误的是( )A、NO遇空气变为红棕色:2NO+O2=2NO2 B、用NaOH溶液吸收Cl2:OH-+Cl2=HClO+Cl- C、明矾净水:Al3++3H2O Al(OH)3(胶体)+3H+ D、向AgI悬浊液中滴加Na2S溶液,沉淀变黑:2AgI(s)+S2-(aq) Ag2S(s)+2I-(aq)7. 酸醇树脂广泛用于涂料行业。一种酸醇树脂P的结构片段如下图所示(“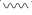 ”表示链延长)。下列说法错误的是( )
”表示链延长)。下列说法错误的是( )  A、树脂P为线型高分子 B、树脂P可发生水解反应 C、树脂P可由缩聚反应制得 D、合成树脂P的一种单体是甘油8. 下列实验操作一定能达到实验目的的是( )
A、树脂P为线型高分子 B、树脂P可发生水解反应 C、树脂P可由缩聚反应制得 D、合成树脂P的一种单体是甘油8. 下列实验操作一定能达到实验目的的是( )选项
实验目的
实验操作
A
除去乙炔中少量的H2S
将混合气通过盛有足量CuSO4溶液的洗气瓶
B
验证淀粉能发生水解反应
将淀粉和稀硫酸混合后加热煮沸,冷却后加入新制Cu(OH)2悬浊液
C
验证干燥的Cl2没有漂白性
将红色鲜花放入盛有干燥Cl2的集气瓶中
D
检验CH3CH2Br中的Br
加入足量稀硝酸,再滴加稀AgNO3溶液
A、A B、B C、C D、D9. 硝基苯甲酸乙酯(O2NC6H4COOC2H5)在碱性条件下发生水解反应:O2NC6H4COOC2H5+OH- O2NC6H4COO-+C2H5OH,两种反应物初始浓度均为0.05mol·L-1 , 测得O2NC6H4COOC2H5的转化率α随时间t变化曲线如下图所示(忽略溶液体积变化)。下列说法错误的是( ) A、t=700s时,反应达到平衡状态 B、t=600s时,硝基苯甲酸乙酯的浓度为0.015mol·L-1 C、达到平衡之前,随着反应的进行硝基苯甲酸乙酯水解速率逐渐减小 D、其他条件不变,提高c(OH-),可使该反应的化学平衡常数增大10. 下图是计算机模拟的在催化剂表面上水煤气变化的反应历程。吸附在催化剂表面的物种用“*”标注。
A、t=700s时,反应达到平衡状态 B、t=600s时,硝基苯甲酸乙酯的浓度为0.015mol·L-1 C、达到平衡之前,随着反应的进行硝基苯甲酸乙酯水解速率逐渐减小 D、其他条件不变,提高c(OH-),可使该反应的化学平衡常数增大10. 下图是计算机模拟的在催化剂表面上水煤气变化的反应历程。吸附在催化剂表面的物种用“*”标注。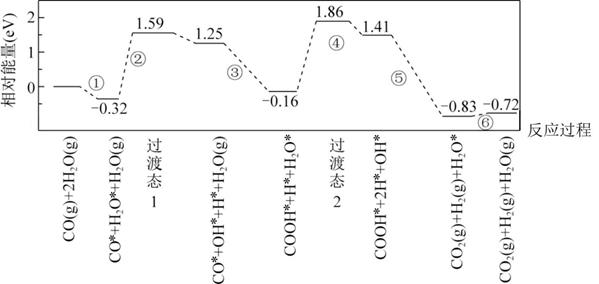
下列说法正确的是( )
A、①表示CO和H2O从催化剂表面脱离的过程 B、②和④中化学键变化相同,因此吸收的能量相同 C、由图可知CO(g)+H2O(g)=CO2(g)+H2(g)为吸热反应 D、本历程中的催化剂通过改变水煤气变化反应的焓变,来实现改变其反应速率11. 家庭常用的一种储水式电热水器的结构如下图所示,其中a、b为水管口。
下列说法错误的是( )
A、电热水器可将电能转化为热能 B、该热水器采用了牺牲阳极的电化学保护法 C、镁棒可以有效防止内部水垢生成 D、a应为出水口,b应为进水口12. CO2资源化利用是实现碳中和的一种有效途径。下图是CO2在电催化下产生合成气(CO和H2)的一种方法。下列说法错误的是( ) A、a电极连接电源的负极 B、 从a极区向b极区移动 C、b极区中c(CH3COO-)逐渐增大 D、a极区中c( )逐渐增大13. 以相同的流速分别向经硫酸酸化和未经酸化的浓度均为0.1mol·L-1的FeSO4溶液中通入O2.溶液中pH随时间的变化如下图所示。
A、a电极连接电源的负极 B、 从a极区向b极区移动 C、b极区中c(CH3COO-)逐渐增大 D、a极区中c( )逐渐增大13. 以相同的流速分别向经硫酸酸化和未经酸化的浓度均为0.1mol·L-1的FeSO4溶液中通入O2.溶液中pH随时间的变化如下图所示。
已知:0.1mol·L-1Fe3+生成Fe(OH)3 , 开始沉淀时pH=1.5,完全沉淀时pH=2.8
下列说法错误的是( )
A、由图1可知,酸化的FeSO4溶液中发生反应:4Fe2++O2+4H+=4Fe3++2H2O B、图2中,t=0时刻,FeSO4溶液pH=5.7是由于Fe2+发生了水解反应 C、由图2可知,未酸化的FeSO4溶液中发生反应生成Fe(OH)3的同时还生成了H+ D、若向FeSO4溶液中先加入过量NaOH溶液再通入O2 , pH先增大后明显减小14. 探究乙醛的银镜反应,实验如下(水浴加热装置已略去,水浴温度均相同)。已知:i.银氨溶液用2%AgNO3溶液和稀氨水配制
ii.[Ag(NH3)2]++2H2O⇌Ag++2NH3·H2O
序号
①
②
③
④
装置




现象
一直无明显现象
8min有银镜产生
3min有银镜产生
d中较长时间无银镜产生,e中有银镜产生
下列说法错误的是( )
A、a与b中现象不同的原因是[Ag(NH3)2]+能氧化乙醛而Ag+不能 B、c中发生的氧化反应为CH3CHO+3OH--2e-=CH3COO-+2H2O C、其他条件不变时,增大pH能增强乙醛的还原性 D、由③和④可知,c与d现象不同的原因是c(Ag+)不同二、综合题
-
15. 由氧元素形成的常见物质有H2O、H2O2、O2和O3等。(1)、基态氧原子的电子排布式是。(2)、H2O分子的VSEPR模型是形。(3)、对H2O2分子结构的研究,曾有以下推测:

①根据测定H2O2分子中(填字母序号),确定其结构一定不是甲。
a.H-O键长 b.O-O键能 c.H-O-O键角
②由于H2O2不稳定,很难得到晶体。20世纪40年代初,卢嘉锡等化学家用尿素(
 )与H2O2形成较稳定的尿素过氧化氢复合物晶体,进而测得H2O2结构为乙。上述晶体中尿素与H2O2分子交替排列且二者中的O均与另外分子的H之间形成氢键。
)与H2O2形成较稳定的尿素过氧化氢复合物晶体,进而测得H2O2结构为乙。上述晶体中尿素与H2O2分子交替排列且二者中的O均与另外分子的H之间形成氢键。a.H2O2为(填“极性”或“非极性”)分子。
b.用“X—H…Y”表示出上述晶体中形成的氢键:。
(4)、O2的晶胞为立方体,结构如下。
根据图中信息,可计算O2晶体密度是g·cm-3。
(5)、已知O3分子空间结构为V形,中心O为sp2杂化。除σ键外,O3分子中还形成了含4个电子的大π键。每个O3分子中用于成键的电子总数是个,中心O提供参与成键的电子数是个。16. 从矿石中提取金(Au)是获取贵金属的主要来源。(1)、俗话说“真金不怕火炼”,从化学性质角度解释其原因是。(2)、用硫代硫酸盐在弱碱性条件下浸金是提取金的一种方法。①补全反应的离子方程式。
口Au+口 +O2+口
 =口[Au(S2O3)2]3-+口
=口[Au(S2O3)2]3-+口 
②简述 在金被氧化过程中的作用:。
(3)、工业上常用CuSO4溶液、氨水和Na2S2O3溶液为原料配制浸金液,其一种可能的浸金原理示意图如下。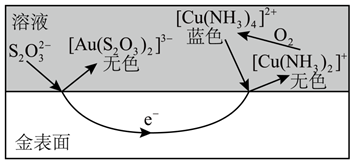
①上述原理可知,[Cu(NH3)4]2+在浸金过程中起作用。
②为了验证上述原理中O2的作用,进行如下实验。
实验现象:反应一段时间后,温度无明显变化,U形管内液柱左高右低,锥形瓶中溶液蓝色变浅,打开瓶塞后……
a.打开瓶塞后,(填实验现象),证实了上述原理。
b.a中现象对应反应的离子方程式是。
③下图表示相同时间内,配制浸金液的原料中c(CuSO4)对浸金过程中 消耗率和浸金量的影响(其他条件不变)。
已知:2Cu2++6 ⇌2[Cu(S2O3)2]3-+
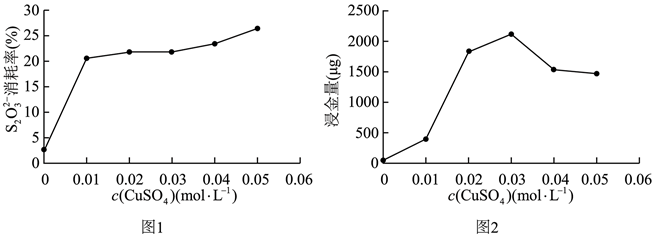
结合图1,解释图2中浸金量先上升后下降的原因:。
17. 实验小组同学为探究Fe2+的性质,进行如下实验。【实验I】向2 mL0.1 mol·L-1FeSO4溶液中滴加几滴0.1 mol·L-1KSCN溶液,无明显现象,再滴加几滴3%H2O2溶液(用H2SO4酸化至pH=1),溶液颜色变红。
(1)、甲同学通过上述实验分析Fe2+具有(填“氧化”或“还原”)性。乙同学查阅资料发现Fe2+与SCN-也可发生反应,生成无色的配合物。为证实该性质,利用FeCO3进行如下实验。
(2)、FeCO3的制备:用过量NH4HCO3溶液与FeSO4溶液反应得到FeCO3 , 离子方程式为。(3)、【实验II】验证Fe2+与SCN-发生反应
通过实验b排除了的干扰。
(4)、从沉淀溶解平衡角度解释实验a和b最终溶液颜色不同的原因是。丙同学设计实验进一步证明Fe2+可与SCN-反应。
(5)、[实验III]
上述实验中,d为c的对照实验。
①X为。
②实验能够证实Fe2+可与SCN-反应,则应观察到的现象是。
(6)、实验II中若未加适量水稀释,则无法通过现象得出结论。推测加水稀释的目的可能有:使后续实验颜色变化易于观察;降低c(Fe3+)。18. 马尼地平( )主要用于治疗原发性高血压,其一种合成路线如下。
)主要用于治疗原发性高血压,其一种合成路线如下。 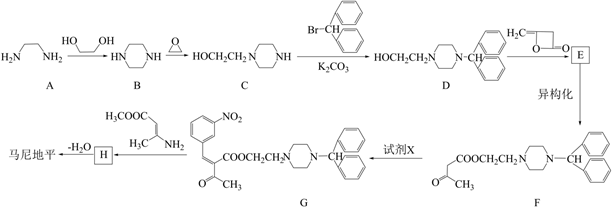
已知:i.R1COOR2+R3OH→R1COOR3十R2OH
ii.
 (1)、A→B的反应方程式是。(2)、C→D的反应类型是。(3)、E中含氧官能团是。(4)、试剂X的分子式为C7H5NO3 , 其结构简式是。(5)、H分子中有两个含氮六元环,其结构简式如图,在虚线框内将H的结构简式补充完整。
(1)、A→B的反应方程式是。(2)、C→D的反应类型是。(3)、E中含氧官能团是。(4)、试剂X的分子式为C7H5NO3 , 其结构简式是。(5)、H分子中有两个含氮六元环,其结构简式如图,在虚线框内将H的结构简式补充完整。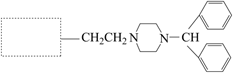 (6)、合成上述流程中
(6)、合成上述流程中 的一种方法如下。
的一种方法如下。 
试剂a、中间产物2的结构简式分别是、。
19. Mn及其化合物在工业生产中具有重要的用途。(1)、I.以含MnCO3的矿石为原料,经硫酸溶解得到含Mn2+的溶液,再经一系列处理后进行电解,获得金属Mn。Mn在(填“阳极”或“阴极”)生成。
(2)、阳极泥中含有MnO2 , 写出产生MnO2的电极反应式:。(3)、II.阳极泥中除含锰元素外,还含有铅元素,采用如下方法可将它们分别转化为活性MnO2和PbO。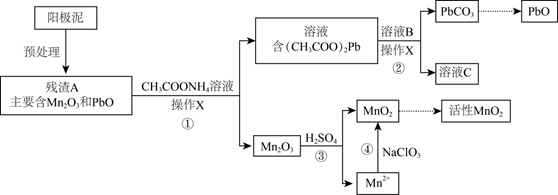
已知:(CH3COO)2Pb在水中难解离。
操作X为。
(4)、①中反应的离子方程式为。(5)、滤液C能循环使用,②中溶液B的溶质为。(6)、a.为了将③中Mn2O3完全转化为MnO2 , 理论上④中加入的NaClO3与Mn2O3的物质的量之比为(已知NaClO3的还原产物为NaCl)。b.加入NaClO3前,需将溶液pH调大至6左右。调节pH的目的是。
(7)、活性MnO2纯度的测定i.用V1mLc1mol∙L-1Na2C2O4溶液(H2SO4)酸化)溶解wg活性MnO2样。品。(MnO2+ +4H+=2CO2↑+Mn2++2H2O)
ii.用c2mol∙L-1酸性KMnO4标准溶液滴定i中剩余的 消耗KMnO4标准溶液V2mL。(5 +2 +16H+=2Mn2++10CO2↑+8H2O)
样品中MnO2的质量分数=[M(MnO2)=87g·mol-1]。