北京市昌平区2022届高三二模化学试题
试卷更新日期:2022-05-23 类型:高考模拟
一、单选题
-
1. 化学与生活密切相关,下列过程与氧化还原反应有关的是( )
 A、图甲碳酸氢钠片可治疗胃酸过多 B、图乙豆浆中加入浓盐溶液,产生沉淀 C、图丙天然气燃烧 D、图丁海水经风吹日晒获得粗盐2. 下列有关化学用语表述正确的是( )A、中子数为16的硫原子: S B、还原性:Na<Mg C、CO2的电子式:
A、图甲碳酸氢钠片可治疗胃酸过多 B、图乙豆浆中加入浓盐溶液,产生沉淀 C、图丙天然气燃烧 D、图丁海水经风吹日晒获得粗盐2. 下列有关化学用语表述正确的是( )A、中子数为16的硫原子: S B、还原性:Na<Mg C、CO2的电子式: D、Al3+的结构示意图:
D、Al3+的结构示意图:  3. 蜂胶中某活性物质X的结构简式如图,下列关于X的说法错误的是( )
3. 蜂胶中某活性物质X的结构简式如图,下列关于X的说法错误的是( )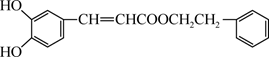 A、X能使溴的四氯化碳溶液褪色 B、1molX最多能与2molNaOH反应 C、X可发生取代反应 D、X具有还原性4. 检验下列溶液是否变质,所选试剂合理的是( )
A、X能使溴的四氯化碳溶液褪色 B、1molX最多能与2molNaOH反应 C、X可发生取代反应 D、X具有还原性4. 检验下列溶液是否变质,所选试剂合理的是( )选项
A
B
C
D
溶液
Na2SO3溶液.
FeSO4溶液
KI溶液
NaOH溶液
所选试剂
BaCl2溶液
KSCN溶液
AgNO3溶液
高锰酸钾溶液
A、A B、B C、C D、D5. 如图所示,先在小烧杯中加入0.01mol/LBa(OH)2溶液50mL,再滴入几滴酚酞溶液,接通电源,再向滴定管小烧杯中匀速滴加0.2mol/LH2SO4溶液3mL,可观察到的现象有:①小灯泡变暗直至熄灭②溶液颜色变浅直至褪去③产生白色沉淀④小灯泡变亮,以下说法正确的是( ) A、现象③可说明溶液中H+与OH-发生反应 B、溶液颜色变浅的原因是反应中酚酞被消耗 C、小灯泡变暗直至熄灭的原因是溶液中自由移动的离子浓度减小直至几乎为0 D、若将H2SO4换为Na2SO4 , 也会产生相似现象6. 利用如图装置可以达到实验目的的是( )
A、现象③可说明溶液中H+与OH-发生反应 B、溶液颜色变浅的原因是反应中酚酞被消耗 C、小灯泡变暗直至熄灭的原因是溶液中自由移动的离子浓度减小直至几乎为0 D、若将H2SO4换为Na2SO4 , 也会产生相似现象6. 利用如图装置可以达到实验目的的是( )
选项
实验目的
X中试剂
Y中试剂
A
用MnO2和浓盐酸制取并收集纯净干燥的Cl2
饱和食盐水
浓硫酸
B
用Cu与浓硝酸制取并收集纯净干燥的NO2
水
浓硫酸
C
用大理石和稀盐酸制取并收集纯净干燥的CO2
饱和NaHCO3溶液
浓硫酸
D
锌和稀盐酸制取并收集纯净干燥的H2
水
浓硫酸
A、A B、B C、C D、D7. 研究表明,大气中氮氧化物和碳氢化合物受紫外线作用可产生二次污染物一光化学烟雾,其中某些反应过程如图所示,下列说法错误的是( )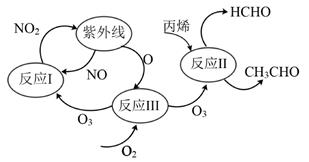 A、紫外线作用下,NO2中有氮氧键发生断裂 B、反应I的的方程式是2NO+O2=2NO2 C、反应II中丙烯是还原剂 D、经反应III,O2转化为了O38. 铁、氮气、丙酮和乙醇可参与制备铁氮化合物(FexNy),以下说法错误的是( )A、Fe元素位于元素周期表的第VIIIB族 B、丙酮中碳原子采用sp2和sp3杂化 C、1个N2分子中有1个σ键和2个π键 D、乙醇的沸点高于丙烷,是因为乙醇分子间存在氢键9. 向铁粉中加入过量稀硫酸,可制备得到硫酸亚铁溶液,下列用来解释事实的方程式中合理的是( )A、制备原理:Fe+2H++SO =FeSO4+H2↑ B、得到的溶液显酸性的主要原因:H2SO4=2H++SO C、得到的溶液在空气中变质:4Fe2++8OH-+O2+2H2O=4Fe(OH)3 D、向制备得到的溶液中滴加氢氧化钠溶液只发生反应:Fe2++2OH-=Fe(OH)2↓10. 钛酸钙是典型的钙钛矿型化合物,该类化合物具有特殊的理化性质,比如吸光性、电催化性等,其晶体结构如图所示。下列说法正确的是( )
A、紫外线作用下,NO2中有氮氧键发生断裂 B、反应I的的方程式是2NO+O2=2NO2 C、反应II中丙烯是还原剂 D、经反应III,O2转化为了O38. 铁、氮气、丙酮和乙醇可参与制备铁氮化合物(FexNy),以下说法错误的是( )A、Fe元素位于元素周期表的第VIIIB族 B、丙酮中碳原子采用sp2和sp3杂化 C、1个N2分子中有1个σ键和2个π键 D、乙醇的沸点高于丙烷,是因为乙醇分子间存在氢键9. 向铁粉中加入过量稀硫酸,可制备得到硫酸亚铁溶液,下列用来解释事实的方程式中合理的是( )A、制备原理:Fe+2H++SO =FeSO4+H2↑ B、得到的溶液显酸性的主要原因:H2SO4=2H++SO C、得到的溶液在空气中变质:4Fe2++8OH-+O2+2H2O=4Fe(OH)3 D、向制备得到的溶液中滴加氢氧化钠溶液只发生反应:Fe2++2OH-=Fe(OH)2↓10. 钛酸钙是典型的钙钛矿型化合物,该类化合物具有特殊的理化性质,比如吸光性、电催化性等,其晶体结构如图所示。下列说法正确的是( ) A、钛酸钙的化学式为CaTiO2 B、晶胞中与每个Ti4+距离最近且相等的O2-有6个 C、基态钛原子价电子排布式是4s23d2 D、基态Ca2+的核外电子排布式为1s22s2sp63s23p64s211. 直接排放含SO2的烟气会形成酸雨,用Na2SO3作为吸收液可吸收SO2 , 且吸收液可通过电解再生。室温条件下,吸收液吸收SO2的过程中,pH随n(SO ):n(HSO )变化关系如表;当吸收液pH降至约为6时,需送至电解槽再生,再生示意图如图,下列说法错误的是( )
A、钛酸钙的化学式为CaTiO2 B、晶胞中与每个Ti4+距离最近且相等的O2-有6个 C、基态钛原子价电子排布式是4s23d2 D、基态Ca2+的核外电子排布式为1s22s2sp63s23p64s211. 直接排放含SO2的烟气会形成酸雨,用Na2SO3作为吸收液可吸收SO2 , 且吸收液可通过电解再生。室温条件下,吸收液吸收SO2的过程中,pH随n(SO ):n(HSO )变化关系如表;当吸收液pH降至约为6时,需送至电解槽再生,再生示意图如图,下列说法错误的是( )n(SO ):n(HSO )
91:9
1:1
9:91
pH
8.2
7.2
6.2
 A、由表中信息可推测,Na2SO3溶液显碱性,NaHSO3溶液显酸性 B、吸收过程中离子浓度关系总有c(Na+)+c(H+)=2c(SO )+c(HSO )+c(OH-) C、电解槽右侧电极发生的反应主要是SO -2e-+H2O=SO +2H+ D、电解槽左侧电极发生的反应有2HSO +2e-=H2↑+2SO ,实现再生12. 常温下,向20mL0.2mol/LH2X溶液中滴加0.2mol/LNaOH溶液,溶液中各微粒的物质的量分数随pH的变化如图所示,以下说法错误的是( )
A、由表中信息可推测,Na2SO3溶液显碱性,NaHSO3溶液显酸性 B、吸收过程中离子浓度关系总有c(Na+)+c(H+)=2c(SO )+c(HSO )+c(OH-) C、电解槽右侧电极发生的反应主要是SO -2e-+H2O=SO +2H+ D、电解槽左侧电极发生的反应有2HSO +2e-=H2↑+2SO ,实现再生12. 常温下,向20mL0.2mol/LH2X溶液中滴加0.2mol/LNaOH溶液,溶液中各微粒的物质的量分数随pH的变化如图所示,以下说法错误的是( ) A、由图可推测,H2X为弱酸 B、滴加过程中发生的反应有:H2X+OH-=HX-+H2O,HX-+OH-=X2-+H2O C、水的电离程度:a点与b点大致相等 D、若常温下Ka(HY)=1.1×10-2 , HY与少量Na2X发生的反应是:2HY+X2-=H2X+2Y-13. 如图为DNA分子的局部结构示意图,下列说法错误的是( )
A、由图可推测,H2X为弱酸 B、滴加过程中发生的反应有:H2X+OH-=HX-+H2O,HX-+OH-=X2-+H2O C、水的电离程度:a点与b点大致相等 D、若常温下Ka(HY)=1.1×10-2 , HY与少量Na2X发生的反应是:2HY+X2-=H2X+2Y-13. 如图为DNA分子的局部结构示意图,下列说法错误的是( )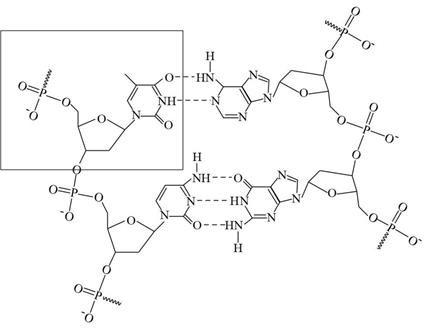 A、DNA由多个脱氧核糖核苷酸分子间脱水形成磷酯键后聚合而成的脱氧核糖核苷酸链构成 B、图中框内的结构可以看成是由脱氧核糖分子与H3PO4分子、碱基分子通过分子间脱水连接而成的 C、胸腺嘧啶(
A、DNA由多个脱氧核糖核苷酸分子间脱水形成磷酯键后聚合而成的脱氧核糖核苷酸链构成 B、图中框内的结构可以看成是由脱氧核糖分子与H3PO4分子、碱基分子通过分子间脱水连接而成的 C、胸腺嘧啶(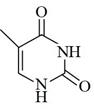 )中含有酰胺基官能团
D、DNA分子的四种碱基均含N—H键,一个碱基中的N—H键的H原子只能与另一个碱基中的N原子形成氢键
14. 研究“2Fe3++2I- 2Fe2++I2”反应中Fe3+和Fe2+的相互转化。实验如图:
)中含有酰胺基官能团
D、DNA分子的四种碱基均含N—H键,一个碱基中的N—H键的H原子只能与另一个碱基中的N原子形成氢键
14. 研究“2Fe3++2I- 2Fe2++I2”反应中Fe3+和Fe2+的相互转化。实验如图:
下列说法错误的是( )
A、i中生成黄色沉淀的反应是:Ag++I-=AgI↓ B、可依据i中现象推测,实验I中的棕黄色主要是I2引起的 C、对照实验ii、iii,可推测ii中增大c(Fe2+),导致Fe2+还原性大于I- , 平衡向左移动 D、还原性:实验i中I->Fe2+ , 实验ii中I-<Fe2+ , 体现了离子浓度对物质还原性的影响二、综合题
-
15. 聚酰亚胺是一种高性能特种工程材料,已广泛应用在航天航空、有机光电等领域。一条制备某聚酰亚胺(Q)的路线如图:

Q的结构简式:

已知:
 R1COOH+R2COOH(1)、A的结构简式是。(2)、B中的含氧官能团的名称是。(3)、C→D的反应类型是。(4)、关于G的说法正确的是。
R1COOH+R2COOH(1)、A的结构简式是。(2)、B中的含氧官能团的名称是。(3)、C→D的反应类型是。(4)、关于G的说法正确的是。a.核磁共振氢谱显示有4种不同化学环境的H原子
b.不存在含有1个苯环及3个醛基的同分异构体
c.分子中所有原子共平面
(5)、N的结构简式是。(6)、制备1molQ,消耗K和P的物质的量之比是 , 同时产生mol小分子物质。16. 螯合树脂吸附法处理废水具有吸附容量大、速度快以及选择性好等特点,已成为近年来的研究热点。螯合树脂M与Cu2+形成新的螯合物Q,从而达到去除Cu2+的效果,吸附机理如图所示。
资料:
①吸附原理
螯合树脂M中的-COOH解离出H+ , 变成-COO- , 而且树脂中含有N原子,在与Cu2+接触时,树脂中的-COO-、N原子与Cu2+形成配位键,形成新的螯合物Q,从而达到去除Cu2+的目的。
②在体系酸性较强情况下,氮原子与氢离子具有较强的配位能力。
(1)、M中四种元素电负性由大到小的顺序为(用元素符号表示)。(2)、M中N原子的杂化轨道类型为。(3)、Q中存在配位键,其中提供空轨道的是。(4)、在螯合树脂M处理含铜废水过程中,发现体系pH对Cu2+的吸附量有影响,实验结果如图所示。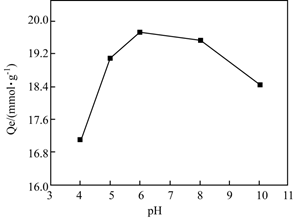
①吸附去除Cu2+的过程中需保持体系处于适宜的pH,其中pH约为时吸附效果最好。
②解释体系碱性过强时,吸附能力下降的原因。
③从结构角度解释:体系酸性较强时,吸附能力下降的原因。
17. 镀镍生产过程中产生的酸性硫酸镍废液(含有Fe2+、Zn2+、Mg2+、Ca2+等杂质离子),通过精制提纯可制备高纯硫酸镍,部分流程如图:
资料1:25℃时,生成氢氧化物沉淀的pH
Fe(OH)2
Fe(OH)3
Zn(OH)2
Mg(OH)2
Ca(OH)2
Ni(OH)2
开始沉淀时
6.3
1.5
6.2
9.1
11.8
6.9
完全沉淀时
8.3
2.8
8.2
11.1
13.8
8.9
注:金属离子的起始浓度为0.1mol/L.
资料2:25℃时,Ksp(CaF2)=4×10-11 , Ksp(MgF2)=9×10-9 , ZnF2易溶于水。
资料3:P204(二乙基己基磷酸)萃取金属离子的反应为:x
 +Mx+
+Mx+  M+xH+(1)、操作1、2的名称是 , 操作3的名称是。(2)、操作1中加入Cl2的主要目的是。(3)、NiF2溶液参与反应的离子方程式是。杂质离子沉淀完全时,溶液中c(F-)=mol/L(c(杂质离子)≤10-5mol/L即可视为沉淀完全)。(4)、滤液b中含有的微粒主要有。(5)、在硫酸盐溶液中,P204对某些金属离子的萃取率与pH关系如图所示,在一定范围内,随着pH升高,萃取率升高的原因是。
M+xH+(1)、操作1、2的名称是 , 操作3的名称是。(2)、操作1中加入Cl2的主要目的是。(3)、NiF2溶液参与反应的离子方程式是。杂质离子沉淀完全时,溶液中c(F-)=mol/L(c(杂质离子)≤10-5mol/L即可视为沉淀完全)。(4)、滤液b中含有的微粒主要有。(5)、在硫酸盐溶液中,P204对某些金属离子的萃取率与pH关系如图所示,在一定范围内,随着pH升高,萃取率升高的原因是。 (6)、在母液中加入其它物质,可制备操作1中所需Ni(OH)2浆液,写出制备的离子方程式。18. 在双碳目标驱动下,大批量氢燃料客车在2022年北京冬奥会上投入使用。稳定氢源的获取是科学研究热点,对以下2种氢源获取方法进行讨论。(1)、Ⅰ.甲醇蒸汽重整制氢
(6)、在母液中加入其它物质,可制备操作1中所需Ni(OH)2浆液,写出制备的离子方程式。18. 在双碳目标驱动下,大批量氢燃料客车在2022年北京冬奥会上投入使用。稳定氢源的获取是科学研究热点,对以下2种氢源获取方法进行讨论。(1)、Ⅰ.甲醇蒸汽重整制氢甲醇蒸汽重整制氢过程中有以下化学反应。
编号
反应
方程式
△H/kJ·mol-1
R1
甲醇蒸汽重整
CH3OH(g)+H2O(g) CO2(g)+3H2(g)
△H1=+49.24
R2
甲醇分解反应
CH3OH(g) CO(g)+2H2(g)
△H2
R3
水汽反应
CO(g)+H2O(g) CO2(g)+H2(g)
△H3=-41.17
R4
积碳反应
CO(g)+H2(g) C(s)+H2O(g)
△H<0
CO2(g)+2H2(g) C(s)+2H2O(g)
△H<0
2CO(g) C(s)+CO2(g)
△H<0
资料:产氢率和水碳比(S/C)的定义:
①产氢率=
②水碳比(S/C)表示反应物中H2O和CH3OH的比值,水碳比的变化是以CH3OH不变,改变H2O的物质的量加以控制。
理想产氢率=。
(2)、△H2=kJ·mol-1(3)、针对R1进行讨论:其他条件不变,随着温度升高,n(H2)(填“增大”、“减小”或“不变”),理由是。(4)、其他条件不变,测得产物摩尔分数(即物质的量分数)随温度的变化如图所示。由图可知,在600-912K时,随着温度升高,氢气的摩尔分数增大,原因是。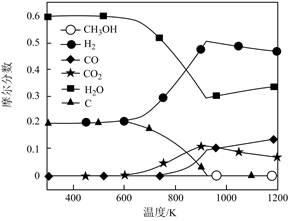 (5)、结合资料和图示,提出2条减少积碳的措施、。(6)、Ⅱ.电解液氨制氢
(5)、结合资料和图示,提出2条减少积碳的措施、。(6)、Ⅱ.电解液氨制氢氨分子中具有较高的含氢量,因此是制氢的优选原料。使用NaNH2非水电解质研究液氨电解制氢原理,装置示意图如图所示。
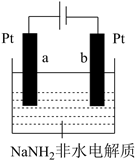
资料:2NH3 NH +NH
①某电极上发生的电极反应为6NH3+6e-=3H2↑+6NH ,该电极为(选填a或b)极。
②写出另一极上发生的电极反应。
③不考虑其它能量损耗,利用该装置产生1mol氢气时,转移电子的物质的量是mol。
19. 某小组同学探究漂白精片(主要有效成分:次氯酸钙)与氯化铜反应产物,操作及现象如表:序号
操作
现象
实验I
取研磨成粉状的漂白精片10g和少量氯化铜固体放入烧杯中,加足量水搅拌
产生黑色悬浊液,同时有大量气泡产生
(1)、甲同学预测气泡主要为Cl2 , 乙同学不认同甲的观点,理由如表:理由
对应的离子方程式
ClO-与Cl-需在酸性条件下反应生成Cl2
①
Ca(ClO)2溶液显碱性
②
写出离子方程式:① , ②。
(2)、猜测气泡可能为O2 , 并通过实验证实了猜测,实验操作及现象是。(3)、对悬浊液成分进行探究。①预测悬浊液成分为CuO,进行如图操作。
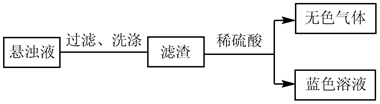
经验证无色气体为O2 , 蓝色溶液为CuSO4。此时可推断悬浊液中(选填序号)CuO。
a.一定有 b.可能有 c.一定没有
②查阅资料,悬浊液中有高铜酸钙:Ca(CuO2)2 , 实验I中主要发生了以下反应:
i。(写出该反应的离子方程式)
ii.i中生成的Ca(CuO2)2部分分解:2Ca(CuO2)2=2CaCuO2+2CuO+O2↑
(4)、查阅资料:某些低价金属化合物在碱性条件下能被某些强氧化剂氧化为高价酸根离子。小组同学设计如图流程制备高铁酸钾:FeCl2溶液 溶液C K2FeO4溶液
写出第一步反应的离子方程式。