安徽省蚌埠市2022届高三第四次教学质量检测理综化学试题
试卷更新日期:2022-05-23 类型:高考模拟
一、单选题
-
1. 中华优秀传统文化涉及了很多化学知识,下列说法正确的是( )A、“弄风柳絮疑城雪,满地榆钱买得春”中的“柳絮”和棉花的主要成分均为蛋白质 B、“煮豆持作羹,漉之以为汁”中的“漉”,涉及的实验基本操作是过滤 C、《新修草本》有关“青矾”的描述为“本来绿色,新出窟未见风者,正如琉璃,烧之赤色”,据此推测“青矾”的主要成分为Fe2(SO4)3·7H2O D、《本草纲目拾遗》中对“强水”的记载:“性最猛烈,能蚀五金。”“强水”为强电解质2. 实验室制取下列气体,所选反应试剂、制备装置与收集方法合理的是( )

选项
气体
反应试剂
制备装置
收集方法
A
NH3
Ca(OH)2、NH4Cl
a
e
B
Cl2
MnO2、浓盐酸
c
d
C
NO
Cu、浓硝酸
c
d
D
SO2
Na2SO3、70%硫酸
b
f
A、A B、B C、C D、D3. 已知X、Y、Z、W是原子序数依次增大的前20号主族元素,X与W、Y与Z分别同主族,W、Z的简单离子核外电子排布相同,X、Y、Z、W元素组成的某化合物的结构如图。下列说法正确的是( ) A、简单离子的半径:W>Z>Y>X B、简单氢化物的还原性:Y>Z C、化合物M中Y的化合价均为-2 D、WX可与H2O反应生成X的单质4. 某有机化合物M是一种药物的合成中间体,其结构简式如图。下列有关该有机化合物的说法错误的是( )
A、简单离子的半径:W>Z>Y>X B、简单氢化物的还原性:Y>Z C、化合物M中Y的化合价均为-2 D、WX可与H2O反应生成X的单质4. 某有机化合物M是一种药物的合成中间体,其结构简式如图。下列有关该有机化合物的说法错误的是( ) A、化学物M的分子式为C18H22O3 B、化合物M中含有二种含氧官能团 C、每个M分子中最多有10个碳原子处于同一平面 D、该有机物能发生加成反应、取代反应和水解反应5. CO与N2O在铁催化剂表面进行如下两步反应:
A、化学物M的分子式为C18H22O3 B、化合物M中含有二种含氧官能团 C、每个M分子中最多有10个碳原子处于同一平面 D、该有机物能发生加成反应、取代反应和水解反应5. CO与N2O在铁催化剂表面进行如下两步反应:第一步:Fe*+N2O=FeO*+N2
第二步:FeO*+CO=Fe*+CO2
其相对能量与反应历程如下图所示,下列说法错误的是( )
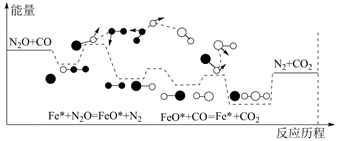 A、总反应是放热反应,化学方程式为CO+N2O CO2+N2 B、在反应过程中,有极性键和非极性键的断裂和生成 C、总反应的反应速率由第一步反应决定 D、Fe*为反应的催化剂,FeO*为中间产物6. 研究发现,在酸性乙醇燃料电池中加入硝酸,可使电池持续大电流放电,其工作原理如图所示。下列说法正确的是( )
A、总反应是放热反应,化学方程式为CO+N2O CO2+N2 B、在反应过程中,有极性键和非极性键的断裂和生成 C、总反应的反应速率由第一步反应决定 D、Fe*为反应的催化剂,FeO*为中间产物6. 研究发现,在酸性乙醇燃料电池中加入硝酸,可使电池持续大电流放电,其工作原理如图所示。下列说法正确的是( )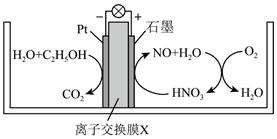 A、离子交换膜X为质子交换膜,质子从石墨电极移向Pt电极 B、C2H5OH在Pt电极发生还原反应 C、正极区反应为4 +12e-+16H+=4NO+8H2O、4NO+3O2+2H2O=4HNO3 D、若Pt电极生成2.24LCO2 , 电路中转移电子数为0.6NA7. 用强碱滴定某一元弱酸时,弱酸被强碱部分中和后可得到“弱酸和弱酸盐”组成的缓冲溶液,缓冲溶液的pH=pKm-lg (计算时忽略酸的电离和盐的水解)。常温下,用0.1mol·L-1的NaOH溶液滴定16.00mL某未知浓度的HX溶液,滴定过程中消耗NaOH溶液的体积与混合溶液pH之间的关系如图(已知:pKm=-lgKm , 100.48≈3.0)。下列说法正确的是( )
A、离子交换膜X为质子交换膜,质子从石墨电极移向Pt电极 B、C2H5OH在Pt电极发生还原反应 C、正极区反应为4 +12e-+16H+=4NO+8H2O、4NO+3O2+2H2O=4HNO3 D、若Pt电极生成2.24LCO2 , 电路中转移电子数为0.6NA7. 用强碱滴定某一元弱酸时,弱酸被强碱部分中和后可得到“弱酸和弱酸盐”组成的缓冲溶液,缓冲溶液的pH=pKm-lg (计算时忽略酸的电离和盐的水解)。常温下,用0.1mol·L-1的NaOH溶液滴定16.00mL某未知浓度的HX溶液,滴定过程中消耗NaOH溶液的体积与混合溶液pH之间的关系如图(已知:pKm=-lgKm , 100.48≈3.0)。下列说法正确的是( ) A、滴定前HX溶液的浓度约为0.3mol·L-1 B、HX的电离常数Ka=10-3.79 C、n点溶液中存在c(X-)+2c(OH-)=c(HX)+2c(H+) D、q点液中离子浓度的大小关系为c(Na+)>c(X-)
A、滴定前HX溶液的浓度约为0.3mol·L-1 B、HX的电离常数Ka=10-3.79 C、n点溶液中存在c(X-)+2c(OH-)=c(HX)+2c(H+) D、q点液中离子浓度的大小关系为c(Na+)>c(X-)二、综合题
-
8. 钪是一种稀土金属元素,在国防、航天、核能等领域具有重要应用。氯化钪(ScCl3)是一种可溶于水的灰白色固体,是制备钪的重要原料。工业上利用固体废料“赤泥”(含有Fe2O3、SiO2、Sc2O3、TiO2等)制取ScCl3 , 请结合流程回答以下问题:

已知:①TiO2难溶于盐酸。
②Ksp[Sc(OH)3]=1.0×10-30 , Ksp[Fe(OH)3]=1.0×10-38
(1)、滤渣1的主要成分是(填化学式)。(2)、“酸浸”时温度过高,酸浸速率反而减慢,其原因是。(3)、常温下,“调pH”时,溶液中c(Sc3+)=0.001mol·L-1 , 为除去杂质离子,应控制的pH范围是(当溶液中某离子浓度c≤1.0 10-5mol·L-1时,可认为该离子沉淀完全)。(4)、已知Ka1(H2C2O4)=a,Ka2(H2C2O4)=b,Ksp[Sc2(C2O4)3]=c。“沉钪”时,发生反应:2Sc3++3H2C2O4=Sc2(C2O4)3+6H+ , 此反应的平衡常数K=(用含a、b、c的代数式表示)。(5)、“加热氯化”过程中排出的气体主要有(填化学式)。(6)、传统制备ScCl3的方法是先得到ScCl3·6H2O沉淀,再高温脱水得ScCl3 , 但通常含有ScOCl杂质,原因是。(7)、草酸钪晶体[Sc2(C2O4)3·6H2O]在空气中加热, 随温度的变化情况如下图所示。250℃时,晶体的主要成分是(填化学式),550~850℃,反应的化学方程式为。(已知Sc2(C2O4)3·6H2O的摩尔质量为462g·mol-1) 9. 三硫代碳酸钠(Na2CS3)在农业上用作杀菌剂和杀线虫剂,在工业上用于处理废水中的重金属离子。某化学兴趣小组对Na2CS3的一些性质进行探究,回答下列问题。查阅资料:①Na2CS3+H2SO4=CS2+H2S↑+Na2SO4 , CS2和H2S均有毒;②CS2不溶于水,沸点46℃,与CO2某些性质相似,与NaOH作用生成Na2COS2和H2O。(1)、I.Na2CS3的性质探究
9. 三硫代碳酸钠(Na2CS3)在农业上用作杀菌剂和杀线虫剂,在工业上用于处理废水中的重金属离子。某化学兴趣小组对Na2CS3的一些性质进行探究,回答下列问题。查阅资料:①Na2CS3+H2SO4=CS2+H2S↑+Na2SO4 , CS2和H2S均有毒;②CS2不溶于水,沸点46℃,与CO2某些性质相似,与NaOH作用生成Na2COS2和H2O。(1)、I.Na2CS3的性质探究步骤
操作及现象
①
取少量Na2CS3固体溶于蒸馏水配制成溶液并分成两等份
②
向其中一份溶液中滴加几滴酚酞试液,溶液变红色
③
向另一份溶液中滴加H2SO4酸化的KMnO4溶液,紫色褪去
H2CS3是酸(填“强”或“弱”)。
(2)、已知步骤③的氧化产物是 ,写出该反应的离子方程式。某同学取步骤③反应后所得溶液于试管中,滴加足量盐酸和氯化钡溶液,通过测定产生的白色沉淀的质量来求所用Na2CS3质量,你是否同意他的观点,并说明理由。(3)、II.测定Na2CS3溶液的浓度实验步骤如下:
①取50.0mLNa2CS3溶液置于仪器M中,打开K,通入一段时间氮气;
②关闭K,打开分液漏斗活塞,滴入足量2.0mol·L-1稀H2SO4 , 关闭活塞;
③反应结束后,再打开K,通入一段时间的热氮气(高于60℃)。

仪器M的名称是
(4)、上述装置按气流方向连接合理的顺序为a.ADCEB b.ACBED c.AEBCD
(5)、步骤③中通N2的目的是。(6)、为了计算该Na2CS3溶液的浓度,可测定C中生成沉淀的质量。对C中混合物进行过滤、洗涤、干燥、称重。若C中生成沉淀的质量为7.2g,则该Na2CS3溶液的物质的量浓度是。也可以通过测定E中溶液质量的增加值来计算Na2CS3溶液的浓度,若缺少装置D,计算值会(填“无影响”、“偏高”或“偏低”)。10. 二氧化碳加氢可转化为二甲醚(CH3OCH3),既可以降低二氧化碳排放量,也可以得到性能优良的燃料,是实现碳中和的有效手段之一、回答下列问题:(1)、已知:①CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H1=-49.0kJ∙mol-1②2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ∆H2=-23.5kJ∙mol-1
用二氧化碳和氢气反应制取二甲醚的热化学方程式为。
(2)、一定条件下,向体积为2L的恒容闭容器中通入2molCO2和6molH2发生上述反应。①下列有关叙述正确的是(填字母序号)。
a.容器内气体密度不再发生改变,说明反应达化学平衡状态
b.使用合适的催化剂可以提高单位时间内CH3OCH3的产率
c.反应达化学平衡后,向容器内通入少量氦气,则平衡向正反应方向移动
d.反应达平衡状态后向容器内再通入1molCO2和3molH2 , 重新达平衡后CH3OCH3体积分数增大
②升高温度,二甲醚的平衡产率(填“增大”、“减小”或“不变”),原因是。
③CO2与H2混合气体以一定的比例和一定流速分别通过填充有催化剂I和催化剂II的反应器,CO2转化率与温度的关系如图。a点的CO2转化率(填“是”或“不是”)平衡转化率,在催化剂I作用下,温度高于T1时,CO2转化率下降的原因可能是
 (3)、将组成(物质的量分数)为20%CO2(g)、60%H2(g)和20%N2(g)(N2不参与反应)的气体通入反应器,在一定温度和p=2.0MPa的条件下发生反应CO2(g)+3H2(g)→CH3OH(g)+H2O(g)。平衡时,若CO2(g)转化率为50%,则H2O(g)的分压为MPa,反应的平衡常数Kp=(MPa)-2(保留两位有效数字,用平衡分压代替平衡浓度计算,分压=总压x物质的量分数)。11. 氮元素是地球上含量丰富的一种元素,不仅是制造农药、医药的重要元素,也是构成蛋白质的重要元素。根据所学知识回答以下问题。(1)、基态N原子的成对电子数与未成对电子数之比为 , 离子的空间构型为(2)、N-甲基咪唑(
(3)、将组成(物质的量分数)为20%CO2(g)、60%H2(g)和20%N2(g)(N2不参与反应)的气体通入反应器,在一定温度和p=2.0MPa的条件下发生反应CO2(g)+3H2(g)→CH3OH(g)+H2O(g)。平衡时,若CO2(g)转化率为50%,则H2O(g)的分压为MPa,反应的平衡常数Kp=(MPa)-2(保留两位有效数字,用平衡分压代替平衡浓度计算,分压=总压x物质的量分数)。11. 氮元素是地球上含量丰富的一种元素,不仅是制造农药、医药的重要元素,也是构成蛋白质的重要元素。根据所学知识回答以下问题。(1)、基态N原子的成对电子数与未成对电子数之比为 , 离子的空间构型为(2)、N-甲基咪唑( )是一种有机化合物,可作为有机合成中间体和树脂固化N剂,其中碳原子杂化方式为 , 所含元素第一电离能由大到小的顺序是 , 0.1molN-甲基咪唑中含σ键的数目为NA。 (3)、N-甲基咪唑的某种衍生物与甘氨酸形成的离子化合物
)是一种有机化合物,可作为有机合成中间体和树脂固化N剂,其中碳原子杂化方式为 , 所含元素第一电离能由大到小的顺序是 , 0.1molN-甲基咪唑中含σ键的数目为NA。 (3)、N-甲基咪唑的某种衍生物与甘氨酸形成的离子化合物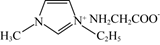 ,常温下为液态而非固态,原因是。 (4)、TiO2-aNb是常见的光学活性物质,由TiO2通过氮掺杂反应生成,表示如下图。
,常温下为液态而非固态,原因是。 (4)、TiO2-aNb是常见的光学活性物质,由TiO2通过氮掺杂反应生成,表示如下图。
①立方晶系TiO2晶胞参数如图甲所示,其晶体的密度为g·cm-3(写计算式, NA代表阿伏加德罗常数)。
②图乙TiO2-aNb晶体中a:b=。
12. 依普黄酮是一种抗骨质疏松药物的主要成分。以甲苯为料合成依普黄酮时生成中间体F的路线如下。
已知:RCOOH+
 +H2O
+H2O请回答下列问题:
(1)、A→B反应的条件是 , B→C反应的类型为。(2)、化合物X的结构简式为 , 习惯命名法的名称为。(3)、化合物E中含氧官能团名称为 , 写出E与足量NaOH溶液反应的化学方程式。(4)、化合物D的同分异构体中,同对满足下列条件的同分异构体的数目为。①芳香族化合物 ②可与金属Na反应产生氢气 ③能与银氨溶液发生银镜反应。
(5)、参照上述合成路线,以苯酚和苯乙烯为原料,设计制备 的合成路线(无机试剂任选)。
的合成路线(无机试剂任选)。