四川省成都市蓉城高中联盟2021-2022学年高一下学期期中考试化学试题
试卷更新日期:2022-05-19 类型:期中考试
一、单选题
-
1. “碳中和”是指排出的二氧化碳或温室气体被植树造林、节能减排等形式抵消,达到相对“零排放”。下列有关说法正确的是( )A、 分子的电子式为
 B、 分子中既含有极性键又含有非极性键
C、碳吸收和碳排放过程中没有化学键的断裂与形成
D、通过投资开发可再生能源和低碳清洁技术能有效降低碳排放
2. “玉兔”号月球车用 (钚)作为热源材料。下列说法正确的是( )A、 的电子数为238 B、 的中子数与质子数之差为94 C、 与 互为同位素 D、 与 互为同素异形体3. 下列元素属于短周期主族元素的是( )A、K B、Ne C、Br D、Be4. 质量数为14的原子,可能有( )A、7个质子,7个中子,7个电子 B、6个质子,8个中子,8个电子 C、7个质子,7个中子,14个电子 D、6个质子,14个中子,6个电子5. 某短周期元素X的简单气态氢化物的化学式为 ,则X的最高价氧化物对应的水化物的化学式为( )A、 B、HXO C、 D、 或6. 下列有关氢化物的叙述正确的是( )A、稳定性: B、还原性: C、LiH中阴阳离子半径:阳离子>阴离子 D、HF的电子式:
B、 分子中既含有极性键又含有非极性键
C、碳吸收和碳排放过程中没有化学键的断裂与形成
D、通过投资开发可再生能源和低碳清洁技术能有效降低碳排放
2. “玉兔”号月球车用 (钚)作为热源材料。下列说法正确的是( )A、 的电子数为238 B、 的中子数与质子数之差为94 C、 与 互为同位素 D、 与 互为同素异形体3. 下列元素属于短周期主族元素的是( )A、K B、Ne C、Br D、Be4. 质量数为14的原子,可能有( )A、7个质子,7个中子,7个电子 B、6个质子,8个中子,8个电子 C、7个质子,7个中子,14个电子 D、6个质子,14个中子,6个电子5. 某短周期元素X的简单气态氢化物的化学式为 ,则X的最高价氧化物对应的水化物的化学式为( )A、 B、HXO C、 D、 或6. 下列有关氢化物的叙述正确的是( )A、稳定性: B、还原性: C、LiH中阴阳离子半径:阳离子>阴离子 D、HF的电子式: 7. 下列各图是元素周期表的一部分(表中数字代表原子序数),其中合理的是( )A、
7. 下列各图是元素周期表的一部分(表中数字代表原子序数),其中合理的是( )A、 B、
B、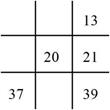 C、
C、 D、
D、 8. 元素符号、反应方程式、结构示意图、电子式以及结构式统称为化学用语。下列有关化学用语的表示方法错误的是( )A、质子数为17,中子数为20,电子数为18的微粒符号: B、乙烯分子的结构简式: C、 的结构示意图:
8. 元素符号、反应方程式、结构示意图、电子式以及结构式统称为化学用语。下列有关化学用语的表示方法错误的是( )A、质子数为17,中子数为20,电子数为18的微粒符号: B、乙烯分子的结构简式: C、 的结构示意图: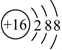 D、次氯酸的电子式:
D、次氯酸的电子式:  9. 下列关于锶(Sr)的叙述错误的是( )A、氢氧化锶是弱碱 B、Sr位于第ⅡA族 C、金属性: D、硫酸锶既含有离子键又含有极性共价键10. 下列实验中,不能观察到明显变化的是( )A、将一块绿豆大小的钾投入到盛有水的烧杯中 B、将少量溴水加入到盛有KI溶液的试管中,振荡,加入 ,振荡、静置 C、取一小段镁带,用砂纸除去表面的氧化膜,放入冷水中 D、将乙烯通入酸性高锰酸钾溶液中11. 某有机物的结构简式为
9. 下列关于锶(Sr)的叙述错误的是( )A、氢氧化锶是弱碱 B、Sr位于第ⅡA族 C、金属性: D、硫酸锶既含有离子键又含有极性共价键10. 下列实验中,不能观察到明显变化的是( )A、将一块绿豆大小的钾投入到盛有水的烧杯中 B、将少量溴水加入到盛有KI溶液的试管中,振荡,加入 ,振荡、静置 C、取一小段镁带,用砂纸除去表面的氧化膜,放入冷水中 D、将乙烯通入酸性高锰酸钾溶液中11. 某有机物的结构简式为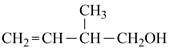 ,下列关于该有机物的叙述错误的是( ) A、能与乙酸在一定条件下发生酯化反应 B、在一定条件下能发生还原反应、氧化反应 C、不能使溴的四氯化碳溶液褪色 D、含有两种官能团12. 下列有关性质的比较,错误的是( )A、金属性: B、碱性: C、酸性: D、沸点:13. Y、Z、U、W为四种短周期非金属元素,它们的原子半径与原子序数的关系如图所示,其中U的单质是人类将太阳能转化为电能的常用材料。下列有关说法错误的是( )
,下列关于该有机物的叙述错误的是( ) A、能与乙酸在一定条件下发生酯化反应 B、在一定条件下能发生还原反应、氧化反应 C、不能使溴的四氯化碳溶液褪色 D、含有两种官能团12. 下列有关性质的比较,错误的是( )A、金属性: B、碱性: C、酸性: D、沸点:13. Y、Z、U、W为四种短周期非金属元素,它们的原子半径与原子序数的关系如图所示,其中U的单质是人类将太阳能转化为电能的常用材料。下列有关说法错误的是( ) A、 可作自来水的消毒剂 B、U是一种亲氧元素 C、Y、Z的简单气态氢化物的稳定性:Y<Z D、Y的氧化物对应的水化物一定是强酸14. 如图为从元素周期表截取的短周期主族元素的一部分,Y是所在周期中原子半径最小的元素。下列说法正确的是( )
A、 可作自来水的消毒剂 B、U是一种亲氧元素 C、Y、Z的简单气态氢化物的稳定性:Y<Z D、Y的氧化物对应的水化物一定是强酸14. 如图为从元素周期表截取的短周期主族元素的一部分,Y是所在周期中原子半径最小的元素。下列说法正确的是( ) A、Y的最高价氧化物对应的水化物酸性最强 B、X的一种氢化物具有强氧化性 C、W的最高价氧化物分子中所有原子的最外层都达到8电子稳定结构 D、简单离子的还原性:15. 和 是氯元素的两种核素, 表示阿伏加德罗常数。下列说法正确的是( )A、氯的相对原子质量为: B、 和 的核外电子排布方式相同 C、7.4g 含有的电子数为 D、标准状况下,11.2L 和 组成的气体含有 个分子16. 下列除去杂质的试剂及其方法正确的是(括号内为杂质)( )
A、Y的最高价氧化物对应的水化物酸性最强 B、X的一种氢化物具有强氧化性 C、W的最高价氧化物分子中所有原子的最外层都达到8电子稳定结构 D、简单离子的还原性:15. 和 是氯元素的两种核素, 表示阿伏加德罗常数。下列说法正确的是( )A、氯的相对原子质量为: B、 和 的核外电子排布方式相同 C、7.4g 含有的电子数为 D、标准状况下,11.2L 和 组成的气体含有 个分子16. 下列除去杂质的试剂及其方法正确的是(括号内为杂质)( )选项
含杂质物质
除杂试剂
方法
A
乙烷(乙烯)
溴水;浓硫酸
洗气
B
品红溶液;NaOH溶液
洗气
C
乙酸乙酯(乙酸)
乙醇;浓硫酸
加热、分液
D
Fe(Cu)
稀硫酸
过滤、洗涤、干燥
A、A B、B C、C D、D17. 下列叙述正确的是( )A、含有碳元素的化合物一定是有机物 B、1,2−二溴乙烷属于烷烃 C、甲烷可以与溴水在一定条件下发生取代反应 D、二氯甲烷只有一种结构,说明甲烷分子是正四面体结构18. 下列有机物中,既能跟溴水发生加成反应,又能使酸性高锰酸钾溶液褪色的是( )A、 B、苯 C、 D、19. 下列关于苯乙烯( )的说法正确的是( ) A、分子式为 B、所有原子不可能在同一平面上 C、1mol苯乙烯最多可与1mol 发生加成反应 D、苯环上的一氯代物有3种20. 按照如图装置持续通入X气体或X蒸气,可以看到a处有红色物质生成,b处变蓝,c处得到液体(假设每个反应均完全)。下列说法错误的是( )
)的说法正确的是( ) A、分子式为 B、所有原子不可能在同一平面上 C、1mol苯乙烯最多可与1mol 发生加成反应 D、苯环上的一氯代物有3种20. 按照如图装置持续通入X气体或X蒸气,可以看到a处有红色物质生成,b处变蓝,c处得到液体(假设每个反应均完全)。下列说法错误的是( ) A、X可能为 B、盛放无水 固体的仪器是球形干燥管 C、硬质玻璃管中,X发生了氧化反应 D、X可能为21. 有以下5种物质:① ,② ,③ ,④ ,⑤ 。下列说法正确的是( )A、沸点高低;②>③>①>⑤>④ B、③的一溴代物有6种 C、①③④⑤互为同系物 D、②可由3种 的烯烃与 加成而得到22. 实验室用下图装置制取乙酸乙酯(使用的乙醇的结构简式为 ),下列有关说法正确的是( )
A、X可能为 B、盛放无水 固体的仪器是球形干燥管 C、硬质玻璃管中,X发生了氧化反应 D、X可能为21. 有以下5种物质:① ,② ,③ ,④ ,⑤ 。下列说法正确的是( )A、沸点高低;②>③>①>⑤>④ B、③的一溴代物有6种 C、①③④⑤互为同系物 D、②可由3种 的烯烃与 加成而得到22. 实验室用下图装置制取乙酸乙酯(使用的乙醇的结构简式为 ),下列有关说法正确的是( ) A、在甲试管中加入药品的顺序:3mL 、2mL浓硫酸和2mL B、乙试管中的饱和碳酸钠溶液可以换成氢氧化钠溶液 C、从乙试管中分离得到纯净干燥的乙酸乙酯的操作是:振荡、静置、分液 D、生成的乙酸乙酯的结构简式为
A、在甲试管中加入药品的顺序:3mL 、2mL浓硫酸和2mL B、乙试管中的饱和碳酸钠溶液可以换成氢氧化钠溶液 C、从乙试管中分离得到纯净干燥的乙酸乙酯的操作是:振荡、静置、分液 D、生成的乙酸乙酯的结构简式为二、综合题
-
23. 根据下图短周期主族元素的原子序数和化合价的关系推断元素种类,用化学符号回答下列问题:
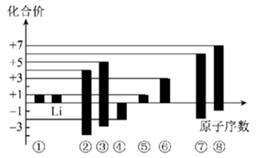 (1)、写出元素③的原子结构示意图;元素⑤在周期表中的位置是。(2)、④、⑥、⑦、⑧四种元素的简单离子的半径最大的是。(3)、元素②、⑦、⑧的最高价氧化物对应的水化物中酸性最强的是;元素⑦、⑧对应的简单氢化物中,稳定性较强的是 , 原因是。(4)、元素④、⑦的简单氢化物中沸点较高的是(写结构式)。(5)、由①和④两种元素组成原子个数比为1:1的化合物的电子式为;请用电子式表示由④和⑤两种元素组成原子个数比为1:2的化合物的形成过程:。(6)、元素⑤和⑥的最高价氧化物对应的水化物能相互反应,请写出该反应的离子方程式:;元素②的一种链状气态氢化物为18电子分子,请写出其结构简式:。24. 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。(1)、I.甲、乙两同学根据实验室提供的下列试剂,设计了两个原理不同的简单实验,请补充完整相应的实验方案,证明镁元素的金属性比铝元素强。
(1)、写出元素③的原子结构示意图;元素⑤在周期表中的位置是。(2)、④、⑥、⑦、⑧四种元素的简单离子的半径最大的是。(3)、元素②、⑦、⑧的最高价氧化物对应的水化物中酸性最强的是;元素⑦、⑧对应的简单氢化物中,稳定性较强的是 , 原因是。(4)、元素④、⑦的简单氢化物中沸点较高的是(写结构式)。(5)、由①和④两种元素组成原子个数比为1:1的化合物的电子式为;请用电子式表示由④和⑤两种元素组成原子个数比为1:2的化合物的形成过程:。(6)、元素⑤和⑥的最高价氧化物对应的水化物能相互反应,请写出该反应的离子方程式:;元素②的一种链状气态氢化物为18电子分子,请写出其结构简式:。24. 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。(1)、I.甲、乙两同学根据实验室提供的下列试剂,设计了两个原理不同的简单实验,请补充完整相应的实验方案,证明镁元素的金属性比铝元素强。试剂:镁条(已除去表面的氧化膜)、铝条(已除去表面的氧化膜)、氯化铝溶液、氯化镁溶液、稀盐酸、氢氧化钠溶液。
方案一:甲同学选用镁条、铝条和盐酸溶液,选择依据是;甲同学设计的方案是。
方案二:乙同学选用氯化镁溶液、氯化铝溶液、氢氧化钠溶液,选择依据是;乙同学设计的方案是。
(2)、铁投入 溶液中,能置换出铜;钠投入 溶液中,不能置换出铜,以此判断出钠比铁的金属性弱,这种说法是否合理? , 理由是。(3)、II.另一活动小组为了验证元素非金属性的递变规律,设计了如图所示的实验装置进行实验探究:
B装置中的X溶液是;其作用为。
(4)、能说明碳元素和硅元素非金属性强弱的实验现象是;C中反应的离子方程式为。(5)、若没有装置B,则会产生的影响是。(6)、若将分液漏斗中的硝酸改为盐酸,(填“能”或“不能”)证明非金属性 ,若能,请说明理由,若不能,请提出改进方案:。25. 实验室用无水乙酸钠和碱石灰混合共热制甲烷的方程式如下: ,为了探究甲烷的化学性质,进行了以下实验,B装置中的试剂为溴水或酸性高锰酸钾溶液,一段时间后,无水硫酸铜变蓝,澄清石灰水变浑浊,所需装置如图甲所示(部分夹持仪器已略去): (1)、装置A应选择图乙中的(填编号);B中的现象是;C装置中的试剂为。(2)、装置K中反应的离子方程式为。(3)、在光照条件下装置M中的现象为、、有白雾产生,装置H中的导管内液面上升,生成一氯甲烷的化学方程式为。(4)、反应一段时间后,装置D中硬质玻璃管内的固体变红,且测得消耗的 和CuO的物质的量之比为1:4,则装置D中硬质玻璃管内发生反应的化学方程式为。(5)、甲烷的一种同系物新戊烷的同分异构体有种,其结构简式为。26. A、B、C、D四种有机物在一定条件下的转化关系如图所示(部分反应条件已省略)。已知,A是一种植物生长调节剂,可用于催熟果实,体积分数为75%的B溶液常用于消毒杀菌,C是厨房中一种酸性调味剂的主要成分。B和C在浓硫酸和加热的条件下发生反应,生成的有机物D有特殊的香味。试回答下列问题:
(1)、装置A应选择图乙中的(填编号);B中的现象是;C装置中的试剂为。(2)、装置K中反应的离子方程式为。(3)、在光照条件下装置M中的现象为、、有白雾产生,装置H中的导管内液面上升,生成一氯甲烷的化学方程式为。(4)、反应一段时间后,装置D中硬质玻璃管内的固体变红,且测得消耗的 和CuO的物质的量之比为1:4,则装置D中硬质玻璃管内发生反应的化学方程式为。(5)、甲烷的一种同系物新戊烷的同分异构体有种,其结构简式为。26. A、B、C、D四种有机物在一定条件下的转化关系如图所示(部分反应条件已省略)。已知,A是一种植物生长调节剂,可用于催熟果实,体积分数为75%的B溶液常用于消毒杀菌,C是厨房中一种酸性调味剂的主要成分。B和C在浓硫酸和加热的条件下发生反应,生成的有机物D有特殊的香味。试回答下列问题: (1)、A的官能团名称是 , A在一定条件下与 发生反应的化学方程式为。(2)、丙烯在一定条件下与 发生反应的化学方程式为 , 判断产物中是否剩余丙烯,可将反应后的混合气体通入(填正确答案标号),然后根据现象判断。
(1)、A的官能团名称是 , A在一定条件下与 发生反应的化学方程式为。(2)、丙烯在一定条件下与 发生反应的化学方程式为 , 判断产物中是否剩余丙烯,可将反应后的混合气体通入(填正确答案标号),然后根据现象判断。A.酸性高锰酸钾溶液 B.溴水 C.澄清石灰水
(3)、B能与钠反应生成氢气,反应的化学方程式为 , 反应类型为。(4)、要除去D中混有的B、C,可加入的试剂是 , 然后通过操作分离。(5)、根据丙烯酸的结构判断,丙烯酸可能发生的反应有_______(填正确答案标号)。①中和反应 ②取代反应 ③加成反应 ④氧化反应
A、①③ B、①②③ C、①③④ D、①②③④