山东省菏泽市2021-2022学年高一下学期期中考试化学(B)试题
试卷更新日期:2022-05-19 类型:期中考试
一、单选题
-
1. 下列表示正确的是( )A、N3-的结构示意图:
 B、原子核内有8个中子的碳原子 C
C、NH3的形成过程:
B、原子核内有8个中子的碳原子 C
C、NH3的形成过程:  D、氯化氢的电子式:
D、氯化氢的电子式:  2. 三种原子的原子结构可用下图形象地表示。下列叙述正确的是( )
2. 三种原子的原子结构可用下图形象地表示。下列叙述正确的是( ) A、①②③质量数相同 B、①②③性质完全相同 C、①②③互为同位素 D、①②③分别代表H、He、Li原子3. “铷(37Rb)原子钟”是我国北斗三号全球卫星导航系统的“心脏”,被称为中国最强“心”。下列有关说法错误的是( )A、铷元素位于ⅠA族 B、铷的金属性比钠强 C、 Rb的中子数与质子数之差为11 D、 R和 R具有相同的中子数4. 下列过程是放热反应的是( )A、碳酸钙分解 B、二氧化碳与碳生成一氧化碳 C、铝与氧化铁 D、碳酸氢钠与柠檬酸反应5. 下列有关能量变化的说法正确的是( )A、化学键的变化必然会引起能量变化,能量变化也一定会引起化学变化 B、反应是放热还是吸热需看反应物和生成物具有的总能量的相对大小 C、所有放热反应的化学变化的能量都可以通过设计成原电池转化为电能 D、放热反应在常温下一定很容易发生6. 某物质在灼烧时透过蓝色钴玻璃看到火焰呈紫色,下列说法正确的是( )A、该物质是钾单质 B、该物质是钾盐 C、该物质含有钾元素 D、该物质含有钾元素,不含钠元素7. 学习元素周期律可根据事实进行推测,下列说法错误的是( )
A、①②③质量数相同 B、①②③性质完全相同 C、①②③互为同位素 D、①②③分别代表H、He、Li原子3. “铷(37Rb)原子钟”是我国北斗三号全球卫星导航系统的“心脏”,被称为中国最强“心”。下列有关说法错误的是( )A、铷元素位于ⅠA族 B、铷的金属性比钠强 C、 Rb的中子数与质子数之差为11 D、 R和 R具有相同的中子数4. 下列过程是放热反应的是( )A、碳酸钙分解 B、二氧化碳与碳生成一氧化碳 C、铝与氧化铁 D、碳酸氢钠与柠檬酸反应5. 下列有关能量变化的说法正确的是( )A、化学键的变化必然会引起能量变化,能量变化也一定会引起化学变化 B、反应是放热还是吸热需看反应物和生成物具有的总能量的相对大小 C、所有放热反应的化学变化的能量都可以通过设计成原电池转化为电能 D、放热反应在常温下一定很容易发生6. 某物质在灼烧时透过蓝色钴玻璃看到火焰呈紫色,下列说法正确的是( )A、该物质是钾单质 B、该物质是钾盐 C、该物质含有钾元素 D、该物质含有钾元素,不含钠元素7. 学习元素周期律可根据事实进行推测,下列说法错误的是( )选项
事实
推测
A
钠与氧气反应比锂与氧气反应剧烈
钾与氧气反应比钠剧烈
B
Al2O3与强酸、强碱能反应,P2O5与强碱反应
SiO2与强碱能反应
C
Si是半导体材料,Ge也是半导体材料
ⅣA族的元素都是半导体材料
D
HCl在1500℃时分解,HI在230℃时分解
HBr的分解温度介于二者之间
A、A B、B C、C D、D8. 某元素R的最高正化合价与最低负化合价的绝对值之差为4,R的最高价氧化物的水化物的化学式为( )A、H2RO3 B、HRO3 C、H3RO4 D、H2RO49. 下图装置能够组成原电池且电池总反应是Zn+Cu2+=Zn2++Cu的是( )A、 B、
B、 C、
C、 D、
D、 10. 工业合成氨的反应为:N2+3H2 2NH3 , 该反应在一定条件下的密闭容器中进行。下列关于该反应的说法正确的是( )A、达到平衡时,反应速率 (正)= (逆)=0 B、当N2、H2、NH3的浓度比为1∶3∶2时,说明反应达到平衡 C、使用催化剂可同时加快正、逆反应速率,提高生产效率 D、若在密闭容器加入1mol N2和足量H2 , 最多能生成2mol NH311. 下列实验装置,不能达到相应实验目的的是( )
10. 工业合成氨的反应为:N2+3H2 2NH3 , 该反应在一定条件下的密闭容器中进行。下列关于该反应的说法正确的是( )A、达到平衡时,反应速率 (正)= (逆)=0 B、当N2、H2、NH3的浓度比为1∶3∶2时,说明反应达到平衡 C、使用催化剂可同时加快正、逆反应速率,提高生产效率 D、若在密闭容器加入1mol N2和足量H2 , 最多能生成2mol NH311. 下列实验装置,不能达到相应实验目的的是( )选项
A
B
C
D
实验装置




实验目的
从碘水中萃取碘
灼烧海带
证明还原性Zn>Cu
证明S、C、Si的非金属性强弱
A、A B、B C、C D、D12. 一定条件下,等物质的量的SO2和O2在容积为2L的恒容密闭容器中发生如下反应2SO2+O2 2SO3该反应放热,下图表示该反应过程中O2的物质的量随反应时间(t)的变化。下列叙述正确的是( ) A、10s末SO2的物质的量浓度为3mol/L B、10s内反应的平均速率为v(O2)=0.05mol·L-1·s-1 C、a点对应的化学反应速率:2v正(SO2)=v逆(O2) D、当反应达到平衡时,升高温度,正反应速率减小,逆反应速率增大,平衡移动
A、10s末SO2的物质的量浓度为3mol/L B、10s内反应的平均速率为v(O2)=0.05mol·L-1·s-1 C、a点对应的化学反应速率:2v正(SO2)=v逆(O2) D、当反应达到平衡时,升高温度,正反应速率减小,逆反应速率增大,平衡移动二、多选题
-
13. 已知X、Y、Z均为短周期的元素,X、Y同周期,X、Z的最低价离子分别为X2-和Z- , Y2+和Z-具有相同的电子层结构,下列说法正确的是( )A、离子半径:X2->Z->Y2+ B、原子序数Y>X>Z C、气态氢化物的稳定性:H2X<HZ D、Z元素的最高正价为+7价14. N2与O2生成NO是自然界固氮的重要方式之一,下图显示了该反应中的能量变化。
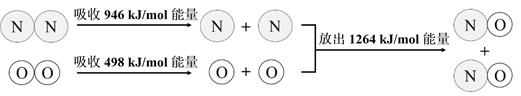
下列说法正确的是( )
A、N≡N键的键能大于O=O键的键能 B、完全断开1mol NO中的化学键需吸收1264kJ能量 C、该反应中产物所具有的总能量高于反应物所具有的总能量 D、生成1mol NO气体反应吸收180kJ能量15. 氢氧燃料电池可以使用在航天飞机上,其反应原理如图。下列有关氢氧燃料电池的说法错误的是( ) A、该电池工作时化学能转化为电能 B、该电池工作时OH-向b极移动 C、外电路中电子由电极a通过导线流向电极b D、a极的电极反应是H2-2e-=2H+
A、该电池工作时化学能转化为电能 B、该电池工作时OH-向b极移动 C、外电路中电子由电极a通过导线流向电极b D、a极的电极反应是H2-2e-=2H+三、综合题
-
16. 下表是元素周期表的一部分,请参照元素①~⑨在表中的位置,回答下列问题:
 (1)、③在元素周期表中的位置是 , ⑨的一种核素的中子数是20,表示该核素的符号是。(2)、③、⑤、⑧三种元素的离子半径由大到小的顺序是(用离子符号表示)。①分别与④、⑨形成化合物的稳定性强弱的顺序是(用化学式表示)。(3)、①、③、⑤形成的化合物中含有化学键的类型是;写出①、②和⑨形成的盐的电子式。(4)、⑤和⑦的最高价氧化物对应的水化物发生反应的离子方程式是。(5)、下列事实能判断⑤和⑥的金属性强弱的是(填字母)。
(1)、③在元素周期表中的位置是 , ⑨的一种核素的中子数是20,表示该核素的符号是。(2)、③、⑤、⑧三种元素的离子半径由大到小的顺序是(用离子符号表示)。①分别与④、⑨形成化合物的稳定性强弱的顺序是(用化学式表示)。(3)、①、③、⑤形成的化合物中含有化学键的类型是;写出①、②和⑨形成的盐的电子式。(4)、⑤和⑦的最高价氧化物对应的水化物发生反应的离子方程式是。(5)、下列事实能判断⑤和⑥的金属性强弱的是(填字母)。a.最高价氧化物对应的水化物的碱性强弱
b.常温下单质与水反应置换出氢的难易程度
c.相同温度下,最高价氧化物对应的水化物的溶解度大小
d.单质的硬度、熔点高低
17. A、B、C、D、E是五种原子序数逐渐增大的短周期元素;A元素最外层电子数是次外层电子数的2倍;C的单质在加热时与B的单质充分反应,生成淡黄色的固体,此淡黄色固体能与AB2反应可生成B的单质;D与B同主族。请回答下列问题:(1)、写出元素名称A , D。(2)、E元素的离子结构示意图。(3)、B单质与C单质生成的淡黄色固体是 , 写出该固体与AB2反应可生成B单质的化学方程式。(4)、C与D能形成2∶1的化合物,用电子式表示该化合物的形成过程。(5)、设计简单实验证明元素D与元素E非金属性的强弱。(无机试剂任选)18. 某小组同学在室温下对“碘钟实验”的原理进行探究。已知:“碘钟实验”的总反应的离子方程式为:H2O2+2S2O +2H+=S4O +2H2O。
反应分两步进行:
反应A:……
反应B:I2+2S2O =2I-+S4O
(1)、反应A的离子方程式是。对于总反应I-的作用是。(2)、为证明反应A、B的存在,进行下列实验:向酸化的H2O2溶液中加入KI溶液和 , 溶液变为蓝色;再向蓝色溶液中加入 , 看到的现象,则证明存在反应A和B。(可供选择的试剂:0.01mol/L的H2O2、0.01mol/L H2SO4、0.01mol/L KI、0.01mol/L Na2S2O3、淀粉溶液)(3)、为探究溶液变蓝快慢的影响因素,进行对比实验(溶液浓度均为0.01mol/L)H2O2
H2SO4
Na2S2O3
KI(淀粉)
H2O
溶液变蓝色的时间
实验甲
5
4
8
3
0
30min
实验乙
a
2
8
3
b
40min
实验丙
4
4
9
3
0
溶液始终无明显颜色变化
①实验甲、实验乙其他条件不变只改变一个变量,a、b所对应的数值分别是。对比实验甲、实验乙,可得出的实验结论是。
②结合“碘钟实验”总反应方程式及反应A与反应B速率的相对快慢关系,解释实验丙未产生颜色变化的原因。
19. 我国提出2030年实现“碳达峰”,2060年实现“碳中和”,CO2的再利用成为热门话题。工业上可用CO2来生产燃料甲醇(CH3OH,无色液体),实验室模拟该过程,在体积为2L的密闭容器中,充入2mol CO2和6mol H2 , 一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示: (1)、t1时刻,正、逆反应速率大小:v(正)(填“>”“=”或“<”)v(逆),达到平衡的点为时刻(填选项)。
(1)、t1时刻,正、逆反应速率大小:v(正)(填“>”“=”或“<”)v(逆),达到平衡的点为时刻(填选项)。a.t1 b.4min c.10min
(2)、在0min到4min时间段,v(H2)=mol·L-1·min-1;从开始到平衡,CH3OH的平均反应速率v(CH3OH)=mol·L-1·min-1。(3)、下列措施能增大反应速率的是_______(填字母)。A、升高温度 B、扩大容器体积 C、充入一定量氦气 D、加入催化剂(4)、能说明上述反应达到平衡状态的是(填字母)。a.3v正(H2)=v逆(CH3OH)
b.H2的体积分数不再变化
c.容器内气体的压强不随时间的变化而变化
d.单位时间内,每生成1mol CH3OH,同时生成3mol H2
e.c(CO2):c(H2):c(CH3OH):c(H2O)=1:3:1:1
20. 现有反应:A.2H2O2 H2O+O2↑
B.Fe+H2SO4=FeSO4+H2↑
C.Na2CO3·10H2O与NH4NO3反应制作冷敷袋
D.2KOH+H2SO4=K2SO4+2H2O
(1)、上述四个反应过程中能量变化符合如图甲的是(填序号)。 (2)、上述四个反应中可用于设计成如图乙的原电池的反应是(填反应序号)。根据该原电池回答下列问题:
(2)、上述四个反应中可用于设计成如图乙的原电池的反应是(填反应序号)。根据该原电池回答下列问题:①负极反应式为;正极发生(填“氧化”或“还原”)反应。
②当导线中有2mol电子通过时,理论上发生的变化是(填序号)。
a.溶液增重56g b.溶液增重54g c.析出1g H2 d.析出11.2L H2(标准状况)
 (3)、FeCl3常用于腐蚀印刷电路铜板(2FeCl3+Cu=2FeCl2+CuCl2),请将此反应设计成原电池,请根据图乙画出该原电池的装置图,注明电极材料,电解质溶液,电子流向。
(3)、FeCl3常用于腐蚀印刷电路铜板(2FeCl3+Cu=2FeCl2+CuCl2),请将此反应设计成原电池,请根据图乙画出该原电池的装置图,注明电极材料,电解质溶液,电子流向。