广东省广州市白云区2022年中考一模化学试题
试卷更新日期:2022-05-18 类型:中考模拟
一、单选题
-
1. 垃圾分类从我做起。废旧金属属于( )A、
 可回收物
B、
可回收物
B、 有害垃圾
C、
有害垃圾
C、 厨余垃圾
D、
厨余垃圾
D、 其他垃圾
2. 医用外科口罩,以聚丙烯[(C3H6)n](n约为103~104)为主要原料,对细菌、病毒有很强的阻隔作用。下列说法错误的是( )
其他垃圾
2. 医用外科口罩,以聚丙烯[(C3H6)n](n约为103~104)为主要原料,对细菌、病毒有很强的阻隔作用。下列说法错误的是( ) A、用过的口罩应集中处理、销毁 B、对细菌、病毒的阻隔属于物理变化 C、聚丙烯的相对分子质量是42 D、聚丙烯是有机合成材料3. 葡萄糖酸钙是常用的补钙剂,其化学式为Ca(C6H11O7)2。下列关于葡萄糖酸钙的说法正确的是( )A、钙是人体必需的微量元素 B、葡萄糖酸钙中氢元素的质量分数最小 C、由49个原子构成 D、钙元素、氧元素的质量比为1:144. 乙醇是一种清洁能源。科学家利用新型催化剂。将二氧化碳转化为液态燃料乙醇。反应的微观示意图如图。下列说法错误的是( )
A、用过的口罩应集中处理、销毁 B、对细菌、病毒的阻隔属于物理变化 C、聚丙烯的相对分子质量是42 D、聚丙烯是有机合成材料3. 葡萄糖酸钙是常用的补钙剂,其化学式为Ca(C6H11O7)2。下列关于葡萄糖酸钙的说法正确的是( )A、钙是人体必需的微量元素 B、葡萄糖酸钙中氢元素的质量分数最小 C、由49个原子构成 D、钙元素、氧元素的质量比为1:144. 乙醇是一种清洁能源。科学家利用新型催化剂。将二氧化碳转化为液态燃料乙醇。反应的微观示意图如图。下列说法错误的是( ) A、反应前后都是混合物 B、反应前后有2种氧化物 C、若有44g二氧化碳反应,则生成氧气48g D、以上为置换反应5. 下列选项中,利于培养化学学科核心素养的是( )A、变化与守恒:某物质R燃烧后生成CO2和H2O,则R中一定含C,H,O元素 B、模型与推理:碱中含有OH- , 所以Cr(OH)SO4是碱类 C、宏观与微观:品红在水中扩散,说明分子总在不停地运动 D、探究与创新:探究红砖粉是否为过氧化氢分解的催化剂,只需设计实验证明红砖粉能否改变反应速率即可6. 端午节是我国重要的传统节日之一,包粽子是家庭劳动的项目。以下说法正确的是( )A、“粽子香,香厨房。艾叶香,香满堂”香飘满堂说明分子的体积和质量都很小 B、粽子馅料可用多种食材,包括糯米、瘦肉、蛋黄等,其中富含糖类的是蛋黄 C、以上粽子的馅料中,缺乏的营养素之一是维生素 D、粽子馅料需要用含碘盐腌制一段时间,碘元素可预防贫血7. 一定温度下,对固体甲的溶液进行恒温蒸发,实验记录如下:
A、反应前后都是混合物 B、反应前后有2种氧化物 C、若有44g二氧化碳反应,则生成氧气48g D、以上为置换反应5. 下列选项中,利于培养化学学科核心素养的是( )A、变化与守恒:某物质R燃烧后生成CO2和H2O,则R中一定含C,H,O元素 B、模型与推理:碱中含有OH- , 所以Cr(OH)SO4是碱类 C、宏观与微观:品红在水中扩散,说明分子总在不停地运动 D、探究与创新:探究红砖粉是否为过氧化氢分解的催化剂,只需设计实验证明红砖粉能否改变反应速率即可6. 端午节是我国重要的传统节日之一,包粽子是家庭劳动的项目。以下说法正确的是( )A、“粽子香,香厨房。艾叶香,香满堂”香飘满堂说明分子的体积和质量都很小 B、粽子馅料可用多种食材,包括糯米、瘦肉、蛋黄等,其中富含糖类的是蛋黄 C、以上粽子的馅料中,缺乏的营养素之一是维生素 D、粽子馅料需要用含碘盐腌制一段时间,碘元素可预防贫血7. 一定温度下,对固体甲的溶液进行恒温蒸发,实验记录如下:
根据上述实验,不能得到的结论是( )
A、①②溶液为不饱和溶液 B、固体甲在该温度下的溶解度为15g C、固体甲的溶解度随温度的升高而增大 D、①~④溶液的溶质质量分数:①<②<③=④8. 据图示判断X、Y、Z三种金属与氢的活动性由强到弱的顺序是( ) A、X>H>Y>Z B、Y>Z>X>H C、Z>Y>X>H D、X>H>Z>Y9. 下列说法错误的是( )A、空气中氧气和氮气的体积比约为1:4 B、工业分离液态空气时发生化学变化 C、食品在空气中因与氧气发生缓慢氧化而变质 D、氦气代替氢气充气球更安全10. 利用如图所示步骤进行实验,其中能达到实验目的的是( )
A、X>H>Y>Z B、Y>Z>X>H C、Z>Y>X>H D、X>H>Z>Y9. 下列说法错误的是( )A、空气中氧气和氮气的体积比约为1:4 B、工业分离液态空气时发生化学变化 C、食品在空气中因与氧气发生缓慢氧化而变质 D、氦气代替氢气充气球更安全10. 利用如图所示步骤进行实验,其中能达到实验目的的是( )
实验目的
实验步骤
A.将20g20%的氯化钠溶液配制成10%的溶液
①加入20g20%的氯化钠溶液;②加入40g水;③搅拌
B.鉴别软水
①取少量样品;②滴入适量肥皂水;③搅拌,出现较多浮渣
C.验证KCl不能无限溶解
20℃时,①加入50g水;②加入9gKCl搅拌;③加入8gKCl搅拌(已知:20℃时,KCl的溶解度为34g)
D.配制50g溶质质量分数为5%的氯化钠溶液
①加入2.5gNaCl;②加入47.5g水;③搅拌至全部溶解
A、A B、B C、C D、D11. 化学兴趣小组设计如下图所示的装置测定空气中氧气的含量。胶头滴管中的水滴入生石灰一段时间后,试管内的白磷(白磷的着火点为40℃)开始燃烧,待白磷熄灭并冷却至室温后打开弹簧夹。下列关于该实验的说法错误的是( ) A、试管中的细沙可防止试管炸裂 B、胶头滴管中的水和注射器中的水作用相同 C、若实验测得氧气的体积分数偏低可能是试管中白磷的量不足 D、若注射器中的水最终减少了10mL,说明空气中氧气的体积分数约为20%12. 下列说法正确的是( )A、C60由分子构成 B、利用活性炭的吸附性,可以软化硬水 C、二氧化碳不能供给呼吸,是空气污染指数的项目 D、一氧化碳能结合生物体的白细胞使生物体缺氧中毒13. 下列实验能达到实验目的的是( )
A、试管中的细沙可防止试管炸裂 B、胶头滴管中的水和注射器中的水作用相同 C、若实验测得氧气的体积分数偏低可能是试管中白磷的量不足 D、若注射器中的水最终减少了10mL,说明空气中氧气的体积分数约为20%12. 下列说法正确的是( )A、C60由分子构成 B、利用活性炭的吸附性,可以软化硬水 C、二氧化碳不能供给呼吸,是空气污染指数的项目 D、一氧化碳能结合生物体的白细胞使生物体缺氧中毒13. 下列实验能达到实验目的的是( )选项
物质
目的
主要实验过程
A
MnO2、KCl固体
分离
加水溶解、过滤、洗涤滤渣
B
H2中混有HCl气体
除杂
通入饱和碳酸钠溶液
C
NaOH 溶液混有Na2CO3
除杂
滴加适量的Ca(NO3)2溶液,过滤
D
氢氧化钠、硝酸铵
鉴别
取样于试管中,分别加入适量的水,振荡
A、A B、B C、C D、D14. 下列实验操作符合规范的是( )A、 当蒸发皿中出现大量固体时停止加热
B、
当蒸发皿中出现大量固体时停止加热
B、 检查装置气密性
C、
检查装置气密性
C、 用托盘天平称量固体NaOH
D、
用托盘天平称量固体NaOH
D、 探究反应物浓度对反应速率的影响
探究反应物浓度对反应速率的影响
二、流程题
-
15. 阅读材料回答问题。(1)、CO2是最主要的温室气体,也是巨大的碳资源,CO2的低能耗捕集、转化和利用正受到世界各国的广泛关注。以CO2为原料制取炭黑的太阳能工艺如图1所示。

①反应1的基本类型为。
②反应2中碳元素的化合价(填“升高”“不变”或“降低”)。
(2)、利用Na2CO3或K2CO3溶液吸收低浓度的CO2 , 将其转化为NaHCO3或KHCO3 , NaHCO3或KHCO3受热分解生成高浓度的CO2储存利用,生成的Na2CO3或K2CO3循环使用以降低生产成本。吸收剂
Na2CO3
K2CO3
20℃最高浓度(g/L)
212
1104
价格(元/Kg)
1.25
9.80
根据表中信息,选择K2CO3溶液作吸收液的优点是。
(3)、鱼浮灵是水产养殖中常见的增氧剂,溶于水后生成Na2CO3和H2O2 , 能增加水体溶解氧的量。某课外小组用溶解氧传感器探究加入鱼浮灵时,鱼浮灵对不同水体的溶解氧量的影响。实验数据如下:水质
湖水
蒸馏水
自来水
起始溶解氧量(mg/L)
1.48
1.46
0.85
最终溶解氧量(mg/L)
3.36
3.28
2.79
溶解氧增值(mg/L)
1.88
1.82
1.94
进行实验时,不需要控制的前提条件是 。
A、常温下 B、水的体积相同 C、加入鱼浮灵质量相同 D、实验仪器相同16. 双氧水脱硫处理烟气(含SO2),并用铝灰(主要成分为Al、Al2O3以及不溶于酸的混合结渣)制备硫酸铝的主要工艺流程如下:注:除尘器的作用为除去悬浮在气体中的粉尘。
 (1)、脱硫塔中,双氧水脱硫过程发生的反应主要有:
(1)、脱硫塔中,双氧水脱硫过程发生的反应主要有:① ;
② ,
Y的化学式是。反应①和②中化合价均未发生变化的元素是。吸收6.4KgSO2能产生30%的Y溶液Kg。(保留一位小数)
(2)、用喷洒的方式注入双氧水的目的是。(3)、反应器中,生成氢气的原因是(用化学方程式解释)。(4)、上图中Z的作用是。(5)、上述流程中,烟气经过脱硫塔和设备的处理,减少了其对环境的污染。三、填空题
-
17. “宏微符”三重表征是重要的化学学科素养,请回答下列问题。(1)、《鲁滨逊漂流记》中的主人公在荒岛采用如图方法将海水淡化。
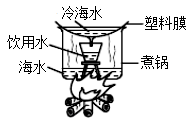
①冷海水的作用是。图中得到的饮用水属于(混合物或纯净物)。
②从微观角度分析上述过程,下列说法正确的是(填序号)。
A.蒸发时水分子体积变大
B.冷凝时水分子质量减小
C.蒸发时水分子运动速率加快
D.冷凝时水分子间隔减小
(2)、如图是稀盐酸和硝酸银反应,产生了白色沉淀,请另写一个与该反应的微观实质相同的化学方程式:。 (3)、某同学在收集满CO2的集气瓶中放入燃烧的钠,钠继续燃烧,充分反应后生成黑色的碳单质和一种白色固体。该同学认为白色固体可能是小苏打,请分析该猜想不合理的原因:。请写出钠在CO2中燃烧的化学方程式。(4)、在硫酸铜溶液中加入足量的铁钉充分反应,所得溶液质量随反应时间的变化如图,请在图上画出曲线上A、B两点所对应的溶液中存在的离子示意图,并进行必要的标注。
(3)、某同学在收集满CO2的集气瓶中放入燃烧的钠,钠继续燃烧,充分反应后生成黑色的碳单质和一种白色固体。该同学认为白色固体可能是小苏打,请分析该猜想不合理的原因:。请写出钠在CO2中燃烧的化学方程式。(4)、在硫酸铜溶液中加入足量的铁钉充分反应,所得溶液质量随反应时间的变化如图,请在图上画出曲线上A、B两点所对应的溶液中存在的离子示意图,并进行必要的标注。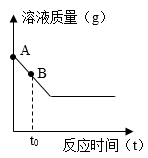
 18. N是空气中含量最高的元素。(1)、将含N物质进行分类,按要求写出化学式
18. N是空气中含量最高的元素。(1)、将含N物质进行分类,按要求写出化学式单质
引起酸雨的氧化物
酸
含氮的不同化合价的盐
N2
HNO3
(2)、镓元素的信息如图。
请设计理论上制备硝酸镓的三种方案(要求含镓原料分别属于不同的化合物类别)
方案
预期反应的化学方程式
①
②
③
(3)、若硫酸铝依晶体[NH4Al(SO4)2]·12H2O,相对分子质量453]①加热过程中,其质量随时间的变化如图所示。据此判断,从200℃到50℃间固体是否还存在结晶水,并作出解释。(是或否),。

②写出一个能与硫酸铝溶液发生反应的原子团。(写离子符号)
四、综合题
-
19. 实验室制取气体。(1)、选用药品进行对比实验。按下表进行实验,等质量的大理石加入足量酸中(杂质不与酸反应)。测得产生二氧化碳体积随着时间变化曲线如图所示:

实验编号
药品
Ⅰ
块状大理石、10%H2SO4溶液
Ⅱ
块状大理石、7%HCl溶液
Ⅲ
大理石粉末、7%HCl溶液
①图中丙对应实验(选填“Ⅰ”“Ⅱ”或“Ⅲ”)。
②不用甲对应的药品,理由是。
(2)、实验室制取多瓶氧气①组装能随意添加双氧水的装置。应选用(选单编号)。写出仪器c的名称。写出用双氧水、二氧化锰制取氧气的化学方程式。


②收集氧气。用上图装置收集时,空气从端排出。
③写出用②收集氧气验满的方法。
20. 有一包不纯的K2CO3样品,可能含有一定量的FeCl3、K2SO4、KCl、KHCO3.小明为确定其成分,取10g样品充分溶解后进行如下实验。查阅资料:碳酸氢钾可溶于水,难溶于乙醇。100℃时开始分解,200℃时完全分解,产生二氧化碳和碳酸钾等物质。
a.取少量样品于烧杯中,加入足量的水溶解,得到无色溶液A
b.取少量溶液A于试管中,滴入酚酞,溶液变红色
c.取少量溶液A于试管中,滴入足量的稀硝酸,再滴入适量氯化钡溶液,产生气泡,得到无色溶液B
d.取少量溶液B于试管中,滴入适量硝酸银溶液,有白色沉淀产生
(1)、小明发现以上步骤错误的是(填选项),正确的实验操作是 , 有白色沉淀产生。(2)、根据正确的实验操作和现象,分析上述实验过程,关于该样品的成分可以得到的结论是。(3)、设计实验方案,进一步确定该样品的成分,完成下表实验操作
预期现象与结论
若 , 则该样品含有可能存在的成分;
若 , 则该样品不含可能存在的成分。
(4)、该样品作为肥料时(能或不能)与氨态氮肥混合使用