山东省临沂市莒南县2022年中考一模化学试题
试卷更新日期:2022-05-18 类型:中考模拟
一、单选题
-
1. 关于铁的变化有:①铁丝弯曲,②铁钉生锈,③铁水铸锅,④铁丝燃烧,其中涉及化学变化的是( )A、②③ B、②④ C、③④ D、①③2. 下列用品中,主要由合成材料制成的是( )A、纯棉内衣 B、塑料笔筒 C、不锈钢刀 D、蚕丝被3. 取少量下列物质分别放入水中,充分搅拌,不能形成溶液的是( )A、食盐 B、小苏打 C、花生油 D、味精4. 全硼富勒烯团簇( )的分子结构像中国红灯笼(如图)。 属于( )

 A、单质 B、氧化物 C、酸 D、盐5. 下列关于物质用途的说法中,正确的是( )A、用碳酸氢钠作食品干燥剂 B、用熟石灰制农药 C、用亚硝酸钠烹饪食物 D、用氢氧化钠改良酸性土壤6. 化学既需要“见微知著”,又需要“见著知微”。下列分析不合理的是( )
A、单质 B、氧化物 C、酸 D、盐5. 下列关于物质用途的说法中,正确的是( )A、用碳酸氢钠作食品干燥剂 B、用熟石灰制农药 C、用亚硝酸钠烹饪食物 D、用氢氧化钠改良酸性土壤6. 化学既需要“见微知著”,又需要“见著知微”。下列分析不合理的是( )选项
宏观现象辨识
微观原因探析
A
墙内开花墙外香
分子在不停地运动
B
冰融化后体积变小
分子间间隔可以改变
C
很多果汁有酸味
这些果汁中含有氢离子
D
C60与Cl8不是同种物质
分子是保持物质性质的最小粒子
A、A B、B C、C D、D7. 动手实验是学习化学的必要途径,如图所示的实验操作中,正确的是( )A、 稀释浓硫酸
B、
稀释浓硫酸
B、 测定溶液pH
C、
测定溶液pH
C、 检查装置气密性
D、
检查装置气密性
D、 过滤
8. 下列关于H2、H2O、H2O2三种物质的说法正确的是( )A、均含有1个氢分子 B、均含有2个氢原子 C、均含有氢元素 D、均含有2个氢离子9. 下列符合“安全、健康、绿色、舒适”的生产生活理念的是( )A、煤气泄漏,开灯检查 B、明矾净水,杀菌消毒 C、植树造林,防沙降尘 D、焚烧秸秆,增肥环保10. 下列根据某些性质区分一些常见物质的方法错误的是( )A、羊毛和涤纶:灼烧闻气味 B、硫酸铵和氯化铵:加熟石灰研磨 C、软水和硬水:加入肥皂水,振荡 D、氧气和二氧化碳:伸入燃着的木条11. 2021年“祝融号”登上火星,火星拥有丰富的金属矿物和二氧化碳等资源。火星低层大气的主要成分如下表:
过滤
8. 下列关于H2、H2O、H2O2三种物质的说法正确的是( )A、均含有1个氢分子 B、均含有2个氢原子 C、均含有氢元素 D、均含有2个氢离子9. 下列符合“安全、健康、绿色、舒适”的生产生活理念的是( )A、煤气泄漏,开灯检查 B、明矾净水,杀菌消毒 C、植树造林,防沙降尘 D、焚烧秸秆,增肥环保10. 下列根据某些性质区分一些常见物质的方法错误的是( )A、羊毛和涤纶:灼烧闻气味 B、硫酸铵和氯化铵:加熟石灰研磨 C、软水和硬水:加入肥皂水,振荡 D、氧气和二氧化碳:伸入燃着的木条11. 2021年“祝融号”登上火星,火星拥有丰富的金属矿物和二氧化碳等资源。火星低层大气的主要成分如下表:气体成分
CO2
N2
Ar
O2
其他
体积分数/%
95.32
2.7
1.6
0.13
0.25
若为满足人类未来在火星上生活,下列研究不合理的是( )
A、将CO2转化为O2 , 提高O2含量 B、将CO2分解转化为N2 , 提高N2含量 C、寻找水的存在和开发水循环技术 D、利用火星上的金属矿物冶炼金属12. 科研人员制备了一种纳米催化剂,二氧化碳和水在其表面发生反应的微观示意图如图。下列说法错误的是( ) A、催化剂的化学性质在反应前后没有发生变化 B、生成物
A、催化剂的化学性质在反应前后没有发生变化 B、生成物 的化学式是
C、两种反应物的质量比为3:4
D、两种生成物的分子个数比为2:3
13. 高铁列车车体材料使用含镍不锈钢,工业上炼镍的原理之C+2NiO 2Ni+CO2↑。下列说法错误的是( )A、含镍不锈钢的硬度小于纯铁 B、火法炼镍的反应是置换反应 C、含镍不锈钢属于一种铁合金 D、火法炼镍的反应中Ni元素化合价降低了14. 类推是化学学习常用的思维方式,以下类推正确的是( )A、氧气由氧元素组成,所以制取氧气的反应物都含有氧元素 B、分子不带电,所以不带电的粒子都是分子 C、溶液是均一、稳定的,所以均一、稳定的物质都是溶液 D、单质中只含一种元素,只含一种元素的物质是单质15. 如图为氮元素的部分化合价、物质类别二维图。下列说法错误的是( )
的化学式是
C、两种反应物的质量比为3:4
D、两种生成物的分子个数比为2:3
13. 高铁列车车体材料使用含镍不锈钢,工业上炼镍的原理之C+2NiO 2Ni+CO2↑。下列说法错误的是( )A、含镍不锈钢的硬度小于纯铁 B、火法炼镍的反应是置换反应 C、含镍不锈钢属于一种铁合金 D、火法炼镍的反应中Ni元素化合价降低了14. 类推是化学学习常用的思维方式,以下类推正确的是( )A、氧气由氧元素组成,所以制取氧气的反应物都含有氧元素 B、分子不带电,所以不带电的粒子都是分子 C、溶液是均一、稳定的,所以均一、稳定的物质都是溶液 D、单质中只含一种元素,只含一种元素的物质是单质15. 如图为氮元素的部分化合价、物质类别二维图。下列说法错误的是( )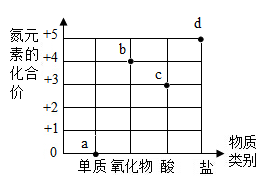 A、a点物质在空气中体积分数最高 B、b点物质属于大气污染物 C、c点物质的名称为硝酸 D、d点物质可能是复合肥料16. 碳及其部分化合物的转化关系如图所示,其中X、Y表示相应转化中的其他反应物。下列说法错误的是( )
A、a点物质在空气中体积分数最高 B、b点物质属于大气污染物 C、c点物质的名称为硝酸 D、d点物质可能是复合肥料16. 碳及其部分化合物的转化关系如图所示,其中X、Y表示相应转化中的其他反应物。下列说法错误的是( ) A、反应①不属于分解反应 B、打开碳酸饮料瓶盖时会发生反应② C、X可以是单质或氧化物 D、反应物Y可以用来检验CO217. 北宋沈括在《梦溪笔谈》中记载了用“苦泉水”制取铜的方法,其主要生产流程如图所示。下列解释合理的是( )
A、反应①不属于分解反应 B、打开碳酸饮料瓶盖时会发生反应② C、X可以是单质或氧化物 D、反应物Y可以用来检验CO217. 北宋沈括在《梦溪笔谈》中记载了用“苦泉水”制取铜的方法,其主要生产流程如图所示。下列解释合理的是( ) A、①通过蒸发溶剂可获得晶体 B、②是通过复分解反应获得铜 C、③所得硫酸铜溶液一定是饱和的 D、④说明铁元素变成了铜元素18. 某兴趣小组为探究影响化学反应速率的因素,使用等量的同种钙片和白醋开展四组实验,分别测得产生的二氧化碳浓度随时间的变化曲线如图所示。选取CO2的浓度从0~8%为研究对象,下列实验结果的分析,错误的是( )
A、①通过蒸发溶剂可获得晶体 B、②是通过复分解反应获得铜 C、③所得硫酸铜溶液一定是饱和的 D、④说明铁元素变成了铜元素18. 某兴趣小组为探究影响化学反应速率的因素,使用等量的同种钙片和白醋开展四组实验,分别测得产生的二氧化碳浓度随时间的变化曲线如图所示。选取CO2的浓度从0~8%为研究对象,下列实验结果的分析,错误的是( ) A、对比①③,温度越高,反应速率越快 B、对比②③,反应物接触面积越小,反应速率越慢 C、对比③④,反应物接触面积越大,反应速率越快 D、对比①②③④,④的反应速率最慢
A、对比①③,温度越高,反应速率越快 B、对比②③,反应物接触面积越小,反应速率越慢 C、对比③④,反应物接触面积越大,反应速率越快 D、对比①②③④,④的反应速率最慢二、填空题
-
19. 能源改变生活。
 (1)、太阳能热水器的集热器主要材料是铜,利用铜的性。(2)、风能属于 (填“可”或“不可”)再生能源。沼气的主要成分属于 (填“无机物”或“有机物”),该物质在空气中燃烧的化学方程式为。(3)、除图中所示能源外,再写一种新能源。20. “宏观辨识与微观探析”是化学学科的核心素养之一。在宏观、微观和符号之间建立联系是化学学科的重要思维方式。(1)、如图1是两个微粒的结构模型示意图,这两个微粒是否属于同种元素?(填“是”或“否”),依据是。
(1)、太阳能热水器的集热器主要材料是铜,利用铜的性。(2)、风能属于 (填“可”或“不可”)再生能源。沼气的主要成分属于 (填“无机物”或“有机物”),该物质在空气中燃烧的化学方程式为。(3)、除图中所示能源外,再写一种新能源。20. “宏观辨识与微观探析”是化学学科的核心素养之一。在宏观、微观和符号之间建立联系是化学学科的重要思维方式。(1)、如图1是两个微粒的结构模型示意图,这两个微粒是否属于同种元素?(填“是”或“否”),依据是。 (2)、如图2是元素周期表的部分内容和铝原子结构示意图,据图判断下列说法正确的有_______ (填字母)。A、表中元素都是金属元素 B、铝的相对原子质量是26.98g C、锗原子中质子数等于中子数 D、铝原子最外层3个电子能量最高21. 回答下列问题:(1)、水果和蔬菜富含的营养素是 , 该营养素可以起到调节新陈代谢等作用。(2)、钢铁在空气中锈蚀,实际上是铁跟空气中的共同作用的结果。使用稀盐酸可以去除铁锈,反应的化学方程式为。22. 我国力争在2060年前实现“碳中和”(二氧化碳的排放与吸收平衡,实现“零排放”),保护环境。实现“碳中和”通常可采取如下措施:(1)、碳减排:自然界中CO2的来源有 (任写一点)。(2)、“碳捕捉和封存”技术是实现碳中和的重要途径之一。用NaOH溶液喷淋“捕捉”空气中的CO2 , 可达到消耗CO2的目的,写出该反应的化学方程式。(3)、若CO2能合理利用,将会是一种重要的原料。CO2可用于食品保鲜,实验测得气体中的CO2体积分数与溶液pH的关系如图所示。气体中CO2体积分数增大时,造成图示变化的主要原因是溶液中 (填化学式)的浓度增大。
(2)、如图2是元素周期表的部分内容和铝原子结构示意图,据图判断下列说法正确的有_______ (填字母)。A、表中元素都是金属元素 B、铝的相对原子质量是26.98g C、锗原子中质子数等于中子数 D、铝原子最外层3个电子能量最高21. 回答下列问题:(1)、水果和蔬菜富含的营养素是 , 该营养素可以起到调节新陈代谢等作用。(2)、钢铁在空气中锈蚀,实际上是铁跟空气中的共同作用的结果。使用稀盐酸可以去除铁锈,反应的化学方程式为。22. 我国力争在2060年前实现“碳中和”(二氧化碳的排放与吸收平衡,实现“零排放”),保护环境。实现“碳中和”通常可采取如下措施:(1)、碳减排:自然界中CO2的来源有 (任写一点)。(2)、“碳捕捉和封存”技术是实现碳中和的重要途径之一。用NaOH溶液喷淋“捕捉”空气中的CO2 , 可达到消耗CO2的目的,写出该反应的化学方程式。(3)、若CO2能合理利用,将会是一种重要的原料。CO2可用于食品保鲜,实验测得气体中的CO2体积分数与溶液pH的关系如图所示。气体中CO2体积分数增大时,造成图示变化的主要原因是溶液中 (填化学式)的浓度增大。 (4)、“低碳”生活是一种生活态度,也是一种生活理念。请你写出一条生活中践行“低碳”生活的具体做法。23. 如图为甲、乙、丙三种固体物从(不形成结晶水合物)在水中随温度变化的溶解度曲线,按要求填空:
(4)、“低碳”生活是一种生活态度,也是一种生活理念。请你写出一条生活中践行“低碳”生活的具体做法。23. 如图为甲、乙、丙三种固体物从(不形成结晶水合物)在水中随温度变化的溶解度曲线,按要求填空: (1)、t1℃时,甲、乙、丙三种物质溶解度的大小关系是(用“>”,“<”或”=“表示)。(2)、t2℃时,将乙溶液的状态由N点变为M点,方法是(填一种方法即可)。(3)、t3℃时,将50 g甲放入50 g水中,充分溶解后所得溶液的质量为g。(4)、当甲中混有少量的乙,提纯甲的方法是(填“蒸发结晶“或“降温结晶”)。
(1)、t1℃时,甲、乙、丙三种物质溶解度的大小关系是(用“>”,“<”或”=“表示)。(2)、t2℃时,将乙溶液的状态由N点变为M点,方法是(填一种方法即可)。(3)、t3℃时,将50 g甲放入50 g水中,充分溶解后所得溶液的质量为g。(4)、当甲中混有少量的乙,提纯甲的方法是(填“蒸发结晶“或“降温结晶”)。三、综合题
-
24. 防疫情,测体温。体温测量仪功不可没。(1)、传统型体温计、含汞血压计将在2026年起全面禁止生产,因为汞是人体中的 (选填“必需”或“有害”)元素。汞的元素符号是。(2)、方便型——额温枪。某种额温枪的红外温度传感器所用材料含有钽酸锂(LiTaO3),钽酸锂中锂元素(Li)的化合价为+1价,则钽元素(Ta)的化合价为价。在惰性气氛中制取钽的原理为:5Na+K2TaF7=Ta+2KF+5R,则R的化学式为。(3)、快捷型——红外热成像测温仪。该测温仪可实现远距离、多目标、非接触式测温,可用于快速筛查人群中的高温个体。
①该测温仪还可用于 (填字母)。
A.测量物质溶解时的温度变化
B.分析鸡龙河水质
C.检测室内甲醛含量是否超标
②该测温仪外壳的塑料一经加工成型,受热不再熔化,是热性塑料。
25. 甲、乙两位同学分别利用下图装置研究可燃物的燃烧条件。已知:白磷的着火点为40℃,红磷的着火点为240℃。
甲同学:挤压滴管1,一段时间后,加热燃烧管至260℃以上,白磷和红磷均不燃烧。
乙同学:微热燃烧管至a℃,一段时间后,挤压滴管2,白磷迅速燃烧,而红磷不燃烧。
(1)、甲同学挤压滴管1后反应的化学方程式:。(2)、从燃烧条件角度分析,甲同学实验中白磷和红磷均不燃烧的原因是。(3)、乙同学实验能证明可燃物燃烧需要温度达到着火点,则a应选择________ (填字母序号)。A、25℃ B、80℃ C、260℃26. 为探究Fe、Cu、Mn三种金属的活动性,进行了如图所示的实验: (1)、C中可观察到明显的现象,则反应的化学方程式为(生成物中锰元素显+2价)。(2)、通过以上实验,判断三种金属的活动性由强到弱的顺序是。(3)、实验A~D中,不需要做的实验是 (填序号)。27. 如下图是氢氧化钠溶液和稀盐酸反应的图示,回答问题:
(1)、C中可观察到明显的现象,则反应的化学方程式为(生成物中锰元素显+2价)。(2)、通过以上实验,判断三种金属的活动性由强到弱的顺序是。(3)、实验A~D中,不需要做的实验是 (填序号)。27. 如下图是氢氧化钠溶液和稀盐酸反应的图示,回答问题: (1)、写出图Ⅰ反应的化学方程式:。(2)、结合图Ⅱ的微观图示,判断图Ⅲ中①代表 (用化学符号表示),若要验证反应后溶液中稀盐酸有剩余,下列操作可行的是 (填字母)。
(1)、写出图Ⅰ反应的化学方程式:。(2)、结合图Ⅱ的微观图示,判断图Ⅲ中①代表 (用化学符号表示),若要验证反应后溶液中稀盐酸有剩余,下列操作可行的是 (填字母)。A.取样,加入CuO粉末
B.取样,滴加NaOH溶液
C.取样,加入CaCO3粉末
D.取样,滴加AgNO3溶液
28. 如图是实验室常用的部分实验装置。请按要求回答问题。 (1)、选用A装置制取氧气的化学方程式为。(任写一个);(2)、若用C装置收集二氧化碳,气体应从(填"a"或"b")管进入;(3)、制气体时,用B装置代替D装置的优点是。(4)、实验时将D和E装置组合,可制取的气体有氧气和(填化学式)。29. 碳酸钙是初中阶段化学学习中的常见物质,某化学兴趣小组围绕此物质展开探究。
(1)、选用A装置制取氧气的化学方程式为。(任写一个);(2)、若用C装置收集二氧化碳,气体应从(填"a"或"b")管进入;(3)、制气体时,用B装置代替D装置的优点是。(4)、实验时将D和E装置组合,可制取的气体有氧气和(填化学式)。29. 碳酸钙是初中阶段化学学习中的常见物质,某化学兴趣小组围绕此物质展开探究。【相关信息】
①把少量泥沙放入水中搅拌,混合物里会悬浮着很多不溶于水的固体小颗粒,使液体呈浑浊状态,这种混合物叫做悬浊液。
②一定体积的溶液中,离子数目越多,其离子浓度越大;电导率传感器用于测定溶液的导电性强弱,在其他条件相同下,溶液中离子浓度越大,溶液的电导率越大。
【实验探究】在试管中加入少量碳酸钙粉末,加入2 mL水,振荡摇匀,制成碳酸钙悬浊液(如图),滴加2滴酚酞试液,酚酞试液变红。
 (1)、酚酞试液变红证明碳酸钙悬浊液显性。(2)、在相同实验条件下,用电导率传感器测得水的电导率为8.5,碳酸钙悬浊液电导率为74。与水比较,碳酸钙悬浊液中离子浓度较 (填“大”或“小”),证明在碳酸钙悬浊液中有部分碳酸钙溶于水,形成碳酸钙的 (填“饱和”或“不饱和”)溶液。(3)、小组继续探究碳酸钙悬浊液使酚酞试液变红的微观原因,做了下面的对照实验:用pH传感器分别测得在常温下五种混合体系的pH,如下表所示。
(1)、酚酞试液变红证明碳酸钙悬浊液显性。(2)、在相同实验条件下,用电导率传感器测得水的电导率为8.5,碳酸钙悬浊液电导率为74。与水比较,碳酸钙悬浊液中离子浓度较 (填“大”或“小”),证明在碳酸钙悬浊液中有部分碳酸钙溶于水,形成碳酸钙的 (填“饱和”或“不饱和”)溶液。(3)、小组继续探究碳酸钙悬浊液使酚酞试液变红的微观原因,做了下面的对照实验:用pH传感器分别测得在常温下五种混合体系的pH,如下表所示。混合体系
①Na2CO3溶液
②NaCl溶液
③CaCl2溶液
④K2CO3溶液
⑤CaCO3悬浊液
pH
11.6
7.0
7.0
11.6
10.1
从上表可知,“盐溶液一定显中性”的说法是 (填“正确”或“不正确”)的。
结合①②③④的数据分析可知, 溶液使酚酞试液变红与碳酸钠构成中离子(填离子符号)有关。查阅资料可知碳酸钠能与水发生一定程度的反应生成一种钠盐和另一种化合物,试写出此反应两种生成物的化学式:。结合⑤的数据分析。碳酸钙悬浊液使酚酞试液变色原因与碳酸钠溶液使酚酞试液变色原因本质上是一致的。
(4)、【拓展延伸】进一步探究,将碳酸钙悬浊液滴加酚酞试液加热,红色会变浅,经测定pH减小。联系所学知识,对此现象产生的原因精测合理的是_________ (填字母)。A、碳酸钙的溶解度随着温度的升高而降低 B、温度升高增大了某离子与水作用的速率,碱性增强 C、加热时部分碳酸钙发生了分解反应四、计算题
-
30. 某化学兴趣小组同学在清理实验室时发现一瓶浓盐酸标签如表。根据标签计算:
500 mL
品名:盐酸
化学式:HCl
相对分子质量:36.5
密度:1.19 g/mL
溶质质量分数:37%
(1)、HCl中氢元素和氯元素的质量比为(最简整数比表示)。(2)、要配制3700g溶质质量分数为10%的稀盐酸,需要用到这种浓盐酸和水,其中需要用水的质量为g(配制过程中不考虑浓盐酸的挥发)。31. 氢氧化钠保存不当容易变质生成碳酸钠,为测定一瓶久置的氢氧化钠的纯度,现取20.0 g样品于烧杯中加水至完全溶解,然后逐滴加入CaCl2溶液,反应过程中加入氯化钙溶液的质量与生成沉淀的质量关系如图所示(不考虑其他因素的影响)。
请根据图示和计算回答:
(1)、恰好完全反应时加入CaCl2溶液的质量为g。(2)、该样品中氢氧化钠的质量分数是多少?