广东省深圳市龙华区2021-2022学年九年级下学期学业质量监测(二模)化学试题
试卷更新日期:2022-05-16 类型:中考模拟
一、单选题
-
1. 中国传统节日,形式多样,内容丰富,是中华民族悠久历史文化的一个组成部分,下列节日传统中不涉及化学变化的是( )A、春节燃放鞭炮
 B、清明节酿美酒
B、清明节酿美酒 C、端午节包粽子
C、端午节包粽子 D、中秋节烤月饼
D、中秋节烤月饼 2. 下列化学用语正确的是( )A、氦气:He B、60个碳原子:C60 C、木炭还原氧化铜: D、氨气:NH43. 下列实验中都要用到玻璃棒,其中玻璃棒的操作相同的是( )
2. 下列化学用语正确的是( )A、氦气:He B、60个碳原子:C60 C、木炭还原氧化铜: D、氨气:NH43. 下列实验中都要用到玻璃棒,其中玻璃棒的操作相同的是( ) A、①和② B、②和③ C、②和④ D、③和④4. 2022年北京冬奥会,碲化镉发电玻璃成为绿色和科技办奥交汇的创新点。如图是碲的原子结构示意图,有关信息正确的是( )
A、①和② B、②和③ C、②和④ D、③和④4. 2022年北京冬奥会,碲化镉发电玻璃成为绿色和科技办奥交汇的创新点。如图是碲的原子结构示意图,有关信息正确的是( ) A、碲属于金属元素 B、碲的质子数为52 C、相对原子质量为127.6g D、碲元素位于第六周期5. 下列课本中的实验均作了一定的改动,改动后能达到实验目的的是( )A、
A、碲属于金属元素 B、碲的质子数为52 C、相对原子质量为127.6g D、碲元素位于第六周期5. 下列课本中的实验均作了一定的改动,改动后能达到实验目的的是( )A、 验证蜡烛燃烧有水生成
B、
验证蜡烛燃烧有水生成
B、 验证分子运动
C、
验证分子运动
C、 验证质量守恒定律
D、
验证质量守恒定律
D、 探究燃烧的条件
6. 科学家将二氧化碳与甲烷在催化剂的作用下制成化工产品乙酸,该反应的微观示意图如图所示,下列说法错误的是( )
探究燃烧的条件
6. 科学家将二氧化碳与甲烷在催化剂的作用下制成化工产品乙酸,该反应的微观示意图如图所示,下列说法错误的是( ) A、该反应可以减少温室气体的排放 B、该实验过程涉及的物质都属于有机物 C、催化剂的质量和化学性质在反应前后均不变 D、参加反应的“
A、该反应可以减少温室气体的排放 B、该实验过程涉及的物质都属于有机物 C、催化剂的质量和化学性质在反应前后均不变 D、参加反应的“ ”和“
”和“ ”的分子个数比是1:1
7. 科学思维是化学核心素养之一、根据下列证据,运用化学知识推理正确的是( )
”的分子个数比是1:1
7. 科学思维是化学核心素养之一、根据下列证据,运用化学知识推理正确的是( )证据
推理
A
电解水产生H2和O2
水由H2和O2组成
B
导气管伸入水中,手握容器外壁,有气泡冒出
装置气密性不好
C
向稀硫酸中滴加Ba(NO3)2溶液,有白色沉淀产生
稀硫酸中存在H+
D
用pH试纸测得K2CO3溶液的pH=11
K2CO3溶液呈碱性
A、A B、B C、C D、D8. 下列实验现象的描述与实际相符合的是( )A、S在空气中燃烧,发出明亮的蓝紫色火焰 B、CuSO4溶液中滴加NaOH溶液,产生蓝色沉淀 C、灼烧变黑的Cu片在H2SO4溶液中浸泡,无明显现象 D、白醋中滴加紫色石蕊溶液后,溶液由紫色变成蓝色9. 对下列事实的微观解释错误的是( )A、固体物质很难被压缩——固体的分子间没有间隔 B、CO和CO2化学性质不同——构成它们的分子不同 C、NaCl固体不导电——NaCl固体中没有自由移动的离子 D、NaOH、Ca(OH)2的溶液具有相似化学性质——溶液中都含有OH-10. 下列各项所采取的方法正确的是( )A、用闻气味的方法鉴别水、氨水 B、用带火星的木条鉴别N2、空气、O2 C、用点燃的方法除去CO2中混有的CO D、除去食盐中的蔗糖:加水溶解,再过滤11. 早在二十世纪初,我国化学家侯德榜在氨碱法制纯碱的基础上,创立了更为先进的侯氏制碱法,生产出Na2CO3的同时得到副产品NH4Cl,促进了世界制碱技术的发展。实验测得Na2CO3和NH4Cl的溶解度曲线如图所示,下列有关说法正确的是( )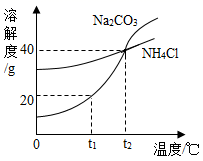 A、NH4Cl的溶解度大于Na2CO3的溶解度 B、t1℃时,100g的Na2CO3饱和溶液中含溶质20g C、t2℃时,Na2CO3和NH4Cl的饱和溶液中溶质质量分数相等 D、将t2℃时Na2CO3和NH4Cl的饱和溶液降温至t1℃,Na2CO3晶体析出的多12. 古诗《石灰吟》“千锤万凿出深山,烈火焚烧若等闲。粉骨碎身浑不怕,要留清白在人间。”后三句所描述的内容正是“钙三角”的转化过程,下列说法错误的是( )
A、NH4Cl的溶解度大于Na2CO3的溶解度 B、t1℃时,100g的Na2CO3饱和溶液中含溶质20g C、t2℃时,Na2CO3和NH4Cl的饱和溶液中溶质质量分数相等 D、将t2℃时Na2CO3和NH4Cl的饱和溶液降温至t1℃,Na2CO3晶体析出的多12. 古诗《石灰吟》“千锤万凿出深山,烈火焚烧若等闲。粉骨碎身浑不怕,要留清白在人间。”后三句所描述的内容正是“钙三角”的转化过程,下列说法错误的是( ) A、“烈火焚烧若等闲”描述的是反应①的变化 B、反应②发生时,会放出热量 C、CaO可做某些食品的干燥剂 D、反应③一定有CO2参加
A、“烈火焚烧若等闲”描述的是反应①的变化 B、反应②发生时,会放出热量 C、CaO可做某些食品的干燥剂 D、反应③一定有CO2参加二、实验题
-
13. 请结合如图装置图回答问题:
 (1)、写出仪器名称①。(2)、实验室用固体混合物制取O2 , 选择发生装置为 , 化学方程式是。选用装置E收集O2的依据是。(3)、实验室用装置BF组合制取CO2并测量收集CO2气体的体积,使用的药品是稀盐酸和(填名称)。在水面上放上一层植物油作用是。14. 九年级化学实验中,铁钉多次亮相,如图展示了一根光亮铁钉的一系列变化:
(1)、写出仪器名称①。(2)、实验室用固体混合物制取O2 , 选择发生装置为 , 化学方程式是。选用装置E收集O2的依据是。(3)、实验室用装置BF组合制取CO2并测量收集CO2气体的体积,使用的药品是稀盐酸和(填名称)。在水面上放上一层植物油作用是。14. 九年级化学实验中,铁钉多次亮相,如图展示了一根光亮铁钉的一系列变化:
 (1)、如图甲,探究铁钉生锈的条件:取4枚光亮的的铁钉,分别放入4支试管中。对比ABC的现象可知,铁的锈蚀是铁跟(填化学式)等物质作用的过程。试管中的铁钉生锈最快(填序号)。(2)、如图乙,把生锈铁钉放入过量稀盐酸中浸泡,可观察到铁锈逐渐消失,铁钉表面有气泡产生,溶液呈黄色,一段时间后黄色变为浅绿色。铁锈溶于盐酸的化学方程式是。有气泡产生反应是(填基本反应类型)。(3)、图乙实验溶液由黄色变为浅绿色,可能是因为氯化铁与某些物质发生反应所致。进行如下表的3个实验(持续10小时,已知氢气不影响该反应)。
(1)、如图甲,探究铁钉生锈的条件:取4枚光亮的的铁钉,分别放入4支试管中。对比ABC的现象可知,铁的锈蚀是铁跟(填化学式)等物质作用的过程。试管中的铁钉生锈最快(填序号)。(2)、如图乙,把生锈铁钉放入过量稀盐酸中浸泡,可观察到铁锈逐渐消失,铁钉表面有气泡产生,溶液呈黄色,一段时间后黄色变为浅绿色。铁锈溶于盐酸的化学方程式是。有气泡产生反应是(填基本反应类型)。(3)、图乙实验溶液由黄色变为浅绿色,可能是因为氯化铁与某些物质发生反应所致。进行如下表的3个实验(持续10小时,已知氢气不影响该反应)。编号
1
2
3
装置



现象
溶液始终呈黄色
产生红褐色沉淀
溶液逐渐由黄色变为浅绿色
实验分析:对比实验(填序号),说明溶液由黄色变为浅绿色需要HCl参与;对比实验1、3,说明。
实验推理:溶液一段时间后由黄色变为浅绿色,是因为在酸性条件下,氯化铁与铁发生了化合反应,写出该反应的化学方程式。
三、综合题
-
15. 某氯碱工厂以粗盐(主要成分是NaCl,含少量泥沙、CaCl2、MgCl2)为原料生产NaOH,主要的工艺流程如图所示:
 (1)、加入试剂X可把MgCl2转化为沉淀,X的化学式是。(2)、处理池中除去CaCl2的化学方程式是。(3)、电解池中电解饱和NaCl溶液化学方程式是。(4)、脱盐池是利用NaCl和NaOH在溶解度上的差异,通过、趁热过滤分离得到NaCl晶体和NaOH溶液。(5)、该工业流程中可循环利用的物质是。(写化学式)(6)、该工艺生产的NaOH样品中常含有少量NaCl、Na2CO3等杂质。你认为样品中含有Na2CO3的原因是(用化学方程式表示)。(7)、写出该工业副产品H2的一种用途。(8)、NaOH有强烈的腐蚀性,如果不慎沾到皮肤,要。16. 生活中常用的过氧乙酸和过氧化氢溶液消毒剂及其使用注意事项:
(1)、加入试剂X可把MgCl2转化为沉淀,X的化学式是。(2)、处理池中除去CaCl2的化学方程式是。(3)、电解池中电解饱和NaCl溶液化学方程式是。(4)、脱盐池是利用NaCl和NaOH在溶解度上的差异,通过、趁热过滤分离得到NaCl晶体和NaOH溶液。(5)、该工业流程中可循环利用的物质是。(写化学式)(6)、该工艺生产的NaOH样品中常含有少量NaCl、Na2CO3等杂质。你认为样品中含有Na2CO3的原因是(用化学方程式表示)。(7)、写出该工业副产品H2的一种用途。(8)、NaOH有强烈的腐蚀性,如果不慎沾到皮肤,要。16. 生活中常用的过氧乙酸和过氧化氢溶液消毒剂及其使用注意事项:消毒剂的成分
使用注意事项
过氧乙酸(主要成分CH3COOOH)消毒剂
见光或受热易分解,有腐蚀性、有灼伤危险
过氧化氢(H2O2)溶液消毒剂
(1)、下列有关上述消毒剂的分析,错误的是____。A、CH3COOOH和H2O2都是氧化物 B、都应放置于暗处密封保存 C、使用时都要谨防溅到皮肤上 D、H2O2中氧元素的化合价为-1价(2)、实验室常用溶质质量分数为10%的过氧化氢溶液制取氧气。

①某兴趣小组打算用如图1所示的整瓶溶液配制溶质质量分数为10%的过氧化氢溶液,需加水g。
②在配制过程中,他们发现试剂瓶内壁附着不少气泡,由此推断该瓶过氧化氢溶液的溶质质量分数小于30%,依据是。他们使用压强传感器等设备,检测密闭容器中不同温度下过氧化氢分解时压强的变化如图2,可知,其他条件一定时,温度越高,过氧化氢的分解速率(填“越快”“越慢”或“不变”)。
③为测定该瓶溶液的溶质质量分数,他们取35g该溶液放入锥形瓶中并加入一定量的二氧化锰。不同时间电子秤的读数如下表所示(不考虑H2O逸出):
反应时间/min
0
1
2
3
4
5
6
电子秤读数/g
340.00
338.78
335.64
335.28
335.20
335.20
335.20
请计算:该瓶过氧化氢溶液的溶质质量分数是多少?(写出计算过程,结果保留到0.1%)