天津市滨海新区2022年中考一模化学试题
试卷更新日期:2022-05-16 类型:中考模拟
一、单选题
-
1. 下列变化属于化学变化的是( )A、铁水铸成锅 B、胆矾研碎 C、石墨导电 D、钢铁生锈2. 下列气体不属于空气污染物的是( )A、二氧化碳 B、一氧化碳 C、二氧化硫 D、二氧化氮3. 人体内含量最高的金属元素是( )A、氧 B、碳 C、钙 D、铁4. 下列物质中,属于氧化物的是( )A、水 B、氧气 C、氯酸钾 D、氢氧化镁5. 测定下列溶液酸碱度,所得数值不合理的是( )A、肥皂水pH= 10 B、食用醋pH= 8 C、胃酸pH= 1 D、蒸馏水pH= 76. 下列实验操作中,正确的是( )A、滴加液体
 B、稀释浓硫酸
B、稀释浓硫酸 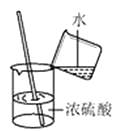 C、检查气密性
C、检查气密性  D、熄灭酒精灯
D、熄灭酒精灯 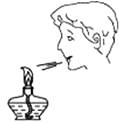 7. 催化剂是影响化学变化的因素之一。下列有关于催化剂说法正确的是( )A、催化剂只能加快化学反应速率 B、催化剂可以增加产物的质量 C、在化学反应前后催化剂性质不发生改变 D、在化学反应前后催化剂质量不发生改变8. 硼元素是核糖核酸形成的必需品。下列有关硼的说法中错误的是( )
7. 催化剂是影响化学变化的因素之一。下列有关于催化剂说法正确的是( )A、催化剂只能加快化学反应速率 B、催化剂可以增加产物的质量 C、在化学反应前后催化剂性质不发生改变 D、在化学反应前后催化剂质量不发生改变8. 硼元素是核糖核酸形成的必需品。下列有关硼的说法中错误的是( ) A、属于非金属元素 B、原子核内中子数为6 C、相对原子质量为11.00 D、最外层电子数为59. 下列关于燃烧现象的描述,正确的是( )A、铁丝在氧气中燃烧发出淡蓝色火焰 B、镁条在空气中燃烧生成白色粉末 C、红磷在空气中燃烧产生大量的白雾 D、木炭在空气中燃烧生成二氧化碳10. 在反应A + 3B= 2C + 3D中,已知2.3 g A跟B完全反应生成4.4 g C和2.7 g D.又已知B的相对分子质量为32,则C的相对分子质量为( )A、88 B、48 C、44 D、1611. 下列叙述正确的是( )A、铁制品表面的铁锈能隔绝氧气和水,阻止铁进一步被氧化 B、生成盐和水的反应一定是中和反应 C、馒头富含糖类,可以为人体提供能量 D、亚硝酸钠有咸味,可以代替食盐作调料12. 下列说法中正确的是( )A、质量相等的二氧化碳和二氧化氮中,氧元素的质量比为1︰1 B、与等质量、等质量分数稀盐酸恰好反应,所需碳酸钠和碳酸氢钠的质量比为53︰84 C、某氮的氧化物中,氮、氧元素的质量比为7︰4,则该氧化物的化学式为NO2 D、高温煅烧含碳酸钙80%的石灰石(杂质不含钙元素,且高温不分解),当剩余固体中钙元素质量分数为40%时,已分解的碳酸钙占原碳酸钙质量的64%
A、属于非金属元素 B、原子核内中子数为6 C、相对原子质量为11.00 D、最外层电子数为59. 下列关于燃烧现象的描述,正确的是( )A、铁丝在氧气中燃烧发出淡蓝色火焰 B、镁条在空气中燃烧生成白色粉末 C、红磷在空气中燃烧产生大量的白雾 D、木炭在空气中燃烧生成二氧化碳10. 在反应A + 3B= 2C + 3D中,已知2.3 g A跟B完全反应生成4.4 g C和2.7 g D.又已知B的相对分子质量为32,则C的相对分子质量为( )A、88 B、48 C、44 D、1611. 下列叙述正确的是( )A、铁制品表面的铁锈能隔绝氧气和水,阻止铁进一步被氧化 B、生成盐和水的反应一定是中和反应 C、馒头富含糖类,可以为人体提供能量 D、亚硝酸钠有咸味,可以代替食盐作调料12. 下列说法中正确的是( )A、质量相等的二氧化碳和二氧化氮中,氧元素的质量比为1︰1 B、与等质量、等质量分数稀盐酸恰好反应,所需碳酸钠和碳酸氢钠的质量比为53︰84 C、某氮的氧化物中,氮、氧元素的质量比为7︰4,则该氧化物的化学式为NO2 D、高温煅烧含碳酸钙80%的石灰石(杂质不含钙元素,且高温不分解),当剩余固体中钙元素质量分数为40%时,已分解的碳酸钙占原碳酸钙质量的64%二、多选题
-
13. 下列有关实验所选试剂及实验操作均正确的是( )
选项
实验目的
所选试剂及操作
A
除去CO2气体中的CO
通过足量灼热的氧化铜
B
除去氯化钠溶液中的氯化铜
加入过量的氢氧化钠溶液,过滤
C
除去硝酸钙溶液中的硝酸
加入过量的碳酸钙,过滤
D
除去氧化钙中的碳酸钙
加入适量的盐酸,过滤
A、A B、B C、C D、D14. 工业上制备单质镁的原理之一为:① 氧化镁与盐酸反应 MgO + 2HCl=MgCl2 + H2O;② 电解熔融氯化镁 MgCl2Mg + Cl2↑。下列判断错误的是( )A、镁元素在反应前后质量守恒 B、反应①属于置换反应 C、反应②应隔绝氧气进行 D、反应中各元素的化合价均发生改变15. X、Y、Z、W 四种物质的转化关系如图所示(“→”表示通过一步反应能实现转化),则符合要求的X、Y、Z、W 依次是( )选项
X
Y
Z
W
A
CuO
CuCl2
Cu(OH)2
CuSO4
B
HCl
Na2CO3
NaOH
H2O
C
H2O2
O2
H2CO3
H2O
D
Ba(OH)2
BaCl2
Ba(NO3)2
BaCO3

 A、A B、B C、C D、D
A、A B、B C、C D、D三、填空题
-
16. 化学与日常生活有着密切的联系,现有 ①金刚石 ②甲烷 ③氯化钠 ④小苏打,请按要求填空(填序号):(1)、在生活中可作调味剂和防腐剂的是。(2)、可用来切割玻璃的是。(3)、可用于治疗胃酸过多的是。(4)、可通过秸秆杂草发酵制备的是。17. 在宏观、微观和符号之间建立联系是化学学科的特点。(1)、写出镁离子的符号。(2)、下列符号既能表示一种物质,又能表示一个原子的是____(填序号)。A、C60 B、Ne C、2Al D、N(3)、结合下列结构示意图回答问题:

① 图中表示(填数字)种元素。
② 达到稳定结构原子的是(填序号)。
③ 在化学反应中最容易失去电子的是(填序号)。
④ 元素B与元素E形成化合物的化学式为(用B、E表示)。
(4)、下图为某化学反应的微观示意图。
根据图示写出反应的化学方程式。
18. 生产、生活离不开水。(1)、下列净化水的手段,只能除去不溶性杂质的是____(填序号)。A、吸附 B、蒸馏 C、过滤 D、消毒(2)、生活中鉴别硬水和软水选用的试剂是。(3)、我们可以从组成、结构、性质和变化等角度认识水。① 组成:电解水实验证明水是由(填元素名称)组成的。
② 结构:水分子中氢、氧原子个数比为。
③ 性质:水能与反应生成碳酸,可用来制备碳酸饮料。
④ 变化:在加热条件下,水能与镁条反应生成氢氧化镁和氢气,试写出该反应的化学方程式。
19. 写出下列反应的化学方程式:(1)、木炭充分燃烧。(2)、铁和稀盐酸反应。(3)、氢氧化钠溶液和二氧化碳反应。20. 溶液与人们的生产生活密切相关。(1)、下列物质放入水中能形成溶液的是____(填序号)。A、高锰酸钾 B、食用油 C、硝酸铵 D、玉米面(2)、下列有关溶液的说法中,正确的是____(填序号)。A、溶液是均一、稳定的混合物 B、溶质质量分数为11%的蔗糖溶液表示蔗糖与水的质量比为11︰100 C、饱和溶液一定是浓溶液,不饱和溶液不一定是稀溶液(3)、甲、乙、丙三种固体的溶解度曲线如图所示,结合图示回答问题。
① 0℃时,三种固体溶解度由大到小的顺序为。
② t2℃时,向100 g水中放入20 g乙物质,所得溶液为(填“饱和”或“不饱和”)溶液。
③ t2℃时,等质量的甲和丙的饱和溶液降温到t1℃,此时,烧杯中所得溶液的溶质质量分数(填“相等”或“不相等”)。
21. 金属在工农业生产和科技领域发挥着极其重要的作用。(1)、铁锅炒菜是利用了铁具有性。(2)、广泛应用于航空航天领域的金属材料是____(填序号)。A、铜及其合金 B、铁及其合金 C、钛及其合金(3)、将锌片放入硝酸银和硝酸亚铁的混合物中,充分反应后过滤。① 若滤液中滴加盐酸,产生白色沉淀,则滤渣中一定含有的固体为。
② 若滤渣中加入稀盐酸,有气体产生,则滤渣中一定含有的固体为。
③ 若得到的滤渣质量与所加锌单质的质量相等,则滤渣成分一共有种组合(填序号)。
A.1种 B.2种 C.3种
④ 写出锌与硝酸银反应的化学方程式。
(4)、冶炼2000 t含杂质2.7%的生铁,理论需要含氧化铁80%的赤铁矿石t。22. 酸、碱、盐在生产生活中具有广泛的用途。(1)、葡萄园常用硫酸铜和消石灰配制波尔多液,消石灰的化学式为。(2)、稀硫酸可用于印染、化肥、火药和除铁锈等。铁锈的主要成分是氧化铁,氧化铁与稀硫酸反应的现象为固体逐渐消失,无色溶液变为色。(3)、农业上常用质量分数为16%的氯化钠溶液来选种。① 配制1000g 16%的氯化钠溶液,需要量取25%的氯化钠溶液g。
② 配制过程中需要用到的仪器除了量筒、烧杯、胶头滴管、试剂瓶外,还需要。
③ 配置完毕,导致所得溶液溶质质量分数偏大的原因可能是(填序号)。
A.量取水时,采用仰视的方法读数
B.量取25%的氯化钠溶液时,采用仰视的方法读数
C.配制溶液的烧杯内残留有水
(4)、除去粗盐中难溶性杂质并计算产率,实验步骤主要有:溶解、过滤、、计算产率。四、综合题
-
23. 结合下列实验装置图,回答有关问题。
 (1)、写出仪器a和b的名称: a , b。(2)、实验室用高锰酸钾制取并收集氧气选用的装置是(填序号),写出其分解的化学方程式。(3)、在实验室制取二氧化碳的常用药品是(写名称),发生反应的化学方程式可表示为。(4)、可用装置E收集的气体具备的物理性质有。24. 某混合物中可能含有硝酸钡、氢氧化钠、氢氧化钾、氢氧化镁、碳酸钠、硫酸钠中的一种或几种,取该混合物进行如下实验(微溶物视为可溶)。结合实验现象回答问题。
(1)、写出仪器a和b的名称: a , b。(2)、实验室用高锰酸钾制取并收集氧气选用的装置是(填序号),写出其分解的化学方程式。(3)、在实验室制取二氧化碳的常用药品是(写名称),发生反应的化学方程式可表示为。(4)、可用装置E收集的气体具备的物理性质有。24. 某混合物中可能含有硝酸钡、氢氧化钠、氢氧化钾、氢氧化镁、碳酸钠、硫酸钠中的一种或几种,取该混合物进行如下实验(微溶物视为可溶)。结合实验现象回答问题。 (1)、由实验Ⅰ现象可知原混合物中一定不含。(2)、由实验Ⅲ现象可知原混合物中一定含有。(3)、测得实验Ⅴ所取稀硫酸的质量为50 g,可进一步确定原混合物中一定含有。(4)、写出硫酸钠与氯化钡反应的化学方程式。
(1)、由实验Ⅰ现象可知原混合物中一定不含。(2)、由实验Ⅲ现象可知原混合物中一定含有。(3)、测得实验Ⅴ所取稀硫酸的质量为50 g,可进一步确定原混合物中一定含有。(4)、写出硫酸钠与氯化钡反应的化学方程式。五、计算题